Paul J. Kenny
1 Laborator de Neuroștiințe Comportamentale și Moleculare, Departamentul de Terapie Moleculară, Institutul de Cercetare Scripps, Jupiter, FL 33458, SUA
Abstract
Alimentele sunt consumate pentru a menține echilibrul energetic la niveluri homeostatice. În plus, alimentele gustoase sunt consumate și pentru proprietățile sale hedonice, independent de starea energetică. Un astfel de consum legat de recompense poate duce la aportul caloric care depășește cerințele și este considerat un vinovat major al ratelor de obezitate în creștere rapidă în țările dezvoltate. În comparație cu mecanismele homeostatice de hrănire, se știe mult mai puțin despre modul în care sistemele hedonice din creier influențează consumul de alimente. În mod curios, consumul excesiv de alimente gustoase poate declanșa răspunsuri neuroadaptative în circuitele de recompensare a creierului similare cu drogurile de abuz. Mai mult, vulnerabilități genetice similare în sistemele de recompensare a creierului pot crește predispoziția la dependență de droguri și obezitate. Aici, vor fi revizuite progresele recente în înțelegerea circuitelor cerebrale care reglează aspectele hedonice ale comportamentului alimentar. De asemenea, vor fi luate în considerare și dovezile emergente care sugerează că obezitatea și dependența de droguri pot împărtăși mecanisme hedonice comune.
„Nu există o iubire mai sinceră decât iubirea de mâncare”.
Introducere
Obezitatea, definită ca un indice de masă corporală (IMC)> 30, este o afecțiune în care adipozitatea este anormal de mare și poate rezulta din hiperfagie sau scăderea ratei metabolice (O'Rahilly, 2009). Adipozitatea excesivă este un factor de risc major pentru bolile cardiovasculare, cancerul, diabetul de tip 2 și tulburările legate de dispoziție, persoanele obeze suferind adesea de stigmatizare socială (Bean și colab., 2008; Centers for Disease Control and Prevention, 2009; Luppino și colab. ., 2010). Potrivit Centrului pentru Controlul Bolilor (CDC), cheltuielile legate de obezitate pentru îngrijirea sănătății în Statele Unite între 1998 și 2000 au fost de aproximativ 213 miliarde de dolari. Mai mult, 300.000 de decese în Statele Unite în fiecare an pot fi atribuite bolilor legate de supraponderalitate și obezitate (Allison și colab., 1999), obezitatea fiind a doua cauză principală de deces prevenibil în spatele consumului de tutun. Cu toate acestea, prevalența obezității în societățile occidentale continuă să crească dramatic, estimările actuale sugerând că mai mult de 30% dintre adulții din Statele Unite sunt obezi (Flegal și colab., 2010).
Cele mai multe conceptualizări ale reglării hranei propun că două sisteme paralele interacționează pentru a influența consumul de alimente (Hommel și colab., 2006; Lutter și Nestler, 2009; Morton și colab., 2006). Sistemul homeostatic cuprinde regulatori hormonali ai nivelurilor de foame, sațietate și adipozitate, cum ar fi leptina, grelina și insulina, care acționează asupra circuitelor hipotalamice și ale trunchiului cerebral pentru a stimula sau inhiba hrănirea, pentru a menține nivelurile adecvate de echilibru energetic. Disfuncția componentelor sistemului homeostatic, cum ar fi deficiența congenitală de leptină, poate duce la o stare persistentă de echilibru energetic pozitiv și la dezvoltarea obezității (Campfield și colab., 1995; Halaas și colab., 1995; Pelleymounter și colab., 1995 ). Mecanismele prin care regulatorii hormonali ai foamei și satietății acționează asupra circuitelor hipotalamice și ale tulpinilor cerebrale pentru a menține homeostazia energetică au fost descrise în detaliu în altă parte, iar cititorii interesați de acest subiect sunt menționați la numeroasele recenzii excelente pe acest subiect (de exemplu, Abizaid et. al., 2006a; Gao și Horvath, 2007).
Activarea sistemelor de recompensare a creierului ca răspuns la alimentele plăcute: interacțiuni cu regulatorii hormonali ai echilibrului energetic
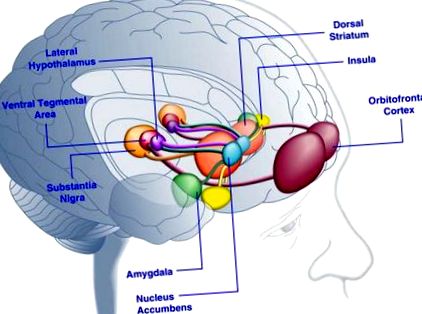
Se consideră că cortexul orbitofrontal și amigdala codifică informații legate de valoarea recompensei alimentelor (Baxter și Murray, 2002; Holland și Gallagher, 2004; Kringelbach și colab., 2003; O'Doherty și colab., 2002; Rolls, 2010) . Insula procesează informații legate de gustul alimentelor și de evaluarea hedonică a acestuia (Balleine și Dickinson, 2000; Small, 2010). Nucleul accumbens și striatul dorsal, care primesc aport dopaminergic din zona tegmentală ventrală și substantia nigra, reglează proprietățile motivaționale și stimulative ale alimentelor (Baicy și colab., 2007; Berridge, 1996, 2009; Farooqi și colab., 2007; Malik și colab., 2008; Söderpalm și Berridge, 2000). Hipotalamusul lateral poate regla răspunsurile satisfăcătoare la mâncarea plăcută și poate determina comportamente de căutare a alimentelor (Kelley și colab., 1996). Aceste structuri cerebrale acționează într-un mod concertat pentru a regla învățarea despre proprietățile hedonice ale alimentelor, schimbând atenția și efortul către obținerea recompenselor alimentare și reglând valoarea stimulativă a stimulilor de mediu care prezic disponibilitatea recompenselor alimentare (Dagher, 2009). Din motive de claritate, nu sunt prezentate toate interconectările dintre aceste structuri.
Circuite cerebrale care reglementează alimentația hedonică: sisteme de dopamină midbrain
Circuite cerebrale care reglementează alimentația hedonică: sisteme striatohipotalamice
Având în vedere influența majoră a semnalizării accumbale asupra hrănirii hedonice, Thompson și Swanson (2010) au folosit o procedură de urmărire a circuitelor pentru a identifica cu precizie rețelele anatomice precise prin care NAc poate influența consumul de alimente plăcut. În aceste studii elegante, șobolanii au primit două injecții de suprapunere anterogradă/retrogradă (denumite COIN) în siturile cojii NAc care influențează puternic consumul de alimente plăcute și au fost identificate conexiuni aferente/eferente. S-a demonstrat că siturile legate de hrănire din NAc extind proiecțiile inhibitorii predominant către LH anterior și palidul ventral (VP) (Thompson și Swanson, 2010). Spre deosebire de restul NAc, care se proiectează dens către VTA, punctele fierbinți hedonice legate de alimente din coaja NAc se proiectează către nucleul interfascicular (IFN), o structură situată adiacent VTA care extinde proiecțiile dopaminergice într-o manieră reciprocă înapoi la coaja NAc (Thompson și Swanson, 2010). Mai mult, proiectele LH anterioare către LHb (Thompson și Swanson, 2010), sugerând din nou că complexul habenular poate juca un rol în hedonica alimentelor (Friedman și colab., 2011).
Regiunea învelișului nucleului accumbens (NAc) primește inervație de la siturile cerebrale corticale și limbice și se proiectează către hipotalamusul lateral și palidul ventral. La rândul său, hipotalamusul lateral se proiectează și către palidul ventral și, de asemenea, PAG, IFN, VTA și nucleul de rafhe dorsală. IFN și rafa dorsală extind proiecțiile dopaminergice și, respectiv, serotonergice, înapoi la NAc. Hipotalamusul lateral inervează, de asemenea, structurile talamice (PVN și PON) și epitalamice (LHb). Nu sunt prezentate proiecțiile minore de la hipotalamusul lateral la zonele creierului septal. 5-HT, serotonină; IFN, nucleu interfascicular; LHb, habenula laterală; PON, nucleu preoptic; PVN, nucleu paraventricular al talamusului; VTA, zona tegmentală ventrală. Figura este adaptată cu permisiunea lui Thompson și Swanson (2010).
Circuite cerebrale care reglementează alimentația hedonică: sisteme striatopalidice
Circuite cerebrale care reglementează alimentația hedonică: sisteme amigdalare
Susținând în continuare noțiunea că aspectele consumului nonhomeostatic sunt disociabile, infuziile de naloxonă în coaja NAc sau VP, dar nu și amigdala basolaterală (BLA), au scăzut gustul soluțiilor de zaharoză (Wassum și colab., 2009). Cu toate acestea, când antagoniștii receptorilor μ-opioizi naloxonă sau CTOP au fost infuzați în BLA, dar nu în coaja NAc sau VP, a existat o atenuare marcată a motivației crescute de a răspunde pentru soluțiile de zaharoză observate de obicei într-o stare de foame (Wassum și colab., 2011; Wassum și colab., 2009). Acest lucru sugerează că proprietățile stimulente ale zaharozei sunt reglementate de circuite amigdalare. În general, constatările de mai sus arată că diferite aspecte ale consumului hedonic, cum ar fi prelucrarea informațiilor legate de gustul alimentelor, comportamentele de abordare și creșterea valorii de stimulare a alimentelor gustoase la animalele flămânde, sunt reglementate diferențial de microcircuituri discrete în contextul unei circuite corticolimbice-striatopalidice-hipotalamice-talamocorticale mai mari (Figura 2).
Efectuați adaptări în circuitele Hedonic ale creierului care conduc alimentația compulsivă?
Activitate de recompensă a creierului modificată în obezitate: studii de imagini ale creierului uman
Creșterea în greutate este asociată cu o scădere a activării striatale ca răspuns la alimentele plăcute, măsurată prin RMN, și niveluri mai scăzute ale disponibilității receptorilor de dopamină striatală D2 (D2R) la om (a se vedea textul pentru detalii).
Semnalizarea deficientă a receptorului dopamină D2 în obezitate
Semnalizarea D2R deficitară contribuie la recompensarea deficitelor de obezitate
Knockdown-ul receptorilor de dopamină D2 (D2R) knockdown în șobolanul striatum accelerează apariția disfuncției recompensei și a consumului compulsiv la șobolani cu acces extins la alimente gustoase.
Semnalizarea D2R deficitară poate declanșa alimentația compulsivă în obezitate
Obezitatea se caracterizează prin mâncarea excesivă care persistă în ciuda dorinței exprimate de a limita consumul și cunoașterea consecințelor negative profunde asupra sănătății și sociale ale consumului excesiv continuu (Booth și colab., 2008; Delin și colab., 1997; Puhl și colab., 2008) . Acest lucru este exemplificat prin faptul că mulți pacienți obezi vor fi supuși unei intervenții chirurgicale bariatrice (bypass gastric) potențial periculoase pentru a-și controla greutatea (Yurcisin și colab., 2009), dar recidivează adesea la supraalimentare, chiar dacă operația scade ratingurile subiective ale foamei și reduce capacitatea de a consuma cantități mari de alimente (Kalarchian și colab., 2002; Saunders, 2001). Dependența de droguri este definită în mod similar ca o pierdere a controlului inhibitor asupra consumului de droguri și a persistenței în obișnuință, în ciuda conștientizării consecințelor potențiale devastatoare asupra sănătății, sociale sau financiare (DSM-IV; American Psychiatric Association, 1994). Ca atare, obezitatea și dependența de droguri împărtășesc caracteristicile tulburărilor compulsive prin faptul că există un eșec vizibil în utilizarea informațiilor cu privire la viitoarele consecințe dăunătoare la consumul moderat și persistența în consum, în ciuda disponibilității unor comportamente alternative mai puțin dăunătoare.
Interacțiunile dintre D2R și regulatorii hormonali ai echilibrului energetic în obezitate
Sisteme de stres cerebral disregulat în obezitate
Pe lângă reglarea efectelor stimulilor nocivi ai mediului asupra comportamentului alimentar, CeA poate juca, de asemenea, un rol cheie în alimentația hedonică legată de stres. La om, stresul motivează puternic selectarea și consumul de alimente gustoase, cu densitate energetică, independent de necesarul caloric (Gluck și colab., 2004; Kandiah și colab., 2006; O'Connor și colab., 2008), iar obezitatea este asociată cu secreție crescută de glucocorticoizi legată de stres (Björntorp și Rosmond, 2000; la Fleur, 2006). Stresorii de mediu și sociali induc, de asemenea, hiperfagia alimentelor plăcute cu densitate energetică la rozătoare și maimuțe, cu un consum plăcut de alimente care pot atenua efectele adverse ale stresului (Dallman și colab., 2003, 2006; Pecoraro și colab., 2004; Wilson și colab., 2008). În plus, medicamentul care evocă stresul, yohimbina, poate restabili răspunsurile la căutare de alimente gustative stinse anterior (apăsarea pârghiei) la șobolani, efect atenuat de antagonistul receptorului antalarmin al factorului de eliberare a corticotropinei (CRF-1) (Ghitza și colab., 2006 ). Este important să subliniem că efectele precise ale stresului asupra consumului de alimente la om și la animalele de laborator depind de natura și amploarea factorului de stres, de tipul de alimente disponibile pentru consum (gustativ versus bland), de greutatea corporală și de sex (Dallman, 2010).
Concluzii
Mulțumiri
Autorul este susținut de subvenții de la Institutul Național pentru Abuzul de Droguri (NIDA). Autorul îi este recunoscător lui Paul Johnson și Christie Fowler pentru informații și comentarii valoroase asupra manuscrisului. Acesta este manuscrisul nr. 21042 de la Institutul de Cercetare Scripps.
- Activitatea fizică și definirea, evaluarea, prevalența și mecanismul obezității sarcopenice Viitor
- Reducerea obezității este nevoie de o viață a satului
- Pregătirea pentru Bypass gastric Ce trebuie să știți; Știri despre obezitate astăzi
- Medicamente pe bază de prescripție medicală pentru tratarea supraponderalității și a obezității Keto Infinite Accel Legal Speed Pills Diet
- Medicamente cu prescripție medicală pentru tratarea supraponderalității și obezității BioOneGen Keto Shred Stomach Fat Diet Pilula