Abstract
Scopul revizuirii
Obezitatea a devenit o epidemie mondială care determină creșterea morbidității și mortalității din cauza tulburărilor trombotice, cum ar fi infarctul miocardic, accidentul vascular cerebral și tromboembolismul venos. Prevenirea și tratamentul eficient al trombozei la pacienții obezi sunt limitate de o înțelegere incompletă a mecanismelor protrombotice subiacente și de incertitudini cu privire la riscurile, beneficiile și dozarea medicamentelor anticoagulante la această populație de pacienți.
Descoperiri recente
Această revizuire rezumă înțelegerea noastră actuală a mecanismelor stabilite și emergente care contribuie la starea protrombotică indusă de obezitate. Este evidențiat impactul mecanic al inflamației cronice și al afectării fibrinolizei în medierea trombozei asociate obezității. Datele recente care demonstrează expresia aberantă a adipokinelor și microARN-urilor, care par să funcționeze ca modulatori cheie ai căilor proinflamatorii și protrombotice în obezitate, sunt, de asemenea, revizuite. În cele din urmă, sunt discutate câteva provocări și noi abordări pentru prevenirea și gestionarea tulburărilor trombotice la pacienții obezi și supraponderali.
rezumat
Inflamația cronică condusă de obezitate și afectarea fibrinolizei par a fi mecanismele efectoare majore ale trombozei la obezitate. Efectele proinflamatorii și hipofibrinolitice ale obezității pot fi exacerbate prin exprimarea neregulată și secreția de adipokine și microARN, care cresc în continuare riscul de tromboză și sugerează noi ținte potențiale pentru terapie.
INTRODUCERE
Obezitatea a devenit o epidemie în Statele Unite. O recentă actualizare statistică a American Heart Association a estimat că prevalența obezității, definită ca un IMC mai mare de 30 kg/m 2, ajunsese la 35% în rândul adulților din SUA în 2010 [1▪]. Chiar și mai alarmant, prevalența combinată a obezității și a supraponderabilității, definită ca IMC mai mare de 25 kg/m 2, a fost estimată a fi de 68%, iar aceste cifre se așteaptă să crească în continuare. În ultimele trei decenii, prevalența obezității la copiii cu vârsta cuprinsă între 6 și 11 ani a crescut dramatic, de la mai puțin de 5% la mai mult de 20% [1▪]. Factorii care contribuie la obezitatea epidemică includ consumul crescut de calorii și scăderea activității fizice în rândul cetățenilor americani [1▪]. Prevalența la nivel mondial a obezității crește, de asemenea. Cele mai recente date de la OMS estimează că prevalența globală a obezității s-a dublat mai mult decât din 1980 [2]. În 2008, peste 1,4 miliarde de adulți erau supraponderali și aproape 500 de milioane erau obezi [2].
Un IMC ridicat este recunoscut ca un factor de risc major pentru tulburările trombotice, cum ar fi bolile cardiovasculare, accidentul vascular cerebral și tromboembolismul venos. Obezitatea este un predictor stabilit al infarctului miocardic independent de sex, vârstă și etnie [3,4]. Obezitatea este, de asemenea, asociată cu un risc crescut de accident vascular cerebral ischemic [5,6], tromboză venoasă profundă și embolie pulmonară la bărbați și femei din toate grupurile etnice [7,8▪].
Deși o asociere puternică între obezitate și boala trombotică a fost recunoscută de ceva timp, mecanismele celulare și moleculare responsabile de starea protrombotică a obezității au fugit abia recent pentru a ieși din studiile clinice și de laborator. În această revizuire, rezumăm aceste date emergente și propunem un cadru conceptual pentru munca viitoare. De asemenea, discutăm provocările actuale cu care se confruntă clinicienii în prevenirea și gestionarea tulburărilor trombotice la pacienții obezi și supraponderali.
CĂI MAJORI PROTROMBOTICE ÎN OBEZITATE
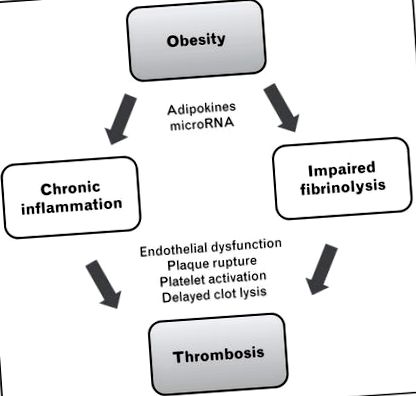
Obezitatea este asociată cu o dereglare generală a homeostaziei metabolice, rezultând rezistență la insulină, dislipidemie, modificarea reglării tensiunii arteriale și risc crescut de diabet, boli cardiovasculare, boli renale cronice și cancer [9]. Dintre nenumăratele anomalii metabolice legate de obezitate, cele două căi majore cele mai responsabile de tromboza indusă de obezitate sunt inflamația cronică și afectarea fibrinolizei (Fig. 1).
Mecanisme majore ale trombozei asociate obezității. Obezitatea favorizează inflamația cronică și afectarea fibrinolizei, ambele ducând la un risc crescut de tromboză. Efectele protrombotice ale obezității asupra căilor inflamatorii și antifibrinolitice sunt modulate sau „reglate fin” de către adipokine și microARN. Mecanismele efectoare includ disfuncția endotelială, ruperea plăcii cu expunerea factorului tisular, activarea trombocitelor și liza întârziată a cheagurilor.
Inflamație cronică
Folosind profilarea expresiei genice, Freedman și colab. [18] au demonstrat o asociere pozitivă între creșterea IMC și expresia inflamatorie a transcrierii ARNm în trombocite umane. Astfel, devine clar că trombocitele activate nu sunt doar mediatori ai trombozei asociate cu afecțiuni inflamatorii, dar pot funcționa și pentru a amplifica răspunsul inflamator în afecțiuni precum obezitate, ateroscleroză, artrită reumatoidă și sepsis [19].
În cele din urmă, afecțiunile inflamatorii, cum ar fi obezitatea, sunt asociate cu niveluri plasmatice ridicate ale anumitor factori de coagulare, cum ar fi fibrinogenul, factorul von Willebrand și factorul VIII [20]. Aceste efecte sunt probabil mediate de acțiunile citokinelor inflamatorii asupra hepatocitelor și celulelor endoteliale. Rămâne incert dacă nivelul crescut al factorilor de coagulare contribuie direct la tromboză sau sunt pur și simplu biomarkeri ai inflamației.
Fibrinoliză afectată
Fibrinoliza este un proces fiziologic critic care are ca rezultat degradarea în timp util a cheagului de fibrină de către plasmină. Rata fibrinolizei este puternic reglată de inhibitorul activatorului plasminogen-1 (PAI-1), un inhibitor al serinei proteazei care este secretat de endoteliul vascular, ficatul și țesutul adipos. PAI-1 acționează ca un inhibitor puternic, ireversibil al activatorilor de plasminogen, inclusiv activator de plasminogen tisular (tPA) și activator de plasminogen de tip urokinază (uPA). Atât tPA cât și uPA transformă plasminogenul în plasmină, favorizând astfel fibrinoliza, iar PAI-1 inhibă puternic acest proces. Expresia PAI-1 este semnificativ reglată în sus în țesutul adipos visceral în obezitate [21], iar pacienții umani cu adipozitate centrală au niveluri circulante crescute de PAI-1 [22]. Nivelurile plasmatice ale PAI-1 sunt, de asemenea, crescute la pacienții cu obezitate sau sindrom metabolic [23]. Pacienții cu IMC crescut și raportul talie-șold au niveluri ridicate de PAI-1, care pot fi inversate prin intervenții intensive de stil de viață pentru scăderea în greutate [24,25▪]. În mod interesant, TNF-α s-a demonstrat că reglează în sus expresia PAI-1 [26], ceea ce sugerează că activitatea antifibrinolitică crescută a PAI-1 este legată de starea inflamatorie cronică a obezității [27].
Asocierea dintre obezitate, niveluri ridicate de PAI-1 și tromboză a fost investigată la modelele de șoareci. La fel ca la oamenii obezi, nivelurile plasmatice ale PAI-1 sunt mai mari la șoarecii obezi comparativ cu șoarecii slabi [28]. Nagai și colab. [29] a demonstrat că deficiența PAI-1 la șoareci a dus la abrogarea completă a accelerării induse de obezitate a ocluziei arterei cerebrale medii (un model de accident vascular cerebral ischemic), sugerând că PAI-1 joacă un rol mecanic critic în promovarea efectelor protrombotice ale obezității.
MODULATORII CĂILOR TROMBOTICE ÎN OBEZITATE
După cum sa discutat mai sus și ilustrat în Fig. 1, se consideră că starea protrombotică a obezității este determinată în mare parte de inflamația cronică și de fibrinoliza afectată, care pot duce la disfuncții endoteliale, la ruperea plăcilor aterosclerotice, la hiperactivarea trombocitelor, la hipercoagulabilitate și la liza întârziată a cheagurilor. Lucrări recente au sugerat că, pe lângă conducerea acestor căi protrombotice majore, obezitatea provoacă și dereglarea mai multor factori care acționează ca modulatori sau „reglatori fini” ai echilibrului hemostatic. Principalul dintre acești modulatori sunt adipokine și microARN (miR).
Adipokine
Țesutul adipos nu este implicat doar în stocarea energiei, ci funcționează și ca un organ activ paracrin și endocrin care secretă citokine, hormoni și alți mediatori bioactivi, denumiți colectiv adipokine. În general, termenul de adipokină se referă la orice substanță bioactivă eliberată de adipocite sau alte celule rezidente adipoase, cum ar fi macrofagele și celulele stromale [30]. Unele adipokine acționează central pentru a regla apetitul și consumul de energie, în timp ce alte adipokine acționează periferic pentru a modula sensibilitatea la insulină, capacitatea oxidativă, metabolismul lipidic și funcția celulelor vasculare.
Importanța țesutului adipos ca organ endocrin a fost recunoscută pentru prima dată în 1994 cu clonarea genei leptinei [31]. Leptina este un hormon derivat din grăsimi (adipokină) care reglează atât apetitul, cât și consumul de energie. Receptorii de leptină au fost identificați în multe tipuri de celule vasculare, inclusiv celule endoteliale, macrofage și trombocite. Studiile clinice au descoperit o asociere puternică între nivelurile plasmatice de leptină și tromboza vasculară [32,33], iar studiile experimentale la animale au stabilit un rol cauzal pentru leptină în trombogeneză. Șoarecii cu deficit de leptină sau receptor de leptină sunt protejați de tromboza arterială [34]. Efectul pro-trombotic al leptinei este mediat parțial prin activarea receptorului de leptină în trombocite și celule endoteliale. Activarea mediatizată de leptină a trombocitelor umane stimulează calea de semnalizare JAK2/STAT3, promovând sinteza tromboxanului și activarea receptorului fibrinogen αIIbβ3 [35], ducând la o agregare plachetară îmbunătățită [36,37]. Efectele Leptinei asupra endoteliului vascular includ expresia reglată în sus a proteinei C reactive [38] și exacerbarea disfuncției endoteliale mediată de activitatea crescută a protein kinazei C-β urmată de scăderea producției de oxid nitric endotelial [39].
De la descoperirea leptinei, țesutul adipos a fost recunoscut ca un organ activ metabolic care poate influența homeostazia vasculară prin secreția unui număr mare de alte adipokine, inclusiv unele cu proprietăți protrombotice sau antitrombotice. În plus față de leptină, adipokinele protrombotice includ rezistină, visfatină și serina anti-fibrinolitică PAI-1 (Fig. 2). Resistina a fost numită pentru asocierea sa cu obezitatea și rezistența la insulină [40]. Rezistina poate activa direct endoteliul vascular, rezultând reglarea în sus a moleculelor de adeziune pro-trombotice și a mediatorilor inflamatori, cum ar fi MCP-1 [41]. Visfatina a fost identificată inițial ca o proteină secretată de grăsimea viscerală care imită efectele insulinei [42]. La fel ca și rezistina, visfa-staniu determină activarea celulelor endoteliale și expresia rezultată a moleculelor de adeziune protrombotice și proinflamatorii [43-46]. Expresia crescută a visfatinei în macrofagele rezidente din plăcile aterosclerotice poate promova, de asemenea, ruperea plăcii și tromboza ulterioară în arterele carotide și coronare [47].
Profil aberant de exprimare a adipokinei în obezitate. Obezitatea duce la întreruperea echilibrului dintre adipokinele protrombotice, cum ar fi leptina, inhibitorul activatorului plasminogen-1 (PAI-1), resistina și visfatina, și adipokinele antitrombotice, cum ar fi adiponectina și apelina.
microARN-urilor
miR-urile pot influența, de asemenea, expresia genelor în trombocite. Deși trombocitele circulante sunt fragmente de celule anucleate, ele conțin totuși molecule pre-ARNm, ARNm și miR reziduale care pot interacționa între ele pentru a regla expresia genelor posttranscripțional ca răspuns la activarea trombocitelor [71]. De fapt, din cauza absenței virtuale a transcripției genelor în trombocite, expresia reglată a genelor în trombocite este complet dependentă de mecanismele posttranscripționale, cum ar fi modularea miR a stabilității ARNm. Trombocitele conțin câteva sute de miR, precum și toate enzimele necesare de procesare a miR [71-74]. Într-un studiu de referință, Landry și colab. [72] a demonstrat că miR-223 reglează în jos expresia receptorului P2Y12 al trombocitelor ADP, care este ținta clopidogrelului și a altor medicamente antiplaquetare ale tienopiridinei. Nivelurile plasmatice ale miR-223 au scăzut la obezi comparativ cu persoanele slabe [64], sugerând că axa miR-223/P2Y12 poate reprezenta un mecanism cauzal al activării trombocitelor în obezitate. S-a dovedit că un alt miR, miR-96, reglează expresia proteinei-8 (VAMP8) a microtubulilor asociați cu trombocite (VAMP8), care este o componentă importantă a exocitozei granulelor plachetare [75].
PROVOCĂRI ACTUALE ȘI DIRECȚII VIITOARE PENTRU PREVENIREA ȘI GESTIONAREA TROMBOZEI LA PACIENȚII OBESI
În afară de scăderea în greutate, care inversează majoritatea efectelor protrombotice ale obezității, nu au fost dezvoltate abordări terapeutice specifice obezității pentru prevenirea sau tratarea trombozei. Mai mult, utilizarea clinică a medicamentelor anticoagulante și antiplachetare standard la pacienții obezi este limitată de o lipsă de informații despre efectele IMC crescut asupra eficacității și siguranței acestora. Majoritatea studiilor clinice care investighează medicamente antitrombotice au exclus pacienții cu obezitate și există informații relativ limitate disponibile despre proprietățile farmacocinetice ale medicamentelor antitrombotice la pacienții obezi.
PAI-1 este o altă țintă atractivă pentru terapia antitrombotică în obezitate. Fjellstrom și colab. [84▪▪] a raportat recent dezvoltarea cu succes a unui inhibitor de molecule mici de PAI-1. Mai multe alte grupuri lucrează activ și la dezvoltarea inhibitorilor PAI-1 [85], dar aceste noi medicamente nu au fost încă testate la pacienți. O altă strategie terapeutică pentru a limita producția de PAI-1 este de a viza receptorul-y activat cu proliferatorul peroxizomului (PPAR-γ), un factor de transcripție care activează un profil de expresie genică antitrombotică și antiinflamatorie [86]. Se știe că PPAR-γ antagonizează activitățile factorului nuclear de factor de transcripție proinflamator κB (NFκB) și reglează în jos expresia PAI-1. Tratamentul cu PPAR-y agonist pioglitazonă protejează de tromboza arterială la șoarecii obezi [87].
Direcționarea farmacologică a adipokinelor este un alt domeniu activ de cercetare și dezvoltare [88]. Terapia de substituție a leptinei îmbunătățește sensibilitatea la insulină și controlul glicemic la pacienții cu lipodistrofie severă și deficit de leptină [89]. În contrast, studiile clinice ale terapiei cu leptină s-au dovedit a fi în mare măsură ineficiente în tratamentul diabetului și obezității, probabil pentru că majoritatea pacienților obezi și diabetici au niveluri ridicate de leptină [90]. Există, de asemenea, îngrijorarea că tratamentul cu leptină poate crește riscul trombotic la pacienții obezi datorită efectelor sale pro-trombotice asupra trombocitelor. Strategia terapeutică alternativă a dezvoltării antagoniștilor receptorilor de leptină ar putea fi de așteptat să fie benefică în protejarea împotriva trombozei, dar are efecte metabolice dăunătoare asupra obezității și rezistenței la insulină, cu excepția cazului în care ar putea fi dezvoltați antagoniști ai receptorilor de leptină specifici pentru trombocite. Adiponectina și apelina par a fi adipokine benefice cu proprietăți antitrombotice și, prin urmare, sunt potențiale ținte terapeutice promițătoare în obezitate [91,92]. Administrarea sistemică a adiponectinei îmbunătățește funcția endotelială în arterele rezistente ale șoarecilor diabetici [93]. Apelin poate reduce producția de PAI-1 și poate promova angiogeneza terapeutică [59,94,95].
În cele din urmă, observația că miR reglează căile trombotice în obezitate sugerează o altă strategie terapeutică viitoare. Abordările potențiale includ atât îmbunătățirea acțiunilor miR prin administrarea de mimetice sintetice miR, fie reducerea la tăcere a miR-urilor endogene utilizând oligonucleotide ARN antisens („antagomiRs”) [96]. Progresele recente în tehnologiile ARN monocatenare oferă promisiuni pentru îmbunătățirea potenței și selectivității terapiei bazate pe miR [97▪▪]. În ceea ce privește tromboza, o țintă deosebit de atractivă este miR-223, care reglează în jos receptorul ADP trombocitar [72].
CONCLUZIE
Epidemia mondială de obezitate contribuie la creșterea morbidității și mortalității prin tulburări trombotice. Datele recente au condus la o mai bună înțelegere a mecanismelor protrombotice subiacente care contribuie la starea protrombotică indusă de obezitate, care includ inflamația cronică și afectarea fibrinolizei. Expresia nereglementată a adipokinelor și miR-urilor pare, de asemenea, să promoveze căile proinflamatorii și protrombotice în obezitate, crescând în continuare riscul de tromboză și sugerând noi ținte potențiale pentru terapie.
PUNCTE CHEIE
Obezitatea promovează o stare de inflamație cronică care activează căile de semnalizare protrombotice în trombocite și alte celule vasculare.
Fibrinoliza afectată, mediată în mare parte de producția crescută de PAI-1, este un factor major care contribuie la riscul trombotic la obezitate.
Utilizarea clinică eficientă a medicamentelor anticoagulante și antiplachetare la pacienții obezi este limitată de o relativă lipsă de informații despre farmacocinetică, eficacitate și siguranță.
Dovezile emergente sugerează că efectele adverse ale obezității asupra inflamației, fibrinolizei și riscului trombotic pot fi modulate de adipokine și microARN, care reprezintă ținte atractive pentru dezvoltarea medicamentelor antitrombotice.
Mulțumiri
Acest studiu este susținut parțial de subvențiile NIH HL063943 și> HL062984 și un grant de la Societatea Americană de Hematologie.
Note de subsol
Conflicte de interes
Nu există conflicte de interese
REFERINȚE ȘI CITIRE RECOMANDATĂ
Lucrările de interes special, publicate în perioada anuală de revizuire, au fost evidențiate ca:
▪ de interes special
▪ de interes remarcabil
Referințe suplimentare legate de acest subiect pot fi găsite și în secțiunea Literatură mondială actuală din acest număr (p. 480).
- Mecanisme de extindere a ariei stângi în obezitate - ScienceDirect
- Hipertrigliceridemie asociată cu arterioscleroza obezității abdominale, tromboza și vasculare
- Mass-media și tehnologie pentru a încuraja activitatea Sursa de prevenire a obezității Harvard T.
- Praful de casă legat de obezitate - dar numai la șoareci - NHS
- Stilul de viață leneș a fost învinuit pentru creșterea obezității The Independent The Independent