Abstract
fundal
Succinat dehidrogenaza (SDH) a fost asociată cu carcinogeneza în feocromocitom și paragangliom. În studiul de față am investigat componentele sistemului de fosforilare oxidativă în probele de țesut neuroblastom uman.
Metode
Măsurătorile spectrofotometrice, analiza imunohistochimică și analiza Western blot au fost utilizate pentru a caracteriza metabolismul aerob al energiei mitocondriale în neuroblastoame (NB).
Rezultate
Comparativ cu citratul sintazat mitocondrial, activitatea SDH a fost sever redusă în NB (n = 14) față de țesutul renal. Cu toate acestea, nu au putut fi identificate mutații patogene în oricare dintre cele patru subunități ale SDH. Mai mult, nu au putut fi identificate modificări genetice în cei doi factori noi de asamblare SDH SDHAF1 și SDH5. Modificări ale genelor care codifică nfs-1, frataxin și isd-11 care ar putea duce la diminuarea activității SDH nu au fost detectate în NB.
Concluzie
Deoarece a fost observată și reglarea descendentă a altor complexe ale sistemului de fosforilare oxidativă, o reducere mai generalizată a respirației mitocondriale pare să fie prezentă în neuroblastom, spre deosebire de defectul enzimatic unic găsit în feocromocitoamele ereditare.
fundal
Conform Clasificării patologice internaționale a neuroblastomului (NB), NB-urile sunt definite ca tumori embrionare ale sistemului nervos simpatic, derivă din creasta neuronală și apar în medula suprarenală, ganglionii simpatici paravertebrali și paraganglii simpatici [3.0.CO; 2-7 . "href ="/article/10.1186/1471-2407-10-149 # ref-CR1 "> 1]. Paragangliomul și feocromocitomul sunt legate histologic de NB, deoarece toate sunt derivate din creasta neuronală. NB-urile constau în principal din neuroblaste imature, în timp ce feocromocitoamele și paraganglioamele conțin celule cromafine mature.
Feocromocitoamele și paraganglioamele prezintă frecvent mutații în subunitățile succinate dehidrogenază (SDH) SDHB, SDHC, SDHD indicând faptul că aceste subunități SDH acționează ca supresoare tumorale în țesuturile neuroendocrine [2]. Complexul SDH este compus din patru subunități și conține o moleculă de flavină (FAD), centre de fier non-hem și un citocrom de tip b ca grupuri protetice. Complexul este ancorat de un SDHC mare și de o mică subunitate SDHD care alcătuiesc împreună proteina hem care se întinde pe membrană b [3]. În plus, recent s-au raportat doi factori de asamblare a SDH SDHAF1 și SDH5. SDH5 este o genă necesară pentru flavinarea SDH [4]. Mutații patogene în SDH5 au fost identificate în paraganglioame [5].
Mutațiile genelor PHOX2B și ale limfomului kinazei anaplazice (ALK) sunt legate de o predispoziție pentru neuroblastom [6-10]. Mutații în PHOX2B au fost găsite într-o minoritate a cazurilor de neuroblastom familial. Până în prezent nu a fost demonstrată nicio legătură clară cu metabolismul energetic pentru aceste două gene.
Utilizarea aerobă a glucozei ca sursă de energie prin glicoliză este o caracteristică comună pentru majoritatea tumorilor solide, ducând la rândul său la o dependență mai mică de OXPHOS, care se numește efect Warburg [25, 26]. Reglarea descendentă a OXPHOS în celulele tumorale pare a fi realizată prin diferite mecanisme. În primul rând, hipoxia profundă poate fi cauza reglării compensatorii a glicolizei în majoritatea tumorilor. În al doilea rând, devine din ce în ce mai evident că pierderea genelor supresoare tumorale precum VHL și p53 sau activarea oncogenelor are ca rezultat reglarea descendentă a OXPHOS [27, 28]. În cele din urmă, inactivarea directă a componentelor OXPHOS a fost detectată într-o minoritate de tumori. Pe lângă asocierea SDH și dezvoltarea tumorii, pierderea NADH: ubiquinonă oxidoreductază (complexul I) al lanțului respirator a fost de asemenea prezentată în tumorile oxifile [29, 30].
Scopul acestui studiu a fost de a determina dacă există modificări specifice ale metabolismului energetic aerob în NB, în special ale SDH, sau dacă există o reglare generală a complexelor OXPHOS.
Deși este în general acceptat faptul că cancerele solide prezintă, în majoritatea cazurilor, o trecere de la fosforilarea oxidativă la glicoliză, tipul de modificare nu a fost investigat în multe tipuri de cancer și, după cunoștințele noastre, nu în tumorile neuroblastice.
Metode
Mostre
NB-uri de la 14 pacienți au fost obținute de la Spitalul Universitar Salzburg, Austria și Spitalul Olga, Stuttgart, Germania. Cincisprezece țesuturi renale neafectate au servit ca referințe pentru măsurători enzimatice. Pentru studiile imunohistochimice fixate în formalină, s-au utilizat NB-uri încorporate în parafină și țesuturi suprarenale neafectate.
Studiul a fost realizat în conformitate cu legea austriacă privind tehnologia genică. Experimentele au fost efectuate în conformitate cu declarația de la Helsinki din 1975 (revizuită în 1983) și cu liniile directoare ale Comitetului de Cercetare pentru Etică al Statului Salzburg (acord etic: AZ 209-11-E1/823-2006), nefiind niciun studiu clinic cu medicamente sau investigații epidemiologice. Toți pacienții au semnat un consimțământ informat cu privire la îndepărtarea chirurgicală și terapia tumorilor. Mai mult, studiul nu s-a extins la examinarea înregistrărilor individuale de caz. Anonimatul pacienților a fost asigurat.
Toate țesuturile au fost înghețate și depozitate în azot lichid în decurs de 30 de minute după operație. Conținutul celulelor tumorale și compoziția celulară a probelor au fost evaluate utilizând secțiuni înghețate colorate cu hematoxilină-eozină. Probele de țesut cu un conținut de celule tumorale de peste 90% au fost investigate. Țesuturile tumorale slab diferențiate sau nediferențiate au fost utilizate în studiu (Tabelul 1).
Măsurători enzimatice
NB și țesuturile renale (20-100 mg) au fost omogenizate cu un dezintegrator tisular (Ultraturrax, IKA, Staufen, Germania) în tampon de extracție (20 mM Tris-HCl, pH 7,6, 250 mM zaharoză, 40 mM KCl, 2 mM EGTA) . și în cele din urmă omogenizat cu un omogenizator de sticlă din teflon acționat cu motor (Potter S, Braun, Melsungen, Germania). Omogenatul a fost centrifugat la 600 g timp de 10 min la 4 ° C. Supernatantul postnuclear (600 g omogenat) care conține fracția mitocondrială a fost utilizată pentru măsurarea activităților enzimatice și analiza Western blot. Citratul sintază a fost determinat în conformitate cu Srere [31] cu modificări. Pe scurt, amestecul de reacție conținea 50 mM Tris-HCI pH 8,1, 0,1% albumină serică bovină (BSA), 0,1% TritonX-100, 0,2 mM 5,5'-ditio-bis (acid 2-nitrobenzoic), 0,15 mM acetil- CoA și omogenizarea de 600 g. După înregistrarea inițială a activității tiolazei timp de 2 min, reacția citrat sintază a fost începută prin adăugarea de 0,5 mM oxaloacetat și a fost urmată la 412 nm timp de 8 min. Activitatea medie nespecifică a tiolazei în NB a fost de 2% din activitatea CS.
Activitățile enzimatice ale complexelor OXPHOS au fost determinate așa cum s-a descris anterior [32, 33]. Pe scurt, activitatea complexului I sensibil la rotenonă a fost măsurată spectrofotometric ca NADH/decilubiquinonă oxidoreductază la 340 nm. Activitățile enzimatice ale citratului sintază și complexului IV (ferocitocrom c/oxigenoreductază) și activitatea ATPazei sensibile la oligomicină a ATF sintazei F1F0 au fost determinate utilizând condiții tampon descrise anterior de Rustin și colab. (1994) [34]. Întregul amestec de reacție pentru măsurarea activității ATPazei a fost tratat timp de 10 secunde cu un ultra-sonifier (disruptor de celule bio 250, Branson, Viena, Austria). Activitatea SDH a fost măsurată conform lui Rustin și colab. cu următoarele modificări. Amestecul de reacție conținea 50 mM fosfat de potasiu pH 7,8, 2 mM EDTA, 0,1% BSA, 3 μM rotenonă, 80 μM 2,6-diclorofenol, 50 μM decilubiquinonă, 1 μM antimicină A, 0,2 mM ATP, 0,3 mM KCN și cei 600 g se omogenizează. Amestecul a fost preincubat timp de 10 minute la 37 ° C, a început prin adăugarea de succinat 10 mM și a fost urmat timp de 6 minute la 600 nm.
Amestecul de reacție pentru măsurarea activității complexului III conținea 50 mM tampon fosfat de potasiu pH 7,8, 2 mM EDTA pH 8,6, 0,3 mM KCN, 100 μM citocrom c, 200 μM decil-ubiquinol redus. Reacția a fost începută prin adăugarea omogenatului de 600 g. După 3-4 minute, reacția a fost inhibată prin adăugarea de 1 μM antimicină A. Activitatea insensibilă a antimicinei A a fost scăzută din activitatea totală pentru a calcula activitatea complexului III. Toate măsurătorile spectrofotometrice (Uvicon 922, Kontron, Milano, Italia) au fost efectuate la 37 ° C.
Secvențierea SDHA, SDHB, SDHC, SDHD, SDHAF1, SDH5, nfs-1, LYRM4, frataxin, PHOX2B și ALK
ADN-ul a fost izolat folosind un kit de țesuturi NucleoSpin® (Macherey-Nagel). ARN-ul a fost izolat din criosecții ale țesuturilor NB folosind Tri-Reagent ™ (Molecular Research Center Inc., Cincinnati, OH). 2 μg de ARN au fost tratați cu DNază I (Ambion, Austin, TX) și s-au transcris invers cu transcriptază inversă 140 U Superscript II (Invitrogen Corporation, Carlsbad, CA) conform instrucțiunilor producătorului. ADN genomic de 100 ng (pentru secvențierea SDHB, SDHC, SDHD, SDHAF1, SDH5, PHOX2B) sau ADNc (pentru secvențierea SDHA, frataxin, nfs1, LYRM4, ALK) au fost utilizate pentru amplificarea PCR (Tabelul 2). Produsele PCR au fost incubate cu Exo SAP IT 500 (USB Corporation), iar kitul de pornire rapidă CEQ DTCS (Beckman Coulter) a fost utilizat pentru reacția de secvențiere utilizând primerii PCR enumerați în tabelul 2, urmat de separarea cu un sistem de analiză ADN CEQ 2000 ( Beckman Coulter).
Determinarea numărului de copie ADNmt
Numărul copiei ADNmt a fost determinat așa cum s-a descris anterior [35].
Analiza Western blot
Colorarea și analiza imunohistochimică
Au fost utilizate țesuturi tumorale fixate pe formalină și înglobate în parafină. Pentru colorarea imunohistochimică s-au utilizat următorii anticorpi: subunitatea monoclonală anti-complex II de șoarece 70 kDa Fp (1: 5000; MitoSciences), subunitatea monoclonală anti-complex III de șoarece Core 2 (1: 1500; MitoSciences) și anti-porină monoclonală de șoarece Anticorpi 31HL (1: 3000; MitoSciences). Toți anticorpii au fost diluați în diluantul anticorpului Dako cu componente de reducere a fondului (Dako).
Secțiunile de 5 μm au fost deparafinizate și rehidratate, urmate de epitopul de recuperare indus de căldură în tampon TE-T (10 mM bază Tris, pH 9,0, 1 mM EDTA, 0,05% Tween 20) timp de 40 min la 95 ° C și 20 min la RT . Secțiunile au fost spălate în H2O distilat și echilibrate cu soluție salină tamponată cu fosfat conținând 0,5% Tween 20 (pH 7,4, PBS-T). Colorarea a fost efectuată folosind un sistem de detectare Envision (Dako) conform instrucțiunilor producătorului, urmată de vizualizare cu diaminobenzidină (DAB) timp de 1 min. Diapozitivele au fost contracolorate cu hematoxilină.
Rezultate
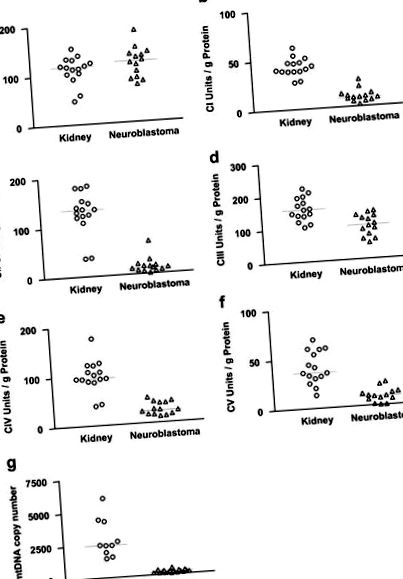
Caracteristicile celor 14 pacienți pediatrici și tumorile lor NB sunt prezentate în Tabelul 1. Activitatea citratului sintază a fost comparativ ridicată în țesuturile renale corticale normale și NB (Figura 1). Mai mult, nivelul activității citratului sintază a fost în concordanță cu nivelul porinei, determinat de colorarea imunohistochimică. Atât citratul sintază, cât și porina sunt utilizate frecvent ca proteine marker pentru masa mitocondrială. NB-urile au arătat doar o ușoară reducere a porinei în comparație cu cortexul suprarenal normal și țesutul medular suprarenal (Figura 2). Prin urmare, masele mitocondriale ale NB și țesuturilor renale normale au fost similare.
Activitatea complexelor OXPHOS în țesuturile renale normale și NB. a: citrat sintază (CS), b: complex I (CI), c: complex II (CII), d: complex III (CIII), e: complex IV (CIV), f: complex V (CV), g: numărul copiei ADNmt.
- Muscletech Vitamax Energy and Metabolism for Men SX-7 Onyx negru 120 comprimate; Nutriție Bizz
- Metabolism Bath Soak - Cele mai bune săruri de baie; O baie mai bună Un corp mai bun
- Metabolism Boost Cea mai bună cremă de slăbire
- Metabolism Boost Do Badan
- Boost Metabolism Dr Moe Recenzii privind pierderea în greutate