Departamentul de Biologie, Universitatea din Ottawa, Ottawa, Ontario, Canada
Adresa pentru cereri de reimprimare și alte corespondențe: E. Vaillancourt, Dept. de Biologie, Univ. din Ottawa, 30 Marie-Curie, Ottawa, Ontario, K1N 6N5, Canada (e-mail: [email protected]).
Departamentul de Biologie, Universitatea din Ottawa, Ottawa, Ontario, Canada
Abstract
Animale.
Cateterizări.
Calorimetre indirecte.
Alimentele au fost reținute timp de 8 ore înainte de începerea măsurătorilor pentru a obține măsurători fiabile ale ratei metabolice inițiale (prin eliminarea creșterii de căldură a alimentării) și pentru a facilita curățarea echipamentului postexperimental (2). Ratele consumului de oxigen (ṀO2) și ale producției de dioxid de carbon (ṀCO2) au fost apoi măsurate cu un sistem Oxymax calibrat (Columbus Instruments, Columbus, OH) (vezi Ref. 52 pentru detalii) conectat la un respirometru Lexan personalizat, cu dublu scop alimentat cu aer de 20 ° C la o rată de 8-12 l/min. Experimentele preliminare au arătat că gâștele rămân mai liniștite în timp ce stau pe o suprafață ușor răcită. Prin urmare, fundul detașabil al respirometrului a fost îndepărtat pentru a permite păsărilor să stea direct pe o placă de aluminiu termostatată de 60 × 60 cm, personalizată, menținută la 15 ° C folosind o baie de apă. Înlocuirea fundului plat Lexan cu placa plată din aluminiu nu a modificat volumul respirometrului și nu a afectat modul în care a funcționat.
Cinetica glucozei.
Prelevarea de țesuturi.
Nouă gâște adulte canadiene imprimate în continuare (patru bărbați și cinci femele) au fost anesteziate la fermă în decembrie 2012 folosind o injecție intramusculară de ketamină și xilazină și, în timp ce erau anesteziate, au fost eutanasiate folosind o supradoză de sodiu pentobarbital administrat intraperitoneal. Aproximativ 5 g de țesut au fost excizate rapid și au fost congelate cu ajutorul cleștelor de aluminiu pre-răcite în azot lichid. Probele de pectoralis au fost prelevate de-a lungul părții anterioare a chilei, de-a lungul întregii grosimi a mușchiului. Toate țesuturile au fost prelevate și congelate în decurs de 10 minute după moarte. Pectoralele și ficatul au fost apoi disecate din carcase, plasate în pungi de plastic etichetate și aduse înapoi la laborator unde a fost înregistrată greutatea organului (inclusiv probele congelate) pentru ambele țesuturi pentru a calcula rezervele de carbohidrați. Probele au fost depozitate la -80 ° C până la testarea concentrațiilor de carbohidrați. Pentru analiză, probele de pectoral fragil congelate au fost spulberate în bucăți mici și prelevate la întâmplare, permițând astfel măsurători reprezentative pentru întreaga grosime a mușchiului.
Concentrația de glucoză și glicogen.
Procedurile de măsurare pentru concentrația țesutului de glucoză și glicogen au fost adaptate de la Fournier și Weber (14). Pe scurt, aproximativ 1 g de țesut (pectoral, ficat) a fost măcinat fin în azot lichid cu un mortar și un pistil pre-răcit. Fiecare probă înghețată a fost cântărită și plasată în 4 volume de acid percloric 6% răcit cu gheață (PCA). După omogenizare, probele au fost centrifugate la 2.800 g timp de 10 min. Supernatanții au fost apoi alicotați în tuburi de centrifugă de 1,5 ml și depozitați la -20 ° C până la testare. Concentrația de glucoză a fost determinată în conformitate cu Bergmeyer (4). Concentrația glicogenului a fost determinată folosind amiloglucozidază (A-7095; Sigma-Aldrich, St. Louis, MO) pentru hidrolizarea glicogenului, urmată de adăugarea de 6% PCA pentru a opri reacția. Standardele de glucoză și glicogen și martorii negativi au fost utilizate în fiecare serie de teste, deoarece amiloglucozidaza conținea cantități semnificative de glucoză și/sau glicogen. Concentrațiile de glicogen tisular au fost corectate pentru această contribuție de către enzima contaminată și pentru glucoza liberă deja prezentă înainte de hidroliza glicogenului.
Analize plasmatice.
Calcule și statistici.
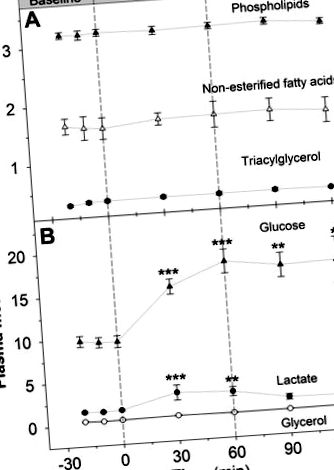
FIG. 1.Acizi grași neesterificați în plasmă (A), fosfolipid (A), triacilglicerol (A), glicerol (B), glucozaB) și lactat (B) concentrația la gâștele canadiene adulte înainte, în timpul și după perfuzia cu glucagon. * Diferență semnificativă față de valoarea inițială (P
Tabelul 1. Contribuții relative (procente de masă) ale acizilor grași individuali la totalul acizilor grași neesterificați, triacilglicerol și fosfolipide în plasma gâștelor din Canada
Valorile sunt procentul de masă al esterilor metilici ai acizilor grași, exprimat ca medii ± SE (n = 5). NEFA, acizi grași neesterificați; TAG, triacilglicerol; PL, fosfolipide; SFA, acizi grași saturați; MUFA, acizi grași mononesaturați; PUFA, acizi grași polinesaturați; DBI, indice cu dublă legătură; n.d., nedetectat; adică urme. Numai acizii grași care contribuie la> 1% din concentrația totală de acizi grași în cel puțin o fracțiune sunt tabelați. Pentru fiecare fracție, sunt, de asemenea, indicate concentrația totală (în micromoli de FA pe mililitru de plasmă), contribuțiile relative ale SFA, MUFA și PUFA, DBI și lungimea medie a lanțului de carbon. Abundența relativă a acizilor grași individuali în fiecare fracțiune lipidică nu s-a modificat odată cu perfuzia de glucagon; astfel, valorile medii pentru întregul experiment sunt prezentate aici.
Schimb de gaze.
Valorile inițiale pentru aceste gâște canadiene în repaus au fost în medie de 270 ± 22 μmol · kg −1 · min −1 (ṀO2; Fig. 2A), 213 ± 17 μmol · kg −1 · min −1 (ṀCO2; Fig. 2B) și 0,80 ± 0,06 (RER; Fig. 2C). Cu excepția unei creșteri slabe și tranzitorii a ṀO2 la 338 ± 26 μmol O2 · kg −1 · min −1 la începutul recuperării (P 0,05).
FIG. 2.Ratele consumului de oxigen (ṀO2)A), producția de dioxid de carbon (ṀCO2)B) și raportul de schimb respirator (RER)C) de gâște canadiene adulte înainte, în timpul și după perfuzia cu glucagon. * Semnificativ diferit de valoarea inițială (P
Oxidarea combustibililor metabolici.
Rata inițială de oxidare a lipidelor și a carbohidraților a fost de 145 ± 59 și, respectiv, de 72 ± 48 μmol O2 · kg -1 -1 min -1, respectiv. Acești parametri au rămas neafectați de glucagon (P > 0,05). Contribuțiile relative inițiale ale oxidării lipidelor și carbohidraților la ṀO2 au fost 51,4 ± 22,3% și, respectiv, 28,7 ± 21,4%. Ambii parametri au rămas neafectați de glucagon (Fig. 3B; P > 0,05).
FIG. 3.Tarife (A) și contribuția relativă la ṀO2 (B) de oxidare a lipidelor și carbohidraților (CHO) la gâștele canadiene adulte înainte, în timpul și după perfuzia cu glucagon. Valorile sunt exprimate ca medii ± SE (n = 5).
Cinetica glucozei.
Activitatea inițială specifică glucozei la starea de echilibru izotopică a fost de 107 ± 11 Bq/μmol. Activitatea specifică a scăzut în decurs de 30 de minute de la inițierea perfuziei de glucagon și a rămas sub valoarea inițială în timpul recuperării (Fig. 4A; P −1 · min −1. Mobilizarea glucozei a fost deja stimulată după 30 de minute de perfuzie cu glucagon și a rămas cu aproximativ 50% peste valoarea inițială până la sfârșitul experimentului (Fig. 4B; P −1 · min −1 după 30 de minute de recuperare.
FIG. 4.Activitate specifică glucozei plasmatice (A) și rata de mobilizare (B) la gâștele canadiene adulte înainte, în timpul și după perfuzia cu glucagon. Rețineți că, la starea de echilibru, mobilizarea glucozei este sinonimă cu fluxul de glucoză, rata de rotație a glucozei (Rt), producția de glucoză hepatică și rata de apariție (Ra) de glucoză. *** Diferențe semnificative față de valoarea inițială (P
Contribuția relativă a glucozei ca combustibil oxidativ.
S-au făcut calcule pentru a determina contribuția potențială a oxidării glucozei la rata metabolică totală (ṀO2) utilizând două ipoteze diferite: fie că 50%, fie că 100% din fluxul de glucoză a fost oxidat. Studiile la mamifere arată că, în repaus, doar aproximativ jumătate din fluxul total de glucoză este oxidat [șobolani: 43-45% (8); câini: 30-50% (39); oameni: 40-60% (19, 32)] și, din acest motiv, a fost selectată valoarea de 50%. Presupunerea că 100% din fluxul de glucoză este oxidat este probabil nerealistă, dar oferă valori limită superioară pentru contribuția maximă posibilă a oxidării glucozei la ṀO2. Presupunând 50%, acest combustibil ar reprezenta 25,0 ± 2,2% din ṀO2 în condițiile inițiale și ar atinge maximum 34,8 ± 3,4% din ṀO2 după 30 de minute de perfuzie cu glucagon (P
FIG. 5.Contribuția relativă a glucozei la cheltuielile totale de energie (A) și oxidarea carbohidraților (B) de gâște canadiene adulte înainte, în timpul și după perfuzia cu glucagon, presupunând că 100% (▲) sau 50% (○) din glucoza care suferă o rotație este oxidată. * Diferență semnificativă față de valoarea inițială (P
Rezerve de carbohidrați.
Concentrația de glucoză a fost de 4,06 ± 0,24 μmol/g țesut umed în pectoral și de 42,6 ± 4,1 μmol/g țesut umed în ficat (datele nu sunt prezentate; P −1 · min −1) să crească cu 50% și, împreună cu o rată neschimbată de oxidare a carbohidraților, a condus la o creștere cu 90% a concentrației de glucoză plasmatică. Glucagonul a provocat, de asemenea, o creștere de două ori a concentrației plasmatice de lactat. Chiar dacă glucagonul este adesea considerat ca principalul hormon lipolitic, la viteza de perfuzie utilizată aici, acesta nu a modulat concentrația niciunei fracțiuni lipidice.
Glucagonul crește mobilizarea glucozei.
Glucagonul crește concentrația plasmatică de lactat.
Infuzia cu glucagon a determinat o creștere de două ori a concentrației plasmatice de lactat (Fig. 1B). Probabil că nu a avut legătură cu stresul experimental, deoarece această creștere a fost observată doar în timpul perfuziei cu glucagon, iar nivelurile de lactat s-au întors imediat la nivelurile lor de bază scăzute în timpul recuperării. Eventual, glucagon sau o disponibilitate mai mare a substratului cauzată de o concentrație crescută de glucoză (Fig. 1B) ar fi putut stimula glicoliza, făcând astfel mai mult piruvat disponibil pentru producerea lactatului și regenerarea NAD + necesară pentru glicoliză.
Ratele de oxidare totală a glucidelor și lipidelor rămân neafectate de glucagon.
Glucagonul nu afectează concentrația de lipide și compoziția acizilor grași.
Rezervele de carbohidrați hepatici ar putea susține RMR timp de 30 de minute.
Perspective și semnificație
Pentru gâștele sălbatice forțate să postească în timpul zborurilor foarte lungi și în timpul escalelor lor de primăvară, mobilizarea glucozei este esențială pentru menținerea normoglicemiei. Acest studiu este primul care demonstrează modul în care glucagonul modulează cinetica glucozei unei păsări migrante la distanță lungă și cuantifică ratele de mobilizare a glucozei în gâștele din Canada. Contrar așteptărilor, glucagonul nu a avut niciun efect asupra concentrației plasmatice a oricărei fracțiuni lipidice, dar a avut un efect puternic asupra mobilizării glucozei. Gâștele din Canada au avut o rată inițială de mobilizare a glucozei de 22,2 μmol · kg -1 -1 min -1, iar glucagonul a determinat creșterea acestei rate de 1,5 ori. Această creștere a mobilizării glucozei indusă de glucagon a dus la o creștere de 1,9 ori a concentrației de glucoză plasmatică, dar nu a avut niciun efect asupra oxidării totale a glucidelor. De asemenea, s-a observat o creștere de două ori a concentrației plasmatice de lactat. La doza administrată aici, glucagonul a stimulat puternic producția de glucoză hepatică, dar nu a avut niciun efect asupra metabolismului lipidic, deși este adesea considerat ca principalul hormon lipolitic aviar. Determinarea dacă diferite doze de glucagon modulează metabolismul combustibilului gâștelor din Canada ne pare în mod similar o provocare interesantă pentru munca viitoare.
Această cercetare a fost susținută de o subvenție de descoperire a Consiliului Național de Științe și Inginerie (NSERC) acordată J.-M.W, precum și de o bursă NSERC Alexander Graham Bell Canada, o bursă universitară Ontario, o bursă de excelență a Universității din Ottawa, o Dr. Prix Acfas-Desjardins, un grant arhitectural al Institutului Arctic al Americii de Nord și subvenții de cercetare Sigma Xi (Grant G2009101616 și G2009151055) către E.V.
Autorii nu declară conflicte de interese, financiare sau de altă natură.
- Efectele staniului dietetic asupra metabolismului staniului și calciului la bărbații adulți
- Efectele dietei asupra HMP dehidrogenazei și malicului (TPN) dehidrogenazei din șobolanul American Journal of
- Efectele unei diete americane standard și a unei diete antiinflamatoare la șoareci masculi și femele - PubMed
- Definiția sensibilității și specificității The American Journal of Clinical Nutrition Oxford Academic
- Efectele consumului de ulei de nucă de cocos asupra metabolismului energetic, asupra markerilor de risc cardiometabolici și