Eric C. Woolf
1 Cercetare neuro-oncologică, Centrul de cercetare a tumorilor cerebrale Barrow, Institutul neurologic Barrow, St. Joseph’s Hospital and Medical Center, Phoenix, AZ, SUA
2 Școala de Științe ale Vieții, Universitatea de Stat din Arizona, Tempe, AZ, SUA
Nelofer Syed
3 Laboratorul de Neuro-Oncologie Moleculară John Fulcher, Divizia de Științe ale Creierului, Imperial College London, Londra, Marea Britanie
Adrienne C. Scheck
1 Cercetare neuro-oncologică, Centrul de cercetare a tumorilor cerebrale Barrow, Institutul neurologic Barrow, St. Joseph’s Hospital and Medical Center, Phoenix, AZ, SUA
2 Școala de Științe ale Vieții, Arizona State University, Tempe, AZ, SUA
Abstract
Tumorile cerebrale maligne sunt devastatoare, în ciuda tratamentelor agresive, cum ar fi rezecția chirurgicală, chimioterapia și radioterapia. Speranța medie de viață a pacienților cu glioblastom nou diagnosticat este de aproximativ
Introducere
Gliomul malign uman este o boală uniform fatală datorată, în parte, limitărilor tratamentelor disponibile în prezent, care includ intervenții chirurgicale, chimioterapie și radioterapie. Supraviețuirea medie a pacienților cu glioblastom multiform (GBM) este de 1,5 ani, iar tumorile sistemului nervos central sunt cele mai frecvente tumori solide în populația pediatrică. Prin urmare, este de o importanță capitală să se dezvolte noi strategii terapeutice pentru pacienții cu cancer cerebral, în special cele care pot spori eficacitatea opțiunilor curente de tratament fără a deteriora țesutul normal al creierului. Progresele în înțelegerea noastră despre biologia acestor tumori au condus la o creștere a numărului de terapii țintite în studiile preclinice și clinice (Roesler și colab., 2010; Nicholas și colab., 2011; Niyazi și colab., 2011). În timp ce aceste terapii se pot dovedi oarecum eficiente, eterogenitatea acestei tumori împiedică adesea găsirea moleculelor vizate pe toate celulele tumorii, reducând astfel eficacitatea acestor tratamente. În schimb, o trăsătură împărtășită de aproape toate celulele tumorale este metabolismul modificat.
Metabolismul tumorii
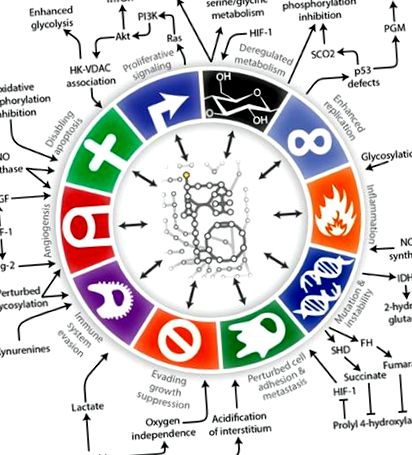
O ilustrare a interconectărilor dintre metabolismul tumorii cu Hanahan și semnele distinctive ale cancerului de la Weinberg (Lewis și Abdel-Haleem, 2013).
Termenul „remodelare metabolică” a fost folosit pentru a descrie modificările metabolice care pot apărea în celulele canceroase (Obre și Rossignol, 2015), iar căile asociate oncogenei sunt acum cunoscute că se intersectează și modifică căile metabolice. De exemplu, proteina supresoare tumorale p53 care joacă un rol esențial în răspunsurile celulare la hipoxie, deteriorarea ADN-ului și activarea oncogenului este acum cunoscută pentru a regla glicoliza și a ajuta la menținerea integrității mitocondriale (Olovnikov și colab., 2009; Madan și colab., 2011; Puzio-Kuter, 2011; Kim și Kim, 2013; Iurlaro și colab., 2014; Barron și colab., 2016). O altă legătură importantă între metabolism și creșterea tumorii este prin reglarea c-MYC. Expresia excesivă a c-MYC apare într-o mare varietate de tipuri de cancer, inclusiv glioamele. c-MYC este un factor de transcripție multifuncțional, iar lista genelor sale țintă include cele implicate atât în proliferarea celulară, cât și în metabolismul celular (Miller și colab., 2012; Zwaans și Lombard, 2014; Altman și colab., 2015; Hsieh și colab. al., 2015; Stine și colab., 2015). În plus față de stimularea glicolizei, sa constatat că c-MYC activează glutaminoliza și sinteza lipidelor din citrat (Obre și Rossignol, 2015).
Odată cu apariția analizelor moleculare, studiile asupra căilor factorilor de creștere păreau să umbrească influența metabolismului asupra creșterii cancerului. Activarea excesivă a căii de semnalizare PI3K/AKT sensibile la stres este tipică în multe tipuri de cancer și deseori datorită activării căilor de semnalizare a factorului de creștere implicate în creșterea gliomului, cum ar fi factorul de creștere derivat din trombocite, factorul de creștere epidermică și factorul de creștere a insulinei. Știm acum că aceste căi ale factorilor de creștere sunt împletite cu căile de semnalizare metabolică (Iurlaro și colab., 2014; Martini și colab., 2014; Courtnay și colab., 2015; Dibble și Cantley, 2015; Roberts și Miyamoto, 2015). Semnalizarea PI3K/AKT a fost strâns legată de metabolism și, în condiții de glucoză scăzută, rezultă moartea rapidă a celulelor tumorale (Robey și Hay, 2009; Yang și colab., 2009; Marie și Shinjo, 2011).
Dieta ketogenică: prezentare generală și dovezi preclinice
Utilizarea alterării metabolice pentru terapia tumorilor cerebrale a fost susținută de Seyfried și colab. (2011). Ei au folosit modelele de tumori de șoarece VM (Shelton și colab., 2010) și CT-2A (Marsh și colab., 2008) pentru a arăta că o KD, mai ales atunci când este administrată în cantități restrânse, extinde supraviețuirea. D’Agostino și colegii săi au adăugat oxigen hiperbaric și suplimente cetonice pentru a demonstra creșterea redusă a celulelor tumorale și răspândirea metastatică în modelul tumorii metastatice VM (Poff și colab., 2014, 2015). Am folosit modelul intracranian GL261-luc/albino C57/Bl6 intracranian pentru a demonstra că CR nu era necesar pentru efectele antitumorale ale KD (Stafford și colab., 2010), în special atunci când o formulare 4: 1 grăsime: carbohidrat plus proteine este utilizat (Scheck și colab., 2012; Woolf și colab., 2015; Lussier și colab., 2016). Recent Martuscello și colab. (2016) au demonstrat inhibarea creșterii celulelor stem ale gliomului in vitro și in vivo prin utilizarea unei diete suplimentate cu conținut ridicat de grăsimi cu conținut scăzut de carbohidrați.
KD în combinație cu terapii standard
Deși dovezile sugerează că KD oferă beneficii antitumorale pe cont propriu, poate cea mai eficientă utilizare a KD este în combinație cu terapiile standard împotriva cancerului, cum ar fi radiațiile și chimioterapia (Allen și colab., 2014). KD a îmbunătățit semnificativ supraviețuirea la un model de șomaj de gliom malign atunci când este combinat cu temozolomidă (TMZ) în comparație cu oricare dintre tratamentele singure (Figura 2; 2; Scheck și colab., 2011). Sa demonstrat că KD potențează semnificativ efectul antitumoral al radioterapiei. De fapt, 9 din 11 animale menținute pe KD și tratate cu radiații au remis complet și susținut tumorile lor implantate, chiar și după ce au fost readuse la o dietă standard de rozătoare. (Figura2; 2; Abdelwahab și colab., 2012). Allen și colab. (2013) au raportat rezultate similare atunci când KD este combinat cu radiații și chimioterapie într-un model de xenogrefă pentru cancerul pulmonar. supraviețuire. CR și postul pe termen scurt s-au dovedit a fi sinergice cu radiațiile și alte medicamente anti-cancer atât în studiile preclinice, cât și în cele clinice (Raffaghello și colab., 2008, 2010; Lee și colab., 2010, 2012; Safdie și colab., 2012; Champ și colab., 2013, 2014; Saleh și colab., 2013; Klement și Champ, 2014).
Suprafața de supraviețuire Kaplan-Meier a animalelor implantate intracranial cu celule glioame maligne GL261-luc2 și (A) menținut pe KetoCal ® [KC, grăsimea 4: 1: carbohidrați și proteine din dieta ketogenică (KD)] vs. dieta standard (SD); (B) tratate cu radiații 2x4Gy vs. KC plus radiații și (C) tratat cu 50 mg/kg temozolomidă (TMZ) vs. KC plus TMZ. Animalele de pe KC au supraviețuit mult mai mult când au fost tratate numai cu KC, când KC a fost combinat cu radiații și când KC a fost combinat cu TMZ (Scheck și colab., 2011; Abdelwahab și colab., 2012).
Eficacitatea radioterapiei se datorează mai multor factori, inclusiv deteriorarea relativă a celulelor tumorale vs. țesutul normal și capacitatea celulelor normale și a celulelor tumorale de a repara daunele (Klement și Champ, 2014; Santivasi și Xia, 2014). KD sau CR pot modula capacitatea tumorilor și a celulelor normale de a repara daunele provocate de radiații (Klement și Champ, 2014). Studiile au arătat că CR poate spori repararea ADN-ului în celulele normale (Heydari și colab., 2007); cu toate acestea, acest lucru nu poate fi cazul în celulele tumorale, iar răspunsul diferențial al celulelor tumorale și celulelor normale la stresul genotoxic poate fi mediat de factorul de creștere redus de insulină 1 (IGF1) și de glucoză în celulele tumorale. Noi și alții am arătat că factorul de creștere a insulinei este redus la animalele menținute pe un KD (Freedland și colab., 2008; Mavropoulos și colab., 2009; Scheck și colab., 2012; Klement și Champ, 2014).
În cele din urmă, cetonele și KD s-au dovedit a afecta sistemul imunitar (Kim DY și colab., 2012; Husain și colab., 2013; Rahman și colab., 2014; Youm și colab., 2015) și am arătat că KD inversează, de asemenea, supresia imună mediată de tumori într-un model de gliom malign la șoarece (Lussier și colab., 2016). Deoarece uciderea tumorii indusă de radiații este cunoscută pentru a expune sistemul imunitar la o mai mare diversitate de antigeni tumorali, este posibil ca KD ca adjuvant să acționeze pentru a spori efectul radiațiilor, în parte, sporind imunitatea împotriva GBM.
Varietatea efectelor observate atunci când glucoza în scăderea și/sau cetonele sunt crescute sugerează că aceasta poate potența și alte terapii, inclusiv terapii mai noi imune și țintite. Sunt valabile îngrijorările că potențarea efectului antitumoral al unei anumite terapii poate crește efectul acesteia asupra creierului normal; cu toate acestea, noi și alții am arătat că modificările exprimării genelor observate în tumoră sunt diferite de cele observate în creierul normal (Stafford și colab., 2010; Maurer și colab., 2011). Mai mult, KD este cunoscut ca având efecte neuroprotectoare (Puchowicz și colab., 2008; Lund și colab., 2009; Maalouf și colab., 2009; Hartman, 2012) și, prin urmare, s-a postulat că acest lucru poate ajuta la protejarea creier normal de la efectele dăunătoare ale radio-chimioterapiei. Luate împreună, datele preclinice oferă un sprijin puternic pentru utilizarea clinică a KD sau CR ca terapie adjuvantă pentru tratamentul glioamelor și a altor tipuri de cancer.
β-Hidroxibutirat ca agent anticancer
Investigațiile noastre proprii asupra interacțiunilor dintre celulele βHB și glioblastom au dezvăluit informații despre baza moleculară pentru unele dintre efectele KD, în special efectele sale radio și chimio-sensibilizante. Studiile in vitro folosind βHB au demonstrat că, chiar și în prezența glucozei ridicate, dozele relevante fiziologic de βHB au redus proliferarea mai multor linii celulare de glioblastom uman, două linii celulare stem de cancer uman și o linie celulară de gliom murin. În plus, un tratament similar cu βHB a dus la potențarea dozelor mici de radioterapie ionizantă atât la populațiile sensibile, cât și la cele rezistente (Rossi și colab., 2015; Silva-Nichols și colab., 2015). Mai mult, într-un studiu separat, βHB a potențat agentul chimioterapeutic 1,3-bis (2-cloretil) -1 nitrozourea (BCNU, carmustină) într-o linie celulară derivată dintr-un glioblastom uman recurent (Scheck și colab., 2012). Luate împreună, aceste rezultate sugerează că suplimentarea cu cetonă poate oferi o alternativă eficientă, mai puțin strictă la rigorile KD; totuși sunt necesare studii suplimentare pentru a dezvolta în continuare această abordare.
KD la Oameni
Studiile privind utilizarea glucozei în cancer au început înainte de anii 1980, inclusiv studii privind metabolismul și cașexia cancerului (Tisdale și colab., 1987; Fearon și colab., 1988). Aceste studii și alte studii au sugerat că KD constând dintr-un procent ridicat de trigliceride cu lanț mediu (MCT), împreună cu diferite suplimente, a dus la creșterea în greutate și la îmbunătățirea echilibrului de azot atât la animale, cât și la oameni. Nebeling și colab. (1995) au publicat un raport de caz în care au folosit o KD similară bazată pe ulei de MCT pentru a trata două femei pediatrice cu tumori cerebrale maligne în stadiu avansat (Nebeling și Lerner, 1995). Ei au demonstrat că cetoza indusă de dietă a scăzut disponibilitatea glucozei pentru tumoare fără a provoca o scădere a greutății pacientului sau a stării nutriționale generale. Mai mult, ambii copii au avut un tratament tumoral pe termen lung (Nebeling și colab., 1995).
tabelul 1
Studii clinice active: dieta ketogenică și glioame.
| 01716468 | Primit pentru prima dată: 18.09.12 Ultima actualizare: 04/9/16 Ultima verificare: aprilie 2016 | Dieta ketogenică în cancerul avansat PI: Jocelyn Tan, MD | VA Pittsburgh Healthcare System | Siguranță; tolerabilitate pe termen lung; calitatea vieții; creșterea/răspândirea tumorii; supraviețuire globală și fără progresie (17 pacienți) |
| 02046187 | Primit pentru prima dată: 17.01.14 Ultima actualizare: 15.03.2015 Ultima verificare: martie 2015 | Dieta ketogenică cu radiații și chimioterapie pentru glioblastomul nou diagnosticat PI: Adrienne C Scheck, dr. Christopher Dardis, MD | Sf. Spitalul și Centrul Medical Joseph’s, Phoenix | Tolerabilitate; supraviețuirea generală; timpul până la progresie; calitatea vieții pacientului (QOL); calitatea vieții îngrijitorului; modificări cognitive; activitate convulsivă (40 pacienți) |
| 01754350 | Primit pentru prima dată: 14.12.12 Ultima actualizare: 31.03.15 Ultima verificare: martie 2015 | Dieta ketogenică restricționată în calorii și postul tranzitoriu în timpul retradierii la pacienții cu glioblastom recurent (ERGO2) PI: Johannes Rieger, PD Dr. med. | Spitalele Universității Johann Wolfgang Goethe TAVARLIN (Darmstadt, Germania) | Tolerabilitate; supraviețuire fără progresie (6 luni după re-iradiere); supraviețuirea generală; frecvența convulsiilor; QOL; depresie; atenție (50 de pacienți) |
| 02286167 | Primit pentru prima dată: 05.11.14 Ultima actualizare: 17.11.14 Ultima verificare: octombrie 2014 | Glioma a modificat dieta pe bază de Atkins la pacienții cu glioblastom PI: Jaishri O. Blakeley, MD | Sidney Kimmel Comprehensive Cancer Center, Johns Hopkins | Fezabilitatea MAD; concentrațiile de glutamat și glutamină cerebrală (MRS); complianță alimentară (25 pacienți) |
| 01535911 | Primit pentru prima dată: 03.02.12 Ultima actualizare: 8.09.15 Ultima verificare: septembrie 2015 | Studiu pilot al unei terapii nutriționale metabolice pentru gestionarea tumorilor cerebrale primare (cetone) | Universitatea de Stat din Michigan | Studiu de siguranță/eficacitate Scanarea CT-PET va fi utilizată pentru a măsura modificările dimensiunii tumorii cerebrale. Dieta ketogenică cu restricție energetică (ERKD) subiecți GBM nou diagnosticați. |
| 01865162 | Primit pentru prima dată: 24.05.2013 Ultima actualizare: 25.11.14 Ultima verificare: mai 2013 | Dieta ketogenică ca tratament adjuvant în glioblastom multiform refractar/în stadiul final: un studiu pilot PI: Pavel Klein, M.D. | Mid-Atlantic Epilepsy and Sleep Center, LLC Colaborator Universitatea din Pittsburgh | Siguranță; conformitate (tolerabilitate); supravieţuire; timp până la edem care necesită steroizi (6 pacienți) |
| 02302235 | Primit pentru prima dată: 24.11.14 Ultima actualizare: 25.11.14 Ultima verificare: noiembrie 2014 | Tratament dietetic ketogen adjuvant la radiații și chimioterapie în glioblastomul multiform: un studiu pilot (GBMXRT) PI: Pavel Klein, MD. | Mid-Atlantic Epilepsy and Sleep Center, LLC Colaborator Neuroscience Research Foundation | Supravieţuire; timpul pentru reapariție; timpul până la progresia radiologică; tolerabilitate (42 pacienți) |
Îngrijorarea cu privire la calitatea vieții pacienților este dată uneori ca motiv de a nu angaja KD. Conformitatea poate fi îngreunată prin utilizarea steroizilor (prescriși edemului peritumoral) care adesea măresc foamea și cresc nivelul glicemiei. Pentru a aborda acest lucru, cel puțin un studiu clinic (> NCT02046187) include o analiză a calității vieții atât a pacientului, cât și a celui care asigură îngrijirea. Măsurătorile calității vieții se adaugă la mai multe studii clinice, deoarece importanța acestora a devenit recunoscută la nivel național (van den Bent și colab., 2011; Boele și colab., 2013; Dirven și colab., 2014). În timp ce unii clinici sunt îngrijorați, conformitatea va reduce calitatea vieții, pacienții care rămân în KD adesea comentează că acest lucru le permite să participe la propria terapie. În ciuda acestor avertismente, datele preclinice existente care sugerează eficacitatea antitumorală și un efect sinergic cu terapiile standard oferă un impuls puternic pentru efectuarea de studii clinice controlate, în special cele care vor arunca lumină asupra interacțiunilor dintre KD și alte terapii.
Concluzie
Contribuțiile autorului
ECW, NS și ACS au contribuit la redactarea acestui articol de revizuire.
Finanțarea
Această lucrare a fost finanțată parțial prin subvenții acordate ACS de la studenți care susțin cercetarea tumorilor cerebrale și sprijin pentru ECW de la Școala de Științe ale Vieții, Universitatea de Stat din Arizona. Campania de cercetare a tumorilor cerebrale ajută la finanțarea muncii efectuate în Dr. Laboratorul Nelofer Syed din Regatul Unit.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
- Dieta ketogenică influențe metabolice asupra excitabilității creierului și epilepsie - ScienceDirect
- Subțire din interiorul revizuirii - Adevărul despre dieta ketogenică expus
- Planul de masă pentru dieta ketogenică de 5 zile (cu rețete)
- Protocolul Ketogains TKD (Target Ketogenic Diet) Ketogains Protocol
- Metoda Ketogains Ghidul dvs. final pentru a câștiga mușchi și a pierde grăsimi pe o dietă ketogenică -