Microbiomul intestinal este până acum cea mai studiată comunitate microbiană la omul sănătos, datorită rolurilor sale cunoscute sau suspectate într-o gamă largă de funcții fiziologice homeostatice și a bolilor inflamatorii intestinale și a biomasei sale mari care face posibilă prelevarea de probe fiabile.
Termeni asociați:
- Firmicute
- Disbioză
- Serozita
- Metabolism
- Metaboliți
- Microbiom
- Obezitatea
- Bacterie
Descărcați în format PDF
Despre această pagină
Microbiom bun
Gail A.M. Dr. Cresci, RDN, CNSC, Kristin Izzo MS, RDN, CNSC și sindromul intestinului scurt pentru adulți, 2019
Introducere
Microbiomul intestinal, așa cum este definit de biologul molecular Joshua Lederberg, este totalitatea microorganismelor, bacteriilor, virusurilor, protozoarelor și ciupercilor și materialul genetic colectiv al acestora prezent în tractul gastro-intestinal (GIT). Microbiota intestinală este alcătuită din toate bacteriile, comensale și patogene, care locuiesc în GIT. În ultimul deceniu, microbiota intestinală a fost explorată pentru interacțiunile potențiale microb-intestin-gazdă, inclusiv efecte asupra metabolismului, răspunsurilor imune și neuroendocrine. Microbiota intestinală joacă un rol important în absorbția nutrienților și a mineralelor, în sinteza enzimelor, vitaminelor și aminoacizilor și în producția de acizi grași cu lanț scurt (SCFA). Subprodusele de fermentație acetat, propionat și butirat sunt importante pentru sănătatea intestinului și furnizează energie celulelor epiteliale, sporesc integritatea barierei epiteliale și oferă imunomodulare și protecție împotriva agenților patogeni. Investigațiile actuale explorează funcția genei bacteriene rezidente și potențialul rol corespunzător în sănătatea și metabolismul uman. În plus, este în curs de desfășurare un studiu pentru a determina dacă tulpinile bacteriene nepatogene pot stimula recuperarea răspunsurilor imune la bolile cauzatoare de patogeni (Cresci și Bawden, 2015).
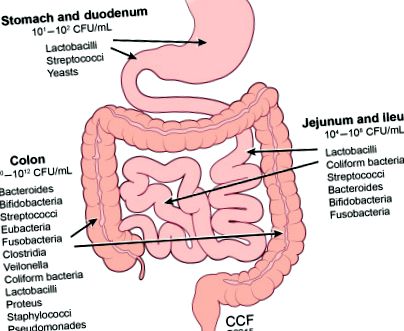
Microbiota intestinului uman este împărțită în multe grupuri numite filuri. Microbiota intestinală este alcătuită în principal din patru filuri principale care includ Firmicutes, Bacteriodetes, Actinobacteria și Proteobacteria (Belizario și Napolitano, 2015). În timp ce bacteriile colonizează corpul uman, inclusiv cavitatea bucală, placenta, vaginul, pielea și GIT, majoritatea bacteriilor se află în GIT, cu majoritatea bacteriilor predominant anaerobe găzduite în colon (Fig. 4.1). Pentru a câștiga perspectiva magnitudinii prezenței bacteriene și a efectelor potențiale asupra gazdei, corpul uman exprimă 20.000 de gene eucariote, în timp ce microbiomul intestinal exprimă 3,3 milioane de gene procariote (NIH, 2012).
Figura 4.1. Bună predominanță a microbiotei.
Dezvoltarea și modificarea microbiomului intestinal sunt afectate de o varietate de factori, inclusiv nașterea și metoda de hrănire a sugarului, expunerea la stres, mediu, dietă, medicamente, stadiul ciclului de viață și bolile comorbide (Fig. 4.2). Disbioza este descrisă ca o modificare a comunității microbiene care are ca rezultat o diversitate redusă și un număr de bacterii comensale. Studiile sugerează relații între disbioză intestinală și afecțiuni cronice de sănătate, cum ar fi boli inflamatorii intestinale, sindrom metabolic, boli cardiovasculare, obezitate și cancer (Carding și colab., 2015).
Figura 4.2. Factori despre care se știe că au impact asupra microbiomului intestinal.
Boli renale cronice și tulburări gastro-intestinale
Susie Q. Lew, Jai Radhakrishnan, în Boala renală cronică (ediția a doua), 2020
Microbiom bun
Microbiomul intestinal joacă roluri importante atât în menținerea sănătății, cât și în patogeneza bolii. Disbioza microbiomului intestinal, rezultată din modificările compoziției și funcției microbiomului intestinal și perturbarea funcției barierei intestinale, există la pacienții cu BCR. Disbioza microbiomului intestinal generează cantități excesive de toxine uremice. Cele mai multe dintre ele sunt derivate din fermentarea dezechilibrată a compușilor de azot în raport cu carbohidrații nedigerabili, cum ar fi sulfatul de p-crezil și, în special, sulfatul de indoxil. Bariera intestinală afectată permite translocarea acestor toxine în circulația sistemică. Aceste toxine uremice au fost implicate în progresia CKD, dezvoltarea bolilor cardiovasculare și riscul de deces la pacienții cu CKD. 134.135 Dovezi sugerează că microbiomul intestinal este modificat la pacienții cu BCR. 136 Câțiva factori care contribuie la disbioza microbiomului intestinal în CKD includ consumul scăzut de fibre dietetice, constipație, asimilarea afectată a proteinelor, utilizarea antibioticelor și terapia cu fier. 134
Efect asupra metabolismului gazdei
Concluzii
Microbiomul intestinal a fost investigat pe scară largă și sa dovedit a fi implicat în diferite mecanisme ale bolii. Noile tehnologii din câmpurile genomice și metabonomice, precum și modelele de sistem, cum ar fi șoarecii fără germeni, s-au îmbunătățit în ultimul deceniu și ne-au sporit cunoștințele și înțelegerea cu privire la interacțiunea complexă a microbiotei intestinale cu metabolismul gazdei. Cu toate acestea, capacitatea de a traduce rezultatele studiilor de rozătoare și de a le aplica funcției umane rămâne problematică, deoarece speciile microbiene și metabolite distincte care au funcționalități metabolice similare se găsesc în ambele organisme. Metodele analitice sunt contestate de diversitatea mare a metaboliților. Nivelurile de metabolit afectate de disbioza microbiotei intestinale, precum SCFA și BA joacă un rol cheie în metabolismul gazdei. Se așteaptă ca noile tehnici dezvoltate să ofere noi informații despre funcția microbiotei intestinale prin monitorizarea metaboliților influențați de funcția intestinală. În mod clar, complementaritatea diferitelor analize -omice este un atu în maximizarea gamei de detecție a metaboliților pentru înțelegerea axei gazdă - microbiotă intestinală și implicarea în fiziopatologia gastrointestinală (Tabelul 28.1).
Tabelul 28.1. Rezumatul metabolizării SCFAs și BAs legate de intestin - Axa gazdă
| SCFA-uri | • |
PH-ul tractului gastro-intestinal
Impactul asupra sintezei ATP, TG, colesterol și BA
Activați căi prin GPCR (GPR41, GPR43 și GPR109a)
Activarea căilor PPAR, ROS și TNFα
Sinteza DG și TG-urilor modulate
Emulsifiere și absorbție a grăsimilor alimentare
PH-ul tractului gastro-intestinal
Reglează-și propria sinteză prin CYP7A1 cu FXR, LXR
Protejați-vă împotriva rezistenței la insulină prin TGR5
Variație la nivelurile secundare și terțiare de BA
Influența factorilor dietetici asupra microbiotei intestinale
Gemma Xifra,. José Manuel Fernández-Real, în Nutriție moleculară și diabet, 2016
Microbiota intestinală și diabetul de tip 1
Se sugerează că microbiomul intestinal joacă un rol în patogeneza tulburărilor autoimune, cum ar fi diabetul de tip 1 (T1D). Investigațiile recente au identificat un rol important al microbiotei intestinale în reglarea metabolismului sistemic al glucozei și în modularea răspunsurilor imunologice într-un model de șoarece cu diabet autoimun. Absența microbiotei intestinale la șoarecii diabetici neobezi (NOD) nu a afectat incidența generală a bolii, dar a dus la creșterea insulinitei și a nivelurilor serice ale autoanticorpilor de insulină și a citokinelor pro-inflamatorii și a înrăutățit metabolismul glucozei la șoarecii care nu au progresat la diabet. 64 Mai mult, acești autori au observat diferențe în profilul metabolomicii serice între șoareci NOD fără germeni și șoareci convenționali care seamănă cu diferențele dintre cei ai nou-născuților care progresează ulterior la T1D și neprogresori. 64 Astfel, modificările metabolomice la sugarii care progresează ulterior la T1D pot fi modulate de microbiota intestinală.
La om, un studiu prospectiv cu 35 de copii nou diagnosticați cu T1D și 35 de copii sănătoși a arătat o scădere a abundenței bacteriilor anaerobe benefice și o creștere concomitentă a Enterobacteriaceae, în afară de colonizarea E. coli, la pacienții cu T1D, comparativ cu grupul de control. 65 O perturbare a echilibrului ecologic al florei intestinale ar putea fi un factor declanșator în etiologia T1D. Pe baza tuturor acestor rezultate, nu poate fi exclus un rol al microbiotei intestinale ca regulator al autoimunității diabetice.
Microbiomul intestinal
Sarah Ashman, Hari Krishnamurthy, în Efectele stilului de viață asupra sănătății bărbaților, 2019
Abstract
Microbiomul intestinal discută rolul microbiotei intestinale în sănătatea și bolile umane atât în contextul larg al imunomodulării, cât și în influența specifică a proceselor inflamatorii. Sunt evidențiate progresele tehnologice, inclusiv o varietate de metode științifice de evaluare a compoziției microbiomului intestinal și punctele tari și punctele slabe ale fiecărei metode. Relația simbiotică a microbiomului intestinal și a gazdei umane este esențială pentru înțelegerea modului în care fiecare afectează și depinde de celălalt pentru supraviețuirea reciprocă, de la naștere până la maturitate și prin mecanisme de expunere microbiană diversă, expunere la mediu și modele dietetice. Se acordă, de asemenea, atenție mecanismelor care precipită bolile cronice și intervențiile, inclusiv probiotice dietetice și suplimentare, prebiotice și compuși fenolici, precum și nutrienți suplimentari suplimentari care au merit în abordarea disbiozei intestinale.
Prebioticele și probioticele în modificarea microbiotei
30.2.2.5 Imunomodulare
Condiții clinice asociate cu excrescența bacteriană
Ayesha Shah MBBS, FRACP, Gerald Holtmann MD, PHD, MBA, FRACP, FRCP, în Boli gastro-intestinale și infecțiile asociate acestora, 2019
Caracterizarea microbiomului intestinal
Microbiomul intestinal poate fi caracterizat prin compoziția bacteriilor care colonizează mucoasa, densitatea colonizării bacteriene și produsele metabolice produse de bacterii. Se crede că metodele de cultură și cuantificarea unităților care formează colonii (CFU) sau caracterizarea metabolică a produselor metabolice ale bacteriilor cultivate sunt cele mai potrivite pentru a caracteriza microbiomul. Astfel, metodele convenționale bazate pe cultură au fost utilizate pentru a evalua microbii intestinali. Cu toate acestea, s-a dovedit că metodele bazate pe cultură sunt inadecvate pentru a determina adevărata diversitate microbiană a microbiotei intestinale, deoarece o fracțiune mare a microbiotei rămâne necultivată. 40 Studii la om care utilizează o varietate de teste moleculare independente de cultură demonstrează o complexitate neimaginată până acum a microbiotei intestinului uman cu sute de filotipuri, dintre care 80% rămân neculturi. 41 Până în prezent, majoritatea studiilor s-au concentrat asupra microbiotei fecale, în parte deoarece probele fecale sunt relativ ușor de obținut; cu toate acestea, materialul fecal este compus în principal din acei microbi rezidenți în lumenul intestinal, care nu reflectă cu exactitate compoziția MAM. 42-45
Limitările menționate mai sus ale testelor directe bazate pe cultură au declanșat dezvoltarea testelor indirecte în cadrul clinic pentru a identifica pacienții cu colonizare bacteriană modificată (crescută) a intestinului. Cele mai disponibile teste indirecte pentru diagnosticarea SIBO sunt testele de respirație 37 bazate pe fermentarea carbohidraților de către bacterii, pentru a produce acizi, apă și gaze. Substratul este administrat oral și nivelul de hidrogen (H2), metan (CH4) sau dioxid de carbon (CO2) este măsurat în respirația expirată. Substraturile pot fi glucoză lactuloză, xiloză sau acizi biliari. În funcție de protocolul de detectare, substraturile pot fi, de asemenea, etichetate cu izotopi radioactivi sau stabili, iar respirația expirată alveolară este măsurată cu detectoare adecvate (de exemplu, detectoare electrochimice în stare solidă [H2 și CH4], dispozitive de scintilație [14 C] sau spectroscopie în infraroșu [13 C]). Alternativ, produsele metabolice precum H2, CH4 și CO2 pot fi măsurate utilizând cromatografia gazoasă sau senzori în stare solidă. Substanțele utilizate pentru testarea hidrogenului și metanului includ glucoza 46,47 sau lactuloza. 48 Aceste teste de respirație sunt acum utilizate pe scară largă în mediul clinic pentru a diagnostica supra-creșterea bacteriană.
Polifenoli și sănătatea intestinală
Kristina B. Martinez,. Michael K. McIntosh, în Nutriție și alimente funcționale pentru o îmbătrânire sănătoasă, 2017
Abstract
Modificarea microbiomului intestinal cu prebiotice poate atenua disbioza și îmbunătăți sănătatea intestinală și sistemică. Plantele sunt bogate în trei clase principale de polifenoli cu proprietăți prebiotice: (1) acizi fenolici, (2) flavonoizi și (3) alți fenolici. Toate acestea sunt abundente în fructe, legume, condimente și ierburi și au atât proprietăți antioxidante, cât și antiinflamatorii. Deoarece polifenolii alimentari sunt slab absorbiți în intestinul subțire, aceștia persistă în colon pentru a fi metabolizați în metaboliți aromatici care sunt absorbiți în sângele portal și trimiși în ficat sau excretați în fecale. Metaboliții hepatici ai polifenolului intră în (1) fluxul sanguin pentru absorbția de către țesuturile țintă, (2) vezică pentru excreția urinară sau (3) bazin de acid biliar pentru remixarea cu digestia intestinală. În colon, polifenolii modifică populațiile de microbi intestinali și producția de metaboliți microbieni și metaboliți intestinali derivați de gazdă și hormoni peptidici care influențează integritatea intestinală și metabolismul sistemic.
Microbiomul mucoasei
Jonathan Jacobs, Jonathan Braun, în Imunologia mucoasei (ediția a patra), 2015
Influențe dietetice
Au fost efectuate două studii în care voluntarii au fost supuși unei diete standardizate cu monitorizare longitudinală a microbiotei lor. Unul a comparat o dietă bogată în grăsimi/cu conținut scăzut de fibre cu o dietă cu conținut scăzut de grăsimi/bogată în fibre, în timp ce cealaltă a studiat o dietă cu deficit de colină (Wu și colab., 2011; Spencer și colab., 2011). Ambele studii au concluzionat că modificarea dietei a dus la o schimbare a compoziției microbiotei intestinale. Într-un studiu, această schimbare a fost observată într-o singură zi (Wu și colab., 2011). Se speră că o mai bună înțelegere a efectelor dietei asupra microbiotei va duce la viitoare strategii terapeutice care utilizează manipularea dietei sau prebiotice pentru a promova comunitățile microbiene cu proprietăți favorabile.
Microbiota bună; Importanța sa în obezitate
Araceli Muñoz-Garach Isabel M. Cornejo-Pareja Francisco J. Tinahones, în Enciclopedia bolilor endocrine (ediția a doua), 2019
Abstract
Multe studii au legat microbiomul intestinal de dezvoltarea bolilor metabolice, cum ar fi diabetul de tip 2 și obezitatea. Obezitatea în sine este asociată cu modificări ale compoziției microbiotei intestinale, cu o tendință către o creștere excesivă a microorganismelor care obțin mai eficient energie din dietă. Cu toate acestea, creșterea masei grase se datorează nu numai unei recolte mai eficiente de energie, ci și microbiotei participă la modificări ale mediului hormonal, exprimarea genelor care reglementează lipogeneza, rezistența la insulină, modificări ale permeabilității intestinului, endotoxemie, interacțiunea cu acizii biliari, modificări ale proporției țesutului adipos maro și efectele asociate cu consumul de droguri.
În prezent, utilizarea de pro și prebiotice și alte tehnici noi, cum ar fi transplantul de microbiote intestinale sau terapia cu antibiotice, a fost postulată ca fiind instrumente utile pentru a modula dezvoltarea obezității și rezistenței la insulină prin dietă.
- Fructoza - o prezentare generală Subiecte ScienceDirect
- Citrullinemia - o prezentare generală Subiecte ScienceDirect
- Greutatea fătului - o prezentare generală Subiecte ScienceDirect
- Alimentele fermentate - o prezentare generală Subiecte ScienceDirect
- Urticaria rece - o prezentare generală Subiecte ScienceDirect