Patrizia D’Aquila
1 Departamentul de Biologie, Ecologie și Științe ale Pământului (DIBEST), Universitatea din Calabria, 87036 Rende, Italia; [email protected] (F.D.R.); [email protected] (G.P.); [email protected] (D.B.)
Laurie Lynn Carelli
2 Laborator medical, 87100 Cosenza, Italia; moc.liamg@illeracnnyleirual
Francesco De Rango
1 Departamentul de Biologie, Ecologie și Științe ale Pământului (DIBEST), Universitatea din Calabria, 87036 Rende, Italia; [email protected] (F.D.R.); [email protected] (G.P.); [email protected] (D.B.)
Giuseppe Passarino
1 Departamentul de Biologie, Ecologie și Științe ale Pământului (DIBEST), Universitatea din Calabria, 87036 Rende, Italia; [email protected] (F.D.R.); [email protected] (G.P.); [email protected] (D.B.)
Dina Bellizzi
1 Departamentul de Biologie, Ecologie și Științe ale Pământului (DIBEST), Universitatea din Calabria, 87036 Rende, Italia; [email protected] (F.D.R.); [email protected] (G.P.); [email protected] (D.B.)
Abstract
Microbiota intestinală umană este un ecosistem complex format din trilioane de microorganisme care locuiesc simbiotic pe și în intestinul uman. Aceștia îndeplinesc, prin producerea unei serii de metaboliți, multe funcții metabolice importante care completează activitatea enzimelor mamiferelor și joacă un rol esențial în digestia gazdei. Variabilitatea interindividuală a structurii microbiotei și, în consecință, a expresiei genelor sale (microbiomul), a fost în mare parte atribuită regimului nutrițional. Dieta influențează compoziția și funcția microbiotei cu efecte pe termen scurt și lung. În ciuda literaturii vaste, mecanismele moleculare care stau la baza acestor efecte rămân încă evazive. În această revizuire, am rezumat dovezile actuale privind rolul exercitat de microbiota intestinală și, mai precis, de metaboliții săi în stabilirea epigenomului gazdă. Interesul pentru acest subiect provine din faptul că, modulând metilarea ADN și modificările histonelor, microbiota intestinală afectează activitățile celulare ale organismului gazdă.
1. Introducere
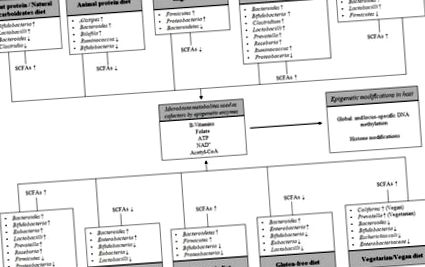
Reprezentarea schematică a interacțiunii dintre tiparele dietetice și microbiota intestinală pe modificările epigenetice ale gazdei. Diferențele de expunere la diete influențează structura microbiotei, producția generală de acizi grași cu lanț scurt (SCFA), cele mai proeminente produse finale ale fermentației microbiene și o serie de metaboliți energetici alimentari care sunt folosiți ca cofactori de către enzimele epigenetice. Săgețile în sus indică creșterea, săgețile în jos scad.
În acest context, un studiu pilot efectuat la femeile gravide a relevat o asociere puternică între predominanța bacteriană și profilurile epigenetice. Mai precis, la mamele în care Firmicutes au fost dominante, analiza profilului de metilare efectuată în probe de sânge a relevat 568 hiper-metilate, inclusiv USF1, ACOT7, TAC1, LMNA și SCD5 și 254 gene hipo-metilate, inclusiv FOXD1, KCNIP4, SERINC3 și MEF2A, dintre care unele sunt asociate cu riscul de boli cardiovasculare (409 gene modificate), metabolismul lipidic (72 gene modificate), obezitate (23 gene modificate) și răspuns inflamator (85 gene modificate) [98]. Recent, analizele compoziției microbiotei intestinale în scaunul ADN și profilarea metilării ADN la nivel de genom în sângele și țesutul adipos visceral de la subiecții obezi au relevat un model complet diferit de metilom ADN atât în sângele cât și în țesutul adipos din grupul cu raport Bacteroidetes: Firmicutes scăzut comparativ cu grup cu Bacteroidete ridicate: Firmicutes. Au fost observate două sute cincizeci și opt de gene metilate diferențial, cum ar fi HDAC7 și IGF2BP2, ambele implicate în glucoză și în homeostazia energetică [99].
După cum subliniază Cortese și colab., Modificările epigenetice ale gazdei pot fi induse de microbiota prin (i) modificări ale disponibilității donatorilor chimici pentru metilarea ADN-ului sau modificări ale histonelor, care depind de nutriție și de activitățile metabolice ale microbiotei; (ii) modificări ale ADN cauzate de mecanismele declanșate de încorporarea materialului genetic străin în genom; (iii) interacțiunea directă cu enzimele responsabile de metilarea ADN-ului sau modificări ale histonelor [100].
4.2. Dieta, metaboliții microbiotei și modificările histonice
Recent s-a raportat că Lactobacillus reuteri 6475 produce o nouă formă de folat care este analogă cu 5,10-metenil-THF, dar încorporează o grupare metil suplimentară la centrul reactiv al folatului, originând astfel 5,10-metilmetenil-THF poliglutamat sau 5, 10-eteniltetrahidrofolil (5,10-EtTHF) poliglutamat. EtTHF este biologic activ și poate transfera doi carboni pe homocisteină, rezultând în formarea aminoacidului etionină care este un analog cu metionina. Interesant, activitatea etioninei a fost găsită asociată cu suprimarea metilării histonei și etilarea reziduurilor de histon lizină [129].
Kuang și colab. a raportat la șoareci că microbiota intestinală programează ritmuri metabolice diurne prin HDAC3 care a fost recrutat ritmic la cromatină și a produs oscilații diurne sincronizate în acetilarea histonelor, exprimarea genetică metabolică și absorbția nutrienților. HDAC3 a co-activat și receptorul α (ERRα) legat de estrogen, inducând transcripția ritmică dependentă de microbiota a genei transportoare de lipide Cd36 și promovând absorbția lipidelor și obezitatea indusă de dietă [130].
Introducerea microbiotei intestinale la șoareci fără germeni modulează codul histonei într-un mod dependent de compoziția bacteriilor. În colon, ficat și țesuturile adipoase de la acești șoareci, s-au observat niveluri crescute de H3K27me3 și H3K36 și niveluri scăzute de H3K18me1, H3K23, K27me2 și K36me1. Dimpotrivă, alte modificări prezintă specificitatea țesutului, cum ar fi H3K27me1 și H3K36me2, care au crescut în țesuturile adipoase, între timp, au scăzut în ficat și colon. Colonizarea șoarecilor fără germeni a demonstrat capacitatea speciilor specifice microbiotei de a activa genele de clasă II ale complexului de histocompatibilitate majoră (MHC), probabil prin reglarea expresiei genei MHC prin metilarea ADN și acetilarea și metilarea histonei [97,131].
SIRT1 nuclear, o sirtuin deacetilază care joacă un rol vital în reglarea biogenezei mitocondriale, a metabolismului, a răspunsurilor la stres, a stabilității genomului și, în cele din urmă, a îmbătrânirii, este reglementată de SCFA [132]. În plus, resveratrolul, care sa dovedit a avea efecte benefice asupra modificărilor legate de sindromul metabolic, este capabil să crească semnificativ activitatea SIRT1 [133]. S-a postulat că beneficiile resveratrolului pentru sănătate depind în mare măsură de microbiota intestinală care participă activ la metabolismul său prin creșterea disponibilității sale de la precursori și producerea derivaților de resveratrol. Bifidobacteria infantilă și Lactobacillus acidophilus sunt responsabile pentru producerea de resveratrol din piceid. Între timp, Slackia equolifaciens și Adlercreutzia equolifaciens produc dihidropiceid și dihidroresveratrol [134].
În cele din urmă, sa constatat că Listeria monocytogenes, bacterie anaerobă facultativă Gram-pozitivă, induce la nivel global acetilarea histonei H4 (lizina 8) și fosforilarea/acetilarea histonei H3 (serina 10/lizina 14) și la promotorul il8 în endoteliul venei ombilicale umane Celulele celulare (HUVEC), precum și recrutarea proteinei de legare a proteinei de legare a proteinei de legare a adenozinei ciclice 3 ’, 5’-monofosfat a histonei acetilazei, contribuind astfel la exprimarea citokinelor celulelor endoteliale umane [135]. În mod similar, Helicobacter pylori a crescut expresia p21 (WAF1) care a fost asociată cu eliberarea HDAC-1 din promotorul p21 (WAF1) și hiper-acetilarea histonei H4. Aceste dovezi pot contribui la disecarea mecanismelor moleculare care stau la baza dezvoltării și progresiei bolilor asociate cu H. pylori [136].
În tabelul 1, sunt detaliate interacțiunile supuse între metaboliții microbieni intestinali și modificările epigenetice ale gazdei, precum și implicarea lor potențială în sănătate și boli.
tabelul 1
Metaboliții microbiotei intestinale, funcția lor biologică și implicația lor în inducerea modificărilor epigenetice la nivelul gazdei.
- Electrolitii sunt FOARTE importanți în dieta ceto - Sfaturi Keto; Rețete
- Recomandat de medic Forskolin pentru pierderea în greutate Recenzii Pastile dietetice Cele mai importante - Managementul HazMat
- Dieta ar putea ajuta la combaterea rezistenței la antibiotice - Microbiota intestinală pentru sănătate
- Microbiota intestinală, translocarea bacteriană și interacțiunile cu legăturile fiziopatologice ale dietei
- Dieta este cel mai important predictor al sănătății, cu David L.