Abstract
fundal
Deoarece modificările stilului de viață sunt principalele terapii pentru boala hepatică grasă nealcoolică (NAFLD), schimbarea componentelor dietetice (nutriționale sau bioactive) poate juca un rol important paralel. Puține studii au evaluat efectele curcuminei asupra NAFLD (în principal efecte antioxidante și antiinflamatorii). Ne-am propus să determinăm efectele nano-curcuminei (NC) asupra pacienților cu NAFLD supraponderali/obezi prin evaluarea indicilor glucozei, lipidelor, inflamației, rezistenței la insulină și a funcției hepatice, în special prin nesfatină.
Metode
Acest studiu clinic dublu-orb, randomizat, controlat cu placebo, a fost realizat la Spitalul Central Oil Company, Teheran. 84 de pacienți supraponderali/obezi cu NAFLD diagnosticați cu ultrasunete au fost recrutați în conformitate cu criteriile de eligibilitate (vârsta 25-50 ani, indicele de masă corporală [IMC] 25-35 kg/m 2). Pacienții au fost împărțiți aleator în două NC egale (n = 42) și grupuri placebo (n = 42). Intervențiile au fost două capsule de 40 mg/zi după mese timp de 3 luni. Schimbările stilului de viață au fost recomandate. Au fost completate un chestionar general, o rechemare a produselor alimentare de 24 de ore (la început, mijloc și sfârșit) și chestionarul internațional de activitate fizică de formă scurtă (la început și la sfârșit). De asemenea, tensiunea arterială, gradul ficatului gras, antropometria, zahărul din sânge (FBS) și insulina (FBI), hemoglobina glicată (HbA1c), evaluarea modelului de homeostazie-rezistența la insulină (HOMA-IR), indicele de verificare a sensibilității la insulină (QUICKI) colesterol total (TC), trigliceride (TG), colesterol lipoproteic cu densitate scăzută (LDL-c), colesterol lipoproteic cu densitate mare (HDL-c), factor de necroză tumorală-alfa (TNF-α), proteină c-reactivă cu sensibilitate ridicată (hs-CRP), interleukina-6 (IL-6), transaminazele hepatice și nesfatina au fost determinate la început și la sfârșit.
Rezultate
NC comparativ cu placebo a crescut semnificativ HDL, QUICKI și nesfatin și a scăzut gradul ficatului gras, transaminazele hepatice, circumferința taliei (WC), FBS, FBI, HbA1c, TG, TC, LDL, HOMA-IR, TNF-α, hs-CRP și IL-6 (P 0,05). După ajustarea pentru confundatori, modificările au fost similare cu modelul neajustat.
Concluzie
Suplimentarea NC la pacienții cu NAFLD supraponderali/obezi a îmbunătățit indicii glucozei, lipidele, inflamația, WC, nesfatina, transaminazele hepatice și gradul ficatului gras. În consecință, mecanismul propus pentru ameliorarea NAFLD cu NC a fost aprobat de nesfatina serică crescută și, probabil, de îmbunătățiri consecvente ale profilului inflamației, lipidelor și glucozei. Sunt sugerate studii suplimentare cu privire la efectele nanocurcuminei.
Înregistrarea procesului
Registrul iranian de studii clinice, IRCT2016071915536N3. Înregistrat 02.08.2016.
Introducere
Boala hepatică grasă nealcoolică (NAFLD) reprezintă depunerea trigliceridelor (TG) în hepatocite peste 5% din greutatea/volumul ficatului și are trei grade în funcție de biopsia hepatică (ușoară: 66%). De obicei, sunt utilizate pe scară largă metode de diagnostic neinvazive, cum ar fi ultrasunetele, CT și RMN, diferențierea exactă dintre etape fiind dificilă. De asemenea, enzimele hepatice (alanina transaminaza [ALT] și aspartatul transaminaza [AST]) pot fi crescute de 1,5-2 ori peste nivelurile normale. Cu toate acestea, mulți indivizi cu steatohepatită nealcoolică avansată (NASH) și chiar ciroză au niveluri normale de enzime hepatice. Prin urmare, ratele NAFLD sunt probabil mai mari decât cele raportate. Simptomele includ frecvent oboseală și disconfort abdominal în sfertul superior drept. Prevalența medie a adulților este de aproximativ 30% [65-85% și 15-20% la obezi [IMC ≥ 25] și non-obezi [IMC
Materiale și metode
proiectarea studiului și participanții
Comitetul de etică al Universității de Științe Medicale din Teheran a aprobat acest studiu clinic dublu-orb randomizat controlat cu placebo sub numele de IR.TUMS.REC.1394.791. Studiul a fost înregistrat la Registrul iranian de studii clinice sub denumirea de IRCT2016071915536N3 în data de 02.08.2016. Participanții au fost pacienți cu NAFLD supraponderali sau obezi îndrumați către secția de ecografie a Spitalului Central NIOC din Teheran.
Criterii de includere a inclus NAFLD conform ultrasonografiei, cu vârsta cuprinsă între 25-50 și 25 ≤ IMC 2 . Criteriu de excludere a inclus consumul de alcool în cursul anului anterior, incapacitatea/dorința de a coopera, alte afecțiuni hepatice, NAFLD secundar, hipertensiune arterială necontrolată (> 140/90 mmHg), sarcină sau alăptare, statutul de sportiv profesionist, utilizarea statinelor, acid ursodeoxicolic, probiotice, antihipertensive, medicamente interactive cu curcumina, consumul de suplimente multivitaminice/minerale și antioxidante în ultimele 3 luni, scăderea în greutate în ultimele 3 luni și care nu iau mai mult de 10% din suplimentul de intervenție [1,2,3,4, 7,8, 9].
Randomizare și intervenție
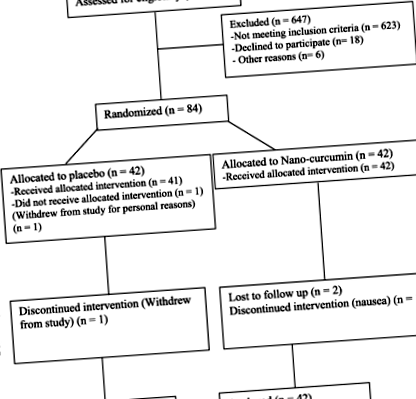
Subiecții au fost împărțiți în două grupuri egale prin metoda randomizării blocurilor, efectuată de un asistent (NC [n = 42] sau placebo [n = 42]). Randomul stratificat a fost folosit pentru a controla sexul. Raportul celor două grupuri a fost de 1: 1. 3 pacienți din grupul NC și 2 pacienți din grupul placebo au refuzat să participe (Fig. 1).
Organigrama participanților cu supraponderalitate/obezitate și NAFLD
Orbirea alocării intervenției a fost efectuată atât pentru participanți, cât și pentru anchetatori înainte de început, păstrată în timpul intervenției și deschisă după analiza datelor de către un lucrător de teren. Capsulele NC și placebo au fost furnizate de către Exir-Nano-Sina Companie. Capsulele au fost similare ca formă, dimensiune și culoare. sinacurcumină® doza a fost de 80 mg/zi (două capsule de 40 mg pe zi, conform instrucțiunilor producătorului: o capsulă la micul dejun și alta la cină). Suplimentele au fost distribuite lunar, iar starea conformității a fost evaluată lunar prin consultare față în față și săptămânal prin telefon. Procentul de complianță a suplimentelor a fost calculat în funcție de procentajul mediu al numărului de capsule consumate de indivizii din orice grup. Sfaturile privind stilul de viață au fost prezentate în mod egal de către un dietetician instruit (SITE) la spital.
Evaluări și măsurători
Caracteristici generale, aporturi alimentare și activitate fizică
Investigatorul principal a identificat pacienții cu NAFLD, le-a verificat criteriile de eligibilitate, a clarificat detaliile studiului și a obținut consimțământul informat. Au fost realizate interviuri pentru completarea chestionarelor, incluzând un chestionar general, o rechemare a produselor alimentare de 24 de ore (la început, mijloc și sfârșit) și IPAQ în formă scurtă (SF-IPAQ) (la început și la sfârșit). La începutul studiului, sfatul stilului de viață [10] a fost prezentat de un dietetician calificat, inclusiv aderarea la o dietă cu conținut scăzut de calorii, menită să obțină o scădere în greutate de aproximativ 0,5-1 kg/săptămână și creșterea activității fizice prin efectuarea intensității moderate exercițiu aerob de cel puțin 3 ori/săptămână timp de 30-45 min [11].
Statutul alimentar al subiecților a fost determinat de Nutriționist-4 software, utilizând valori gram/zi din rechemarea alimentelor de 24 de ore (validat în Iran [12]) [12, 13].
Chestionarul în formă scurtă IPAQ are 7 întrebări stratificate care determină unul dintre cele trei niveluri generale de activitate. Acest chestionar a fost validat anterior în Iran [14, 15].
Măsurători antropometrice
Greutatea (la începutul și sfârșitul) și înălțimea (la început) au fost determinate folosind un cântar digital și un stadiometruSeca® Germania, model: 7551021994). IMC a fost calculat prin împărțirea greutății în kilograme la înălțimea în metri pătrate. Procentele de compoziție corporală, inclusiv grăsimea corporală și masa corporală slabă, au fost măsurate folosind Analizor de bioimpedanță dispozitiv (Tanita®). La începutul și sfârșitul studiului, presiunile sanguine sistolice și diastolice au fost obținute cu ajutorul unui manometru cu mercur (Riester®) și au fost raportate în mmHg. Circumferința taliei a fost măsurată la mijlocul ultimei coaste și la creasta iliacă cu îmbrăcăminte minimă, folosind o bandă non-elastică, la începutul și la sfârșitul procesului. Prelevarea de probe de sânge, depozitarea și testele de laborator au fost efectuate la Spitalul Central NIOC, Teheran.
Sonografie și măsurători ale biomarkerilor sanguini
Testul cu ultrasunete a fost efectuat de un radiolog, folosind un dispozitiv de sonografie (General Electric (GE) ®, Model: Voluson E8) după un post de 12 ore, pentru a reduce posibilele erori umane.
10 ml de sânge (la început și la sfârșit) au fost preluați din vena periferică după un post de 12 ore peste noapte și au fost centrifugați timp de 20 de minute g). Indicii glucozei serice, lipidele și transaminazele hepatice au fost evaluate în ziua probei de sânge. Serul rămas a fost congelat și depozitat la - 80 ° C înainte de analiză.
Nesfatina serică, IL-6 și TNF-α au fost măsurate folosind sandwich ELISA și următoarele seturi: Shanghai Crystal Day Biotech Co. Ltd®; CV intra-test $$ QUICKI = 1/\ left [\ mathit \ fasting \ insulin \ \ left [\ mu IU/ml \ right] \ right) + \ mathit \ fasting glucose \ \ left [mg/dl \ right] \ Mare). $$
HOMA - IR = FBI [μIU/Jr.] × FBS [mg/dl] /405.
Lipidele serice (TC, TG, HDL-c, LDL-c), ALT, AST și HbA1c au fost evaluate cu Analizor Hitachi dispozitiv (q17®) și seturi specifice (Tabelul 1).
Marime de mostra
Potrivit lui Chuengsamarn și colab. [16], media ± SD a indicilor HOMA-IR în grupurile cu curcumină și placebo au fost de 3,22 ± 1,30 și respectiv 4,08 ± 1,35. Au fost 42 de participanți în fiecare grup de eșantion, cu un IC de 95%, o putere de 80% și o scădere de 15%. Au fost aleși 84 de indivizi în total și împărțiți în două grupuri egale (NC și placebo) folosind o metodă de randomizare în bloc.
Analiza datelor și accesibilitatea
S-a efectuat gestionarea datelor, inclusiv introducerea, securitatea, codarea și stocarea. Datele de urmărire lipsă de la pacienți au fost estimate prin analiza intenției modificate de tratare (m-ITT) și metoda de imputare a regresiei. Testele Kolmogorov-Smirnov, Chi-pătrat, Fisher Exact și t sau testele Mann-Whitney au fost implementate pentru a evalua normalitatea variabilelor continue și, respectiv, caracteristicile de bază categorice și continue. Analiza de varianță a măsurilor repetate bidirecționale (TWRM-ANOVA) a fost utilizată pentru a calcula efectele timpului și timpul prin efectele interacțiunii tratamentului cu toate variabilele dependente. Mai mult, TWRM-ANOVA a fost ajustat pentru aportul alimentar al participanților de energie, grăsimi totale, grăsimi saturate, acid gras mononesaturat, vitaminele D, B1, B6 și folat. Un interval de încredere de 95% (CI) și a P-valoarea
Rezultate
Trăsăturile participanților
Așa cum se arată în Fig. 1, 731 de persoane au fost selectate pe baza istoricului medical. 108 subiecți au îndeplinit criteriile de eligibilitate, dintre care 18 au refuzat să participe, iar 6 nu au putut participa. 84 de subiecți au fost randomizați în 2 grupuri și au finalizat prima vizită. În etapa de urmărire, 5 subiecți nu au putut continua (din motive personale și/sau de călătorie; NC n = 3; placebo n = 2). În cele din urmă, analiza datelor a fost efectuată la cei 84 de subiecți, conform analizei ITT modificate.
Trăsăturile generale ale participanților și nivelurile de activitate fizică sunt afișate în Tabelul 2. Majoritatea subiecților au avut niveluri de educație similare și au prezentat statutul economic ridicat și scorurile scăzute ale activității fizice. Ambele grupuri au consumat bine suplimentele prescrise. Procentul de complianță a suplimentelor a fost de 95,98% în grupul NC și 97,95% în grupul placebo.
Consumul dietetic de vitamina D la momentul inițial a fost mai mare în grupul placebo, în timp ce alte caracteristici inițiale între cele două grupuri au fost similare (Tabelele 2, 3, 4).
Starea dietei și modificările biomarkerilor măsurați
Aporturile dietetice de energie, grăsimi totale, grăsimi saturate, acid gras mononesaturat, vitaminele D, B1, B6 și folat în timpul studiului au fost mai mari în grupul placebo (P 0,05), deși greutatea, IMC, WC, SBP, ALT, AST, TC, LDL-c, TG, FBS, FBI, HbA1c, FM, TNF-α, IL-6, hs-CRP și HOMA-IR au scăzut, și HDL-c, QUICKI și Nesfatin au crescut semnificativ (P 0,05), dar greutatea, IMC, WC, DBP, ALT, AST, TC, LDL-c, TG, FBS, FBI, HbA1c, FM, TNF-α, IL-6, hs-CRP și HOMA-IR au scăzut, și HDL-c, QUICKI și Nesfatin au crescut semnificativ (P 2 și 29,7 ± 2,10 kg/m 2 în grupul NC și 30,7 ± 2,35 kg/m 2 și 29,9 ± 2,53 kg/m 2 în grupul placebo. Aceste modificări medii au rămas nesemnificative atât în cele neajustate (P = 0,2) și modele ajustateP = 0,3).
După cum se poate observa în timp prin efectul de interacțiune al tratamentului atât în modelele de analiză neajustate, cât și în cele ajustate, WC, ALT, AST, TC, LDL-c, TG, FBS, FBI, HbA1c, TNF-α, IL-6, hs- CRP și HOMA-IR au scăzut, iar HDL-c, QUICKI și Nesfatin au crescut semnificativ în rândul grupului NC în comparație cu grupul placebo (P Tabelul 5 Schimbările în greutate, IMC, indicii de glucoză, nesfatină, factori inflamatori și enzime hepatice la pacienții cu NAFLD supraponderali/obezi
Siguranță
Pacienții nu au raportat efecte secundare și evenimente secundare asociate tratamentului în timpul studiului, cu excepția unui pacient din grupul NC, care a raportat greață.
Discuţie
Acest studiu a fost primul care a evaluat efectele NC asupra nivelului seric al unor factori importanți legați de supraponderalitate, obezitate și NAFLD.
Variabilele inițiale au fost similare între cele două grupuri, cu o excepție pentru aportul dietetic de vitamina D a fost mai mare în grupul placebo. Motivele posibile pentru similitudinea ridicată a intrării includ selecția unui singur centru și niveluri socio-economice similare.
Conform analizei neajustate și ajustate, NC (în comparație cu placebo) a crescut semnificativ HDL-c, QUICKI și nesfatin și a scăzut WC, ALT, AST, TC, LDL-c, TG, FBS, FBI, HbA1c, TNF -α, IL-6, hs-CRP și HOMA-IR. Modificările în greutate, IMC și FM în grupul NC în comparație cu placebo nu au fost semnificative.
Multe studii au arătat efectele semnificative ale curcuminei (în special forme mai accesibile, cum ar fi NC) asupra măsurătorilor antropometrice (greutate, IMC, WC, FM) [6, 17,18,19,20,21,22,23,24,25 ]. Diferitele mecanisme au fost propuse pentru efectele curcuminei asupra măsurătorilor antropometrice, inclusiv inhibarea adipocitelor, lipogeneza, masa grasă și inflamația, creșterea lipolizei, consumul de energie [26, 27], și țesutul adipos brun și efectele asemănătoare probioticelor [24] ]. De asemenea, efectele nesfatinei asupra antropometriei includ scăderea poftei de mâncare [28, 29], IMC [26, 30, 31] și WC [26]. Prin urmare, îmbunătățirea WC în acest studiu poate fi atribuită nivelurilor crescute de ser de nesfatină prin suplimentarea NC.
Într-un studiu privind NAFLD, curcumina nu a modificat semnificativ SBP și DBP [17], deși SBP a fost semnificativ redusă în grupul NC în acest studiu. Cu toate acestea, efectele benefice ale curcuminei asupra tensiunii arteriale au fost raportate în două recenzii [20, 27]. Au fost propuse unele mecanisme, inclusiv îmbunătățirea reactivității vasculare [27], inflamația, stresul oxidativ și antropometria [20]. Studiile efectelor nesfatinei asupra hipertensiunii sunt divizive [32]. Motivul pentru care nu există modificări ale TA poate fi TA normală a participanților la momentul inițial.
NC la bărbații infertili a crescut semnificativ capacitatea antioxidantă totală și a redus nivelul CRP și TNF-α [61]. Țintele antiinflamatorii ale curcuminei au fost menționate TNF-α, IL-1β, NF-κB, IL-6, COX2, 5-LOX, iNOS, IL-17A, IL-17F și IL-22 [23]. De asemenea, mai multe recenzii au arătat efectele antiinflamatorii ale curcuminei [27, 36, 41,42,43,44,45,46,47,48,49, 62,63,64]. Mecanismele sale antiinflamatorii propuse au fost reducerea expresiei și eliberării factorilor inflamatori [27, 36, 39, 44, 63, 65] și activarea PPARγ [66]. De asemenea, scăderea WC poate îmbunătăți factorii inflamatori, inclusiv TNF-α, IL-6 și hs-CRP [49, 50]. Efectele benefice ale nesfatinei asupra inflamației și stresului oxidativ au fost raportate în studii anterioare, inclusiv reducerea expresiei NF-κB, IL-6, IL-1β, TNF-α și apoptoză [67, 68].
În doar două studii separate despre Jujube și Nigella sativa efectele asupra nesfatinei, Jujube au crescut nivelul ficatului și al plasmei. Efectele importante raportate pentru nesfatină sunt pierderea poftei de mâncare, anti-hiperglicemiant, antiinflamator, regulatori neuroendocrini, reducerea grăsimii corporale și reglarea metabolică [69]. Astfel, îmbunătățirile indicilor de glucoză [5, 54, 56,57,58], lipidelor [57, 58], inflamației [67] și antropometrice [5, 54, 56] și, ulterior, NAFLD, pot fi atribuite creșterii nivelurile de nesfatină prin suplimentarea NC.
Unele studii efectuate la animale cu privire la suplimentarea cu curcumină/turmemeric au arătat efectele benefice asupra ficatului gras și a aminotransferazelor serice [61, 70,71,72,73]. Într-un studiu pe pacienți cu NAFLD, curcumina a redus semnificativ gradul ficatului gras, ALT și AST [17]. Conform a trei analize separate, curcumina poate reduce ALT, AST [39, 40], ALP, GGT [40], steatoza, inflamația și ROS [21]. Cu toate acestea, un studiu al efectelor turmericului asupra enzimelor hepatice și a gradelor hepatice grase la pacienții cu NAFLD nu a prezentat modificări semnificative [22]. Motivul diferențelor poate fi tipul și forma suplimentării. Celelalte mecanisme propuse în îmbunătățirea enzimelor hepatice și a ficatului gras prin curcumină au fost reducerea markerilor inflamatori, sinteza/acumularea lipidelor, măsurătorile antropometrice [17] și stresul oxidativ [40, 70], activarea PPARγ și efectele asupra glicolizei [73]. De asemenea, efectul nesfatinei asupra ameliorării steatozei a fost raportat într-un studiu anterior efectuat pe animale [57].
Punctele forte au fost examinate mai întâi de efectul NC la pacienții obezi cu NAFLD, în special prin evaluarea nivelurilor de nefatină, randomizarea blocată stratificată, pacienții nou diagnosticați cu NAFLD care nu primeau tratament și evaluarea aporturilor dietetice și a nivelurilor de activitate fizică. Cu toate acestea, unele limitări nu au reprezentat biopsia hepatică și măsurarea GGT și anumiți factori menționați (PPAR-γ etc.), auto-raportare a aporturilor alimentare și a activității fizice, selectarea unui centru specific și lipsa verificării biodisponibilității și a nivelurilor sanguine ale NC.
Concluzie
Suplimentarea NC la pacienții cu NAFLD supraponderali și obezi a îmbunătățit unii markeri legați de obezitate și NAFLD, inclusiv nesfatină, QUICKI, gradul ficatului gras, WC, indici de glucoză, lipide, inflamații și transaminaze hepatice. Efectele NC asupra greutății, IMC, FM, SBP și DBP nu au fost semnificative. În consecință, mecanismul propus pentru ameliorarea NAFLD cu suplimentarea NC a fost aprobat prin creșterea nivelului seric de nesfatină și, probabil, îmbunătățirea ulterioară a profilurilor inflamatorii, lipidice și de glucoză. Sunt sugerate studii suplimentare cu privire la efectele curcuminei, care implică dimensiuni mai mari ale eșantionului, durate mai lungi, pacienți non-obezi și luând în considerare limitările menționate.
Abrevieri
Protein kinaza activată cu adenozină monofosfat
- PolitiFact Advocate 70% dintre texanii supraponderali sau obezi
- Pacienții obezi, supraponderali spitalizați cu pneumonie sunt cu 20 până la 30% mai puține șanse de a muri decât
- Șapte din 10 adulți americani sunt supraponderali sau obezi
- Pacienții supraponderali, obezi, cu risc mai mare de intervenție chirurgicală de înlocuire a genunchiului MDedge Endocrinology
- Supraponderal, dar gata de luptă; Oamenii obezi își îndreaptă pretențiile la judecată - New York