Tim C Kirkham
1 1 Departamentul de Psihologie, Universitatea din Reading, Earley Gate, Whiteknights, Reading RG6 6AL
Claire M Williams
1 1 Departamentul de Psihologie, Universitatea din Reading, Earley Gate, Whiteknights, Reading RG6 6AL
Filomena Fezza
2 2 Grupul de cercetare endocannabinoidă, Institutul de Chimie Biomoleculară, Consiliul Național de Cercetare, Compresorul Olivetti, Fabbr. 70, 80078, Pozzuoli (Napoli), Italia
Vincenzo Di Marzo
2 2 Grupul de cercetare endocannabinoidă, Institutul de Chimie Biomoleculară, Consiliul Național de Cercetare, Compresorul Olivetti, Fabbr. 70, 80078, Pozzuoli (Napoli), Italia
Abstract
Endocannabinoizii sunt implicați în reglarea apetitului și a greutății corporale. La rozătoare, anandamida stimulează alimentația prin acțiuni la receptorii centrali CB1, iar endocanabinoizii hipotalamici pot fi sub controlul negativ al leptinei. Cu toate acestea, modificările nivelurilor endocannabinoide ale creierului în relație directă cu hrănirea sau modificarea stării nutriționale nu au fost investigate.
Am măsurat nivelurile de anandamidă și 2-arahidonoil glicerol (2-AG) în regiunile cerebrale asociate hrănirii șobolanilor, în timpul postului, hrănirii unui aliment plăcut sau după saturare. Nivelurile endocannabinoide au fost comparate cu cele la șobolani hrăniți ad libitum, într-un moment al ciclului lor zilnic, când motivația de a mânca era absentă. Postul a crescut nivelurile de anandamidă și 2-AG în creierul limbic și, într-o măsură mai mică, de 2-AG în hipotalamus. Prin contrast, hipotalamicul 2-AG a scăzut pe măsură ce mâncau animalele. Nu au fost detectate modificări la șobolanii sățioși. Nivelurile endocannabinoide din cerebel, o regiune de control care nu este implicată direct în controlul aportului de alimente, nu au fost afectate de nicio manipulare.
Întrucât 2-AG a fost cel mai sensibil la variații în timpul hrănirii și la reglarea leptinei într-un studiu anterior, am examinat efectele comportamentale ale 2-AG atunci când a fost injectat în coaja nucleului accumbens, o zonă limbică a creierului puternic legată de motivația alimentară. 2-AG hrănire stimulată puternic și dependentă de doză. Acest efect a fost atenuat de antagonistul receptorului CB1 SR141716.
Aceste constatări furnizează primele dovezi directe ale nivelurilor modificate ale creierului de endocannabinoizi și, în special, de 2-AG, în timpul postului și al hrănirii. Natura acestor efecte susține un rol pentru endocannabinoizi în controlul motivației apetitive.
Introducere
Descoperirea receptorilor canabinoizi din sistemul nervos central (Devane și colab., 1988; Matsuda și colab., 1990) și liganzii lor endogeni, endocannabinoizii arahidonoil etanolamidă (anandamidă; Devane și colab., 1992), 2-arahidonoil glicerol (2-AG; Mechoulam și colab., 1995; Sugiura și colab., 1995) și eterul 2-arahidonil gliceril (eter noladin; Hanus și colab., 2001) au generat cercetări considerabile asupra semnificației lor comportamentale. Există dovezi din ce în ce mai mari pentru rolul sistemelor endocannabinoide în reglarea poftei de mâncare (Kirkham & Williams, 2001a), atât cu canabinoidul exogen, Δ 9-tetrahidrocannabinol (Δ 9-THC), cât și cu anandamida raportată că induc în mod fiabil supraalimentarea (Foltin et al ., 1988; Williams și Kirkham, 1998; Williams și Kirkham, 1999; 2002a; Hao și colab., 2000; Jamshidi și Taylor, 2001; Koch, 2001; Koch și Matthews, 2001). Aceste acțiuni hiperfagice sunt mediate de receptorii canabinoizi CB1 de tip central (Williams și Kirkham, 1999; 2002a), deoarece sunt blocați selectiv de antagonistul CB1, SR141716, dar nu și SR144258, un antagonist al receptorilor CB2 exprimați periferic (Munro și colab., 1993; Rinaldi-Carmona și colab., 1998). Prin contrast, blocarea selectivă CB1, singură, suprimă hrănirea (Arnone și colab., 1997; Simiand și colab., 1998; Colombo și colab., 1998; Kirkham și Williams, 2001b; Le Fur și colab., 2001), în timp ce șoarecii cu receptorii CB1 cu deficiențe genetice mănâncă mai puțin decât șoarecii de tip sălbatic ca răspuns la lipsa alimentelor (di marzo și colab., 2001).
Există și alte indicații că endocannabinoizii sunt componente cheie ale sistemelor care reglează atât hrănirea, cât și greutatea corporală. De exemplu, endocannabinoizii par a fi cruciale pentru alăptarea nou-născuților (Fride și colab., 2001) și sunt implicați în răspunsurile de hrănire pe scara filogenetică (de petrocellis și colab., 1999). În plus, biosinteza anandamidei hipotalamice și a 2-AG poate fi supusă controlului de către leptină, un hormon peptidic produs de adipocite despre care se crede că semnalează starea nutrițională regiunilor creierului care controlează apetitul (Friedman și Halaas, 1998). Astfel, administrarea de leptină suprimă nivelurile endocannabinoide hipotalamice la șobolanii normali; în timp ce șobolanii și șoarecii cu obezitate genetică, cronic hiperfagici exprimă niveluri ridicate, reversibile de leptină, anandamidă hipotalamică sau 2-AG (di marzo și colab., 2001).
Capacitatea de blocare sau ștergere genetică a receptorilor CB1 de a suprima alimentația indică faptul că eliberarea tonică de endocannabinoizi poate fi crucială pentru exprimarea normală a hrănirii. Cu toate acestea, până acum nu au existat măsuri directe ale nivelurilor endocannabinoide ale creierului legate în mod specific de apariția hrănirii sau de factori motivaționali care influențează consumul de alimente.
În studiul de față am explorat modificările legate de hrănire ale endocannabinoizilor cerebrali și am ales să examinăm nivelurile de anandamidă și 2-AG în hipotalamus și în creierul limbic al șobolanilor. După cum sa subliniat mai sus, există dovezi indirecte ale endocannabinoizilor hipotalamici susceptibili la manipulări care afectează comportamentul de hrănire, cum ar fi efectele potențial anorectice ale administrării leptinei și hiperfagia afișată de animalele obeze genetic. Creierul anterior limbic conține o serie de zone legate de hrănire, inclusiv zona învelișului nucleului accumbens (AcbSh). Regiunea cochiliei accumbens este mai sever implicată în generarea excitării emoționale și activării comportamentale ca răspuns la stimuli recompensați, inclusiv stimularea consumului (Kelley, 1999; Ikemoto & Panksepp, 1999; Stratford și colab., 1998). Ca control, am examinat, de asemenea, nivelurile de anandamidă și 2-AG în cerebel, o zonă a creierului care nu este implicată direct în motivația hrănirii.
Folosind o analiză sensibilă și specifică de cromatografie a gazelor-spectrometrie de masă (Bisogno și colab., 1999), am examinat nivelurile regionale de anandamidă și 2-AG la animale care au fost ucise: după lipsa de hrană; în timp ce se angajează în consumul unui aliment plăcut sau după ce s-a săturat de acel aliment. Nivelurile endocannabinoide la aceste animale au fost comparate cu cele de la șobolani neprivați, uciși la un moment dat în timpul ciclului lor zilnic de hrănire, când motivația de a mânca a fost minimă și hrănirea absentă. Am argumentat că, dacă activitatea endocannabinoidă este esențială pentru faza apetitivă a motivației pentru alimentație, atunci privarea de alimente, cu capacitatea sa evidentă de a provoca foamea, ne-ar maximiza capacitatea de a detecta modificările relevante ale anandamidei și 2-AG. Alternativ, dacă activitatea endocannabinoidă contribuie mai direct la recompensa orosenzorială în timpul ingestiei, modificările relevante ar trebui să fie maximizate, permițând animalelor să consume avid un aliment foarte gustos. În cele din urmă, examinarea creierului animalelor care mâncaseră până la sațietate a oferit un control suplimentar pentru a evalua implicarea specifică a endocannabinoizilor în toate etapele apetitului și hrănirii.
În plus față de aceste teste, am examinat și acțiunile acute asupra consumului de alimente din administrarea 2-AG. Deși s-a demonstrat că anandamida administrată exogen induce hiperfagia la șobolani și șoareci (Williams și Kirkham, 1999; Hao și colab., 2000; Jamshidi și Taylor, 2001) și 2-AG pot restabili alăptarea la șoarecii neonatali tratați cu SR141716 și colab. ., 2001), efectele hiperfagice directe ale 2-AG nu au fost încă publicate. Am ales să investigăm efectele 2-AG injectate direct în coaja nucleului accumbens. Această regiune exprimă receptorii CB1, precum și este asociată cu stimularea hrănirii și procesarea valorii de stimulare și recompensă a alimentelor și, în consecință, este un site potențial sensibil pentru acțiunile hiperfagice ale agoniștilor receptorilor canabinoizi. Pentru a evalua localizarea oricăror efecte comportamentale ale 2-AG pe coaja accumbens, am administrat și endocannabinoidul în ventriculul lateral.
Furnizăm dovezi ale variației atât în anandamidă, cât și în 2-AG în creierul șobolanului, în funcție de modificările stării nutriționale și a comportamentului de hrănire și demonstrăm că 2-AG poate stimula consumul de mâncare prin acțiuni la receptorii CB1 din creierul anterior din cadrul unui nucleu cheie legat de apetit.
Metode
Animale
Șobolani Lister masculi adulți (Harlan, Marea Britanie) cu o greutate de aproximativ 450 g la începutul testării au fost adăpostiți individual sub un ciclu inversat de lumină/întuneric 12:12 h (luminile stinse la 1000). Mâncarea și apa erau disponibile gratuit în orice moment, cu excepția cazului în care se specifică mai jos. Toate procedurile au fost efectuate în conformitate cu specificațiile Legii din 1986 a Regatului Unit pentru animale (proceduri științifice).
Nivelurile endocannabinoide ale creierului în raport cu hrănirea și privarea
Tratamentul animalelor
Toate animalele au fost ucise prin creșterea concentrației de CO2, creierul lor îndepărtat imediat și înghețat pe gheață uscată. Hipotalamusul și creierul limbic de la animalele din fiecare grup au fost disecate rapid, combinate și congelate în azot lichid. Probele au fost ulterior trimise pe gheață uscată la laboratorul din Napoli.
Extracția și cuantificarea endocannabinoizilor
Țesuturile au fost omogenizate în 5 vol cloroform/metanol/Tris HCI 50 m M (2: 1: 1) conținând 1 nmol de d8-anandamidă și d8-2-AG. Standardele deuterizate au fost sintetizate din acid arahidonic d8 și etanolamină sau glicerol așa cum este descris, respectiv, în Devane și colab. (1992) și Bisogno și colab. (1997). Omogenatele au fost centrifugate la 13000 g timp de 16 min (4 ° C), faza apoasă plus resturile au fost colectate și extrase din nou de două ori cu 1 vol de cloroform. Fazele organice din cele trei extracții au fost reunite și solvenții organici s-au evaporat într-un evaporator rotativ. Probele liofilizate au fost apoi depozitate congelate la -80 ° C sub atmosferă de azot până când au fost analizate.
Analiza conținutului de endocannabinoizi de către GC-MS
analize statistice
Mediile ± semestru (n = 4) ale cantităților endocannabinoide din aceeași zonă din diferite grupuri de hrănire au fost comparate cu ANOVA unidirecțional, urmat de testul Bonferroni cu un prag de semnificație de P -1 și respectiv 3 mg kg -1,) după inducerea analgeziei buprenorfinei (0,3 mg kg −1). Șobolanii au fost apoi implantați cu o canulă de ghidare din oțel inoxidabil cu calibru 26, folosind o tehnică stereotaxică cu craniu plat. Un grup a primit canule bilaterale care vizează coaja nucleului accumbens (AcbSh; coordonate relative la bregma: anteroposterior, +1,2 mm; lateromedial, ± 1,0 mm; dorsoventral, -7,0 mm). Un al doilea grup a fost implantat cu o singură canulă îndreptată spre ventriculul lateral (VS; coordonate: AP, -1,0 mm; LM +1,6 mm; DV-3,0 mm). Coordonatele au fost determinate prin referire la atlasul lui Paxinos și Watson (1986). După fixarea pe craniu cu șuruburi din oțel inoxidabil și ciment dentar, canulele au fost sigilate cu stilete pentru a-și menține permeabilitatea.
Procedură
Începând cu 14 zile după operație, șobolanii au fost familiarizați cu procedurile de perfuzare a medicamentelor și cu condițiile de testare descrise mai jos. Pentru a stabili aporturi stabile, s-au efectuat perfuzii simulate și 2 ore teste de admisie pe parcursul unei săptămâni, cu perfuzie salină intracerebrală în ultima zi de bază.
În fiecare zi de testare, cu 10 minute înainte de apariția întunericului, șobolanii au fost îndepărtați din cuștile de testare și li s-au administrat microinfuzii bilaterale VB sau simultane AcbSh de 0,15 M vehicul salin sau 2-AG (0,125, 0,5, 2,0 μg pe șobolan; Nottingham, Marea Britanie). Momentul injecțiilor a fost ales pentru a coincide cu obiceiurile de hrănire nocturne ale șobolanilor, pentru a spori activitatea endogenă, legată de hrănire, a sistemelor canabinoide cerebrale. Infuziile au fost livrate pe parcursul a 90 de secunde prin injectoare cu gabarit 33 (proiectând 1,0 mm dincolo de vârful canulei de ghidare), folosind pompe automate cu microsinge într-un volum de 0,5 μl pe parte (AcbSh) sau 1,0 μl pe șobolan (LV). Pentru injecțiile bilaterale, jumătate din doza totală a fost administrată în fiecare parte a creierului. La un minut după finalizarea fiecărei perfuzii, injectoarele au fost îndepărtate, canulele resigilate și șobolanii așezați în camerele lor de testare. Alimentele (chow; PCD Mod C; Servicii de dietă specială, Witham, Marea Britanie) și aportul de apă au fost ulterior măsurate după 1 și 2 ore, cu corecția adecvată pentru vărsarea alimentelor. Toți șobolanii au primit toate tratamentele, conform unui design contrabalansat, cu cel puțin 48 de ore între tratamentele succesive.
După finalizarea seriei inițiale de răspuns la doză, șobolanii cu canule AcbSh au fost re-testați pentru a examina capacitatea antagonistului CB1 SR141716 [[N-piperidino-5- (4-clorofenil) -1- (2,4-diclorfenil) -4-metilpirazol-3-carboxamidă]; Vernalis Ltd, Wokingham, Marea Britanie) pentru a bloca acțiunile comportamentale ale celei mai puternice doze de 2-AG. Cu 30 de minute înainte de debutul întunecat, șobolanii au primit o injecție subcutanată de 0,5 mg kg -1 SR141716 (dizolvată în soluție 10% DMSO, într-un volum de 1 ml kg -1). Infuziile bilaterale de ser fiziologic sau 0,5 μg 2-AG au fost administrate 20 de minute mai târziu, iar aportul de alimente a fost monitorizat în următoarele 2 ore. Doza SR141716 a fost aleasă din observația noastră anterioară a capacității sale de a atenua acțiunile hiperfagice ale Δ 9-THC și anandamidei (Williams și Kirkham, 1999; 2002a).
Histologie
La finalizarea testării, șobolanii au fost uciși cu CO2 și decapitați. Cerneala India a fost injectată în fiecare canulă LV, într-un volum de 1 μl, înainte de decapitare. Capetele au fost plasate într-o soluție tamponată cu 10% zaharoză, 10% fosfat de formaldehidă timp de 4 zile. Ulterior, creierele au fost îndepărtate, secționate coronal și colorate cu violet crezil. Urmele canulei au fost determinate prin inspecție vizuală la microscop. Prezența cernelii în ventricule a confirmat plasarea canulei VS. Aceste inspecții au arătat că locurile de injectare pentru două animale din grupul accumbens se aflau în afara AcbSh. Datele de la aceste animale au fost excluse din analizele de date ulterioare.
analize statistice
Datele de admisie pentru fiecare grup au fost analizate folosind ANOVA unidirecțional pentru măsuri repetate. Comparații post-hoc au fost făcute cu testul Newman-Keuls pentru comparații multiple.
Rezultate
Modificări legate de hrană în nivelurile endocannabinoide
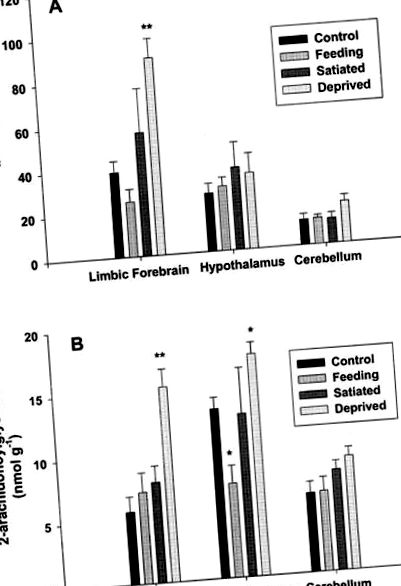
Analiza nivelurilor regionale de anandamidă și 2-AG în țesutul cerebral a relevat schimbări distincte ca răspuns la manipulările noastre experimentale (Figura 1). În condiții de control (grupa 1), nivelurile de anandamidă au fost cele mai ridicate în creierul limbic, în timp ce 2-AG a fost cel mai mare în hipotalamus. Nivelurile de anandamidă din cerebelul șobolanilor martor au fost mai mici decât în alte țesuturi, în timp ce nivelurile de 2-AG au fost similare cu cele din creierul limbic. Important, nivelurile de anandamidă cerebelară și nivelurile de 2-AG au rămas constante în toate condițiile.
Nivelurile endocannabinoide din creierul limbic, hipotalamusul și cerebelul șobolanilor în raport cu postul, hrănirea și satierea. Sunt prezentate date pentru nivelurile de anandamidă (A) și nivelurile de 2-arahidonoil glicerol (B) și sunt exprimate ca pmol sau respectiv nmol, pe gram de greutate a țesutului umed. Toate valorile sunt medii ± adică mijlocul de n = 4. * P ** P Figura 2) a dezvăluit că, la șobolanii noștri de hrănire liberă, injecția bilaterală de 2-AG în coaja nucleului accumbens a produs o acțiune stimulatoare clară, pe termen scurt, asupra comportamentului de hrănire. Mai exact, endocannabinoidul a crescut semnificativ cantitatea consumată în prima oră după administrare (P Figura 2). Administrarea antagonistului în monoterapie nu a avut niciun efect fiabil asupra aportului alimentar inițial deja scăzut (datele nu sunt prezentate). Spre deosebire de efectele asupra consumului de alimente, nu au fost detectate efecte asupra consumului de apă după tratamentul cu 2-AG; animale rareori angajate în băut în timpul oricărui test. În cele din urmă, trebuie remarcat faptul că 2-AG nu pare să introducă niciun comportament neobișnuit, nespecific, care ar putea explica creșterea consumului de alimente.
Creșteri legate de doză ale consumului de alimente în decurs de o oră după perfuzia bilaterală cu 2-arahidonoil glicerol accumbens. Toate valorile sunt medii ± adică de la opt șobolani. ** P *** P †† P −1, s.c.).
Spre deosebire de efectele hiperfagice induse de 2-AG intra-accumbens, infuzia de 2-AG în ventriculul lateral nu a reușit să exercite niciun efect evident asupra aportului alimentar în timpul oricărei perioade de măsurare. Aporturile medii de 1 h după administrarea ventriculară laterală de 2-AG au fost: vehicul = 2,84 ± 0,4 g; 0,125 μg = 2,72 ± 0,57 g; 0,5 μg = 2,05 ± 0,49 g; 2,0 μg = 2,99 ± 0,8 g. Deși aporturile inițiale pentru acest grup au fost relativ ridicate, este puțin probabil ca efectele plafonului să fi ascuns hiperfagia 2-AG. Într-adevăr, aportul de 1 oră după cea mai eficientă doză de 2-AG intra-accumbens (0,5 μg) a depășit semnificativ valoarea inițială a ventriculului lateral (P 9-THC care poate induce hiperfagia promovează, de asemenea, eliberarea de dopamină în interiorul accumbens (Tanda și colab., 1997 Gardner și Vorel, 1998; Ameri, 1999) și stimulează semnificativ biosinteza anandamidei în creierul limbic (di marzo și colab., 2000).
Am raportat în altă parte că administrat periferic Δ 9-THC și anandamidă provoacă în mod activ animalele sățioase să se apropie de hrană și să înceapă hrănirea (Williams și Kirkham, 2002b). Am interpretat aceste efecte ca dovezi ale unei acțiuni a canabinoizilor pentru a crește valoarea de stimulare sau stimulare a stimulilor alimentari și a induce apetitul pentru alimente, analog efectelor privării de alimente. În conformitate cu această propunere, șoarecii CB1 -/- cu receptori CB1 cu deficiențe genetice se disting de colegii lor de tip sălbatic printr-un răspuns hiperfagic redus la post (di marzo și colab., 2001), deși aparent prezintă niveluri normale de aport și greutăți corporale în condiții ad libitum. Potența 2-AG în coaja accumbens este, de asemenea, consecventă cu implicarea endocannabinoidelor în stimularea apetitului. După cum am discutat mai devreme, există dovezi bune din alte paradigme pentru implicarea endocannabinoidelor în procesele de stimulare/apetitiv. Astfel, Gallate și colegii săi au constatat că un agonist CB1, CP 55940, a crescut punctele de rupere la șobolanii care lingeau soluții de zaharoză (adică șobolanii ar lucra mai mult pentru a obține zaharoza), efect care a fost blocat de SR141716 (Gallate și McGregor, 1999 ).
În concluzie, studiile de față au demonstrat legături clare între activitatea canabinoidă endogenă și motivația hrănirii. Au arătat, de asemenea, că endocannabinoidul 2-AG poate stimula puternic alimentația. În general, aceste constatări sunt în concordanță cu rapoartele anterioare și consolidează rolul endocannabinoizilor în reglarea fiziologică a poftei de mâncare și a greutății corporale, potențial prin acțiuni asupra sistemelor cerebrale care mediază procesele de stimulare și recompensare.
- Evaluarea efectului postului Ramadan asupra pacienților musulmani cu diabet în raport cu utilizarea
- Ghid de post Nativity Fast 2019; Biserica Ortodoxă Toți Sfinții
- Post în 24 de ore de lumina soarelui Ramadan în cercul polar polar Mvslim
- Postul în Ramadan nu este asociat cu deteriorarea bolii renale cronice A prospective
- Postul este unul dintre cei cinci stâlpi ai Islamului