Robert R. Henry
un Centru pentru Cercetări Metabolice, VA San Diego Healthcare System și Universitatea din California San Diego, San Diego, CA, SUA
Robert Chilton
b Spitalul Universitar de Boli Cardiovasculare și Cardiologie Intervențională, San Antonio, TX, SUA
W. Timothy Garvey
c Departamentul de Științe Nutritive, Universitatea din Alabama la Birmingham și Centrul Medical VA din Birmingham, Birmingham, AL, SUA
Abstract
Pierderea moderată în greutate (> 5%), care a fost asociată cu îmbunătățiri ale parametrilor glicemici la pacienții cu disglicemie, reduce și prezența altor comorbidități, inclusiv dislipidemie și hipertensiune, culminând cu un risc redus de boli cardiovasculare. Modificările stilului de viață sunt abordarea preliminară recomandată pentru scăderea în greutate, cu un obiectiv inițial de scădere în greutate de 10% din greutatea corporală atins în decurs de 6 luni, cu o rată de 1-2 lire sterline pe săptămână, selectată ca țintă adecvată pentru a reduce severitatea obezității. factori de risc asociați. Implementarea și menținerea modificărilor stilului de viață asociate cu pierderea în greutate poate fi totuși dificilă pentru mulți pacienți. Prin urmare, pot fi uneori necesare intervenții suplimentare. Chirurgia bariatrică poate fi, de asemenea, o opțiune extrem de eficientă pentru pierderea în greutate și reducerea comorbidității, dar intervenția chirurgicală prezintă riscuri considerabile și este încă aplicabilă doar pacienților selectați cu diabet de tip 2. Astfel, atenția se îndreaptă spre utilizarea medicamentelor pentru slăbit, inclusiv 2 compuși aprobați recent: lorcaserin de două ori pe zi și o combinație o dată pe zi de fentermină și topiramat cu eliberare prelungită, ambele fiind dovedite a fi terapii sigure și eficiente în gestionarea obezitate la pacienții cu diabet zaharat de tip 2.
1. Introducere
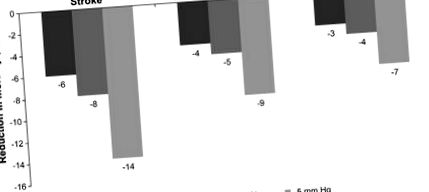
Reduceri ale mortalității prin reducerea tensiunii arteriale sistolice (SBP) (Chobanian și colab., 2003; Whelton și colab., 2002). Figura adaptată din Whelton și colab., 2002.
3.1. Schimbările stilului de viață
Modificările stilului de viață, care implică modificarea dietei, a activității fizice și a comportamentului, sunt abordările inițiale ale terapiei de slăbire recomandate de Institutul Național al Inimii, Plămânilor și Sângelui (NHLBI) (Institutul Național al Inimii, Plămânilor și Sângelui. Ghidurile clinice privind identificarea, 1998). Liniile directoare NHLBI afirmă că o scădere inițială în greutate de 10% din greutatea corporală realizată în decurs de 6 luni, cu o rată de 1 până la 2 kilograme pe săptămână, este o țintă adecvată pentru a reduce severitatea factorilor de risc legați de obezitate (National Heart, Lung, Și Institutul de sânge. Ghidurile clinice privind identificarea, 1998). ADA recomandă, de asemenea, pierderea în greutate de 7% sau mai mult pentru toate persoanele supraponderale sau obeze care au sau sunt expuse riscului de a dezvolta T2DM, citând reducerea calorică, activitatea fizică și modificarea comportamentului ca elemente importante în sprijinirea și menținerea pierderii în greutate (American Diabetes Association), 2012).
În studiul Look AHEAD (Acțiune pentru sănătate în diabet), scăderea în greutate de 8,6% cu intervenție intensivă în stilul de viață (Tabelul 1) a fost asociată cu îmbunătățiri semnificative ale factorilor de risc BCV la 5145 de participanți supraponderali/obezi cu T2DM (Tabelul 2) Research Group et. al., 2007). Atunci când se stratifică acești pacienți în funcție de gradul de scădere în greutate, cei care au realizat o scădere în greutate de 5% până la a de la momentul inițial până la anul 4 (P = .0032 vs PBO)
Scăderea SBP (P a A 75-g test de toleranță la glucoză pe cale orală (OGTT) a fost efectuat la momentul inițial și apoi la fiecare 6 luni. Diagnosticul T2DM s-a bazat pe o singură măsură de 2 ore a glicemiei totale ≥10 mmol/L. prima 6 luni de studiu, printr-o modificare a protocolului, pacienții cu OGTT diabetic au suferit o repetare a OGTT în decurs de 4 săptămâni. Un test pozitiv repetat s-a bazat pe o glucoză din sânge integral de 2 ore ≥10 mmol/L, o glucoză în sânge integral ≥6,7 mmol/L, sau 2 măsurători consecutive ale glicemiei în repaus alimentar ≥6,7 mmol/L.
Pierderea în greutate numai prin modificările stilului de viață este adesea dificil de implementat și întreținut (Barte și colab., 2010; UKPDS Group, 1990), aproape jumătate dintre pacienți nu reușesc să mențină ≥75% din pierderea inițială în greutate în decurs de 52 de săptămâni (Wadden și colab. ., 2010). Prin urmare, intervențiile medicale, cum ar fi intervențiile chirurgicale sau farmacoterapia, pot fi un adjuvant necesar la unii pacienți.
3.2. Chirurgie bariatrică
Chirurgia bariatrică este recomandată pentru a fi luată în considerare la adulții cu indicele de masă corporală (IMC)> 35 kg/m2 și T2DM, mai ales dacă T2DM sau comorbiditățile asociate sunt dificil de controlat cu stilul de viață și terapia farmacologică (American Diabetes Association, 2012). Chirurgia poate fi o opțiune extrem de eficientă pentru reducerea greutății și comorbidității, oferind o pierdere în greutate semnificativă din punct de vedere medical, care este susținută mai mult de 5 ani la majoritatea pacienților (Institutul Național al Inimii, Plămânilor și Sângelui. Ghidurile clinice pentru identificare, 1998). S-a demonstrat că intervenția chirurgicală bariatrică îmbunătățește funcția celulelor β pancreatice (Hofsø și colab., 2011) și poate reduce necesitatea medicației la pacienții obezi cu T2DM și poate duce la remisie T2DM și hipertensiune arterială în unele cazuri (tabelele 1 și 2). 2) (Cunneen, 2008; Kadera și colab., 2009).
3.3.1.1. Evenimente adverse
În timpul studiului XENDOS, cele mai frecvente evenimente adverse cu orlistat au fost gastro-intestinale, incluzând flatusul cu secreție, pete uleioase și urgență fecală; acestea au fost de natură ușoară până la moderată (Davidson și colab., 1999; Torgerson și colab., 2004). Scăderi semnificative ale vitaminelor liposolubile (A, D, E, K1) din grupul orlistat au apărut în comparație cu placebo (Torgerson și colab., 2004); cu toate acestea, nivelul mediu al fiecărei vitamine evaluate a fost în intervalul de referință în timpul studiului de 4 ani. Subiecții cărora li se administrează orlistat sunt instruiți să ia suplimente de vitamine ≥ 2 ore înainte sau după doza lor de seară (XENICAL 2012).
3.3.2. Lorcaserin
În 2012, FDA a aprobat medicamentul lorcaserin pentru scăderea în greutate, un agonist selectiv al receptorului serotoninei 2C care acționează central pentru a promova pierderea în greutate prin reducerea aportului de alimente și promovarea sațietății (BELVIQ 2012). Mecanismul exact de acțiune nu este cunoscut. Deoarece lorcaserina acționează asupra receptorilor serotoninergici, există potențialul sindromului serotoninei, care se manifestă în simptome autonome, cognitive și somatice care pot pune viața în pericol. Ca urmare, ar trebui să se recurgă la prudență extremă atunci când lorcaserina este utilizată în combinație cu alte medicamente cu acțiune serotoninergică, inclusiv, dar fără a se limita la, inhibitori selectivi ai recaptării serotoninei-norepinefrinei, inhibitori selectivi ai recaptării serotoninei, triptani și inhibitori ai monoaminoxidazei (BELVIQ 2012) .
Lorcaserin este recomandat să fie administrat la o doză de 10 mg oral BID împreună cu intervenția stilului de viață, inclusiv o dietă cu calorii reduse și o activitate fizică crescută. După 12 săptămâni, terapia trebuie evaluată și, dacă pacientul nu a pierdut ≥ 5% din greutatea corporală inițială, terapia cu lorcaserin trebuie întreruptă (BELVIQ 2012).
3.3.2.1. Pierdere în greutate
3.3.2.3. Evenimente adverse
În timpul studiilor BLOOM și BLOSSOM, cele mai frecvente evenimente adverse au fost infecțiile respiratorii superioare, dureri de cap, amețeli, nazofaringită și greață (Fidler și colab., 2011; Smith și colab., 2010). Ratele de valvulopatie definite de FDA după 1 an au fost echivalente în toate grupurile: 2,7% în grupul lorcaserin 10 mg BID comparativ cu 2,3% în grupul placebo în studiul BLOOM și 2,0%, 1,4% și 2,0% în lorcaserin 10 mg BID, lorcaserin 10 mg QD și brațe placebo, respectiv, în studiul BLOSSOM (Fidler și colab., 2011; Smith și colab., 2010). La fel ca în studiile BLOOM și BLOSSOM, cele mai frecvente evenimente adverse raportate de subiecții cu T2DM în studiul BLOOM-DM au fost cefaleea, durerile de spate, nazofaringita și greața (O’Neil și colab., 2012). În săptămâna 52 în studiul BLOOM-DM, 2,9% și 2,5% dintre pacienții lorcaserin 10 mg BID și, respectiv, lorcaserin 10 mg QD T2DM, au raportat valvulopatie nouă, dar rata la pacienții tratați cu placebo cu T2DM a scăzut la 0,5%; aceste modificări nu au fost semnificative (O'Neil și colab., 2012). În plus, hipoglicemia raportată de pacient a apărut la 29,3% dintre subiecții cărora li s-a administrat lorcaserin 10 mg BID și 21,0% dintre subiecții cărora li s-a administrat placebo (BELVIQ 2012), hipoglicemia simptomatică a apărut la 7,4% dintre subiecții care au primit T2DM care au primit lorcaserin 10 mg BID, 10,5% au primit lorcaserin 10 mg QD și 6,3% care au primit placebo; ambele au fost mai frecvente la subiecții care au primit sulfoniluree (O'Neil și colab., 2012).
3.3.3. Fentermină și topiramat cu eliberare prelungită
A fost propus un algoritm de tratament pentru a maximiza riscul beneficiu-pacient. Tratamentul trebuie să înceapă cu PHEN 3,75 mg/TPM ER 23 mg (3,75/23) QD timp de 2 săptămâni (14 zile) și apoi să crească la PHEN 7,5 mg/TPM ER 46 mg (7,5/46) QD timp de 12 săptămâni (QSYMIA 2012) . Pierderea în greutate trebuie evaluată după 12 săptămâni cu doza 7,5/46 și, dacă pacientul nu a pierdut ≥3% din greutatea corporală, tratamentul trebuie întrerupt sau doza crescută la PHEN 15 mg/TPM ER 92 mg (15/92 ) într-un proces în 2 etape, crescând la PHEN 11,25 mg/TPM ER 69 mg QD timp de 2 săptămâni urmat de 15/92 QD timp de 12 săptămâni. Dacă după 12 săptămâni suplimentare de tratament cu 15/92 un pacient nu a pierdut ≥ 5% din greutatea corporală inițială, tratamentul trebuie întrerupt conform instrucțiunilor.
Eficacitatea și siguranța PHEN/TPM ER au fost evaluate în două studii de fază 3 randomizate, dublu-orb, controlate cu placebo. Studiul EQUIP a evaluat 1267 adulți obezi (IMC ≥35 kg/m2) randomizați la placebo, 3,75/23 sau 15/92 (Allison și colab., 2012). Studiul CONQUER a evaluat 2487 de adulți supraponderali și obezi (IMC ≥27 kg/m 2 și ≤45 kg/m 2) cu comorbidități ≥2 legate de greutate, inclusiv T2DM și boli cardiovasculare (Gadde și colab., 2011). Subiecții au fost randomizați la placebo, 7,5/46 sau 15/92. După primele 56 de săptămâni de tratament în CONQUER, 676 de subiecți dintr-un subset de site-uri au continuat în studiul de extensie SEQUEL, care a evaluat subiecții pentru încă 52 de săptămâni, menținând în același timp randomizarea lor orbită inițială (Garvey și colab., 2012). Toți subiecții au fost tratați cu standard de îngrijire pentru comorbiditățile lor respective, inclusiv T2DM, și au primit consiliere dietetică și de stil de viață pe baza programului LEARN (Brownell, 2000).
3.3.3.1. Pierdere în greutate
În studiul EQUIP, utilizarea PHEN/TPM ER a dus la pierderea semnificativă în greutate în decurs de 56 de săptămâni în comparație cu placebo și mai mulți subiecți au obținut o pierdere în greutate de ≥ 5% la 1 an decât cei care au primit placebo (P Tabelul 1) (Allison et. al., 2012). După 1 an în studiul CONQUER, pierderea ponderală medie LS în populația totală a fost semnificativ mai mare decât cu placebo (P Tabelul 1) (Gadde și colab., 2011) și a fost susținută timp de 2 ani în studiul SEQUEL (P Tabelul 1 Fig. 2C) (Garvey și colab., 2012). În studiul CONQUER, mai mulți subiecți care au primit PHEN/TPM ER au obținut o pierdere în greutate de ≥ 5% la 1 an decât cei care au primit placebo (P Tabelul 1) (Gadde și colab., 2011) și acest lucru a fost menținut, de asemenea, timp de 2 ani în procesul SEQUEL (P Tabelul 1) (Garvey și colab., 2012). În mod similar, acei subiecți care au prezentat T2DM la momentul inițial au prezentat o pierdere semnificativă în greutate în LS semnificativă după 1 an de tratament (P Fig. 2D) (Gadde și colab., 2011; Garvey, Peterson și Troupin, 2010). O analiză combinată a rezultatelor studiilor clinice a constatat că 83,5% dintre subiecții care au finalizat 12 săptămâni de tratament 7,5/46 au răspuns (≥3% pierdere în greutate la 12 săptămâni), așa cum este definit în etichetă (Dvorak, Peterson și Day, 2012; QSYMIA 2012).
3.3.3.2. Parametri cardiometabolici
Ca și în populația generală, subiecții cu T2DM la momentul inițial care au primit PHEN/TPM ER au avut îmbunătățiri mai mari față de placebo în parametrii glicemici la 1 an în studiul CONQUER (Tabelul 2) (Gadde și colab., 2011). Aceste îmbunătățiri ale parametrilor glicemici au fost mai mari cu PHEN/TPM ER decât cu placebo și mai puțini dintre acești subiecți gestionați activ care au primit PHEN/TPM ER au necesitat o creștere a medicamentelor antidiabetice concomitente (Gadde și colab., 2011): 12,1% dintre subiecții cu T2DM în grupul placebo a necesitat o creștere netă a medicamentelor antidiabetice, comparativ cu doar 1,5% și 0,6% dintre subiecții din grupurile 7,5/46 și respectiv 15/92 (Garvey și colab., 2010).
3.3.3.3. Evenimente adverse
În studiul EQUIP, cele mai frecvente evenimente adverse au fost paraestezie, gură uscată, constipație, cefalee, disgeuzie și insomnie (Allison și colab., 2012); în studiul CONQUER, gură uscată, parestezie, constipație, insomnie, amețeli și disgeuzie. În mod similar, tipurile de evenimente adverse care au avut loc între anii 1 și 2 în studiul SEQUEL au fost similare cu cele raportate în eșantionul general CONQUER de la momentul inițial până în anul 1, deși incidența evenimentelor adverse emergente ale tratamentului individual a fost semnificativ mai mică în al doilea an (săptămânile 56–108) (Garvey și colab., 2012). În EQUIP și CONQUER, s-au înregistrat mici creșteri ale ritmului cardiac mediu: EQUIP, -0,2, -0,3 și 1,2 bpm cu placebo, 3,75/23 și respectiv 15/92 (Allison și colab., 2012); CONQUER, -0,1, 0,1 și 1,7 bpm cu placebo, 7,5/46 și respectiv 15/92 (Gadde și colab., 2011; Garvey și colab., 2012). Cu toate acestea, TA medie a scăzut cu tratamentul PHEN/TPM ER față de placebo și nu au fost raportate evenimente adverse care să fi fost asociate cu modificări ale ritmului cardiac (Allison și colab., 2012; Gadde și colab., 2011; Garvey și colab., 2012 ).
3.4. Farmacoterapii investigaționale pentru scăderea în greutate
3.4.1. Naltrexonă cu eliberare susținută și bupropion cu eliberare susținută
O terapie suplimentară investigată pentru tratamentul obezității este o combinație de naltrexonă cu eliberare susținută (SR) și bupropion SR. Programul Contrave Obesity Research (COR) a constat din patru studii de 1 an, faza 3, a pacienților supraponderali/obezi: COR-I (Greenway și colab., 2010), COR-II (Rubino și colab., 2010) și COR -Modificare comportamentală (COR-BMOD) (Wadden și colab., 2011), care exclude participanții cu T2DM; și COR-Diabetes Mellitus (CORDM) (Hollander și colab., 2010), care a inclus participanți cu T2DM (Makowski, Gwinn și Hurren, 2011). Participanții la COR-I, COR-II și COR-DM au primit consiliere privind stilul de viață, inclusiv reducerea consumului de energie cu 500 kcal/zi și creșterea activității fizice, la momentul inițial și la fiecare 12 săptămâni (Greenway și colab., 2010; US Food & Drug Administrație, 2012). Alternativ, participanții la studiul COR-BMOD au participat la vizite de grup multidisciplinare de 90 de minute săptămânal timp de 16 săptămâni și lunar după aceea și li s-au prescris diete de la 1200 la 2000 kcal/zi și au fost încurajați să se angajeze în activitate fizică timp de 180 min/săptămână în primele 6 luni, crescând la 360 min/săptămână după aceea (Wadden și colab., 2011).
În fiecare dintre aceste studii, naltrexona SR/bupropion SR a produs o scădere mai mare în greutate și îmbunătățiri ale parametrilor cardiometabolici în comparație cu placebo (Tabelul 1) (Greenway și colab., 2010; Makowski și colab., 2011; US Food & Drug Administration, 2012 Wadden și colab., 2011). În studiul CORDM, la pacienții cu T2DM care utilizează medicamente orale sau fără medicamente antidiabetice, s-a constatat că naltrexona SR/bupropion SR induce pierderi semnificative în greutate și îmbunătățiri ale HbA1c, precum și îmbunătățiri ale circumferinței taliei, trigliceridelor și colesterolului HDL (Tabelul 2) (Hollander și colab., 2010; Makowski și colab., 2011; US Food & Drug Administration, 2012). În toate studiile, după 56 de săptămâni de tratament, grupurile placebo au înregistrat scăderi mai mari în SBP și DBP decât în grupurile cu naltrexonă SR/bupropion SR (Makowski și colab., 2011; US Food & Drug Administration, 2012). În studiile de fază 3, cele mai frecvente evenimente adverse au fost greață, constipație, cefalee, vărsături și amețeli. Mai mult, la 56 de săptămâni, frecvența cardiacă a crescut cu o medie de 0,3 bpm cu naltrexonă SR/bupropion SR față de -0,98 bpm cu placebo (Makowski și colab., 2011; US Food & Drug Administration, 2012).
În ianuarie 2011, FDA a emis Orexigen, producătorul de naltrexonă SR/bupropion SR, o scrisoare de răspuns completă în care s-a solicitat un studiu al rezultatelor cardiovasculare (CVOT; The Light Study). Orexigen a inițiat înscrierea în CVOT în mai 2012. Data estimată de finalizare a CVOT este iulie 2017. Data finalizării va depinde de timpul necesar pentru a acumula suficiente evenimente pentru a evalua statistic ratele de pericol dintr-o analiză intermediară. Măsura rezultatului primar va fi timpul de la randomizarea perioadei de tratament până la prima apariție confirmată a evenimentului cardiovascular advers major (MACE), cu puncte finale secundare, incluzând timpul de la randomizarea perioadei de tratament până la prima deces cardiovasculară confirmată, infarct miocardic (fatal/non-fatal) ), accident vascular cerebral (fatal/non-fatal) și angina instabilă non-fatală care necesită spitalizare (rezultate cardiovasculare, 2012). Subiecții vor include adulți supraponderali și obezi (IMC ≥27 și ≤50 kg/m 2) cu vârsta ≥45 ani care prezintă un risc ridicat de a experimenta aceste evenimente din cauza T2DM și/sau a altor factori de risc cardiovascular; participanții vor fi randomizați la placebo sau naltrexonă SR 32 mg/buproprion SR 360 mg/zi.
3.4.2. Liraglutidă
4. Concluzie
Pe măsură ce ratele de obezitate și T2DM continuă să crească, nevoia de strategii eficiente de slăbit devine mai urgentă. În timp ce intervențiile pentru stilul de viață și chirurgia bariatrică s-au dovedit a reduce greutatea corporală și îmbunătățesc factorii de risc legați de T2DM și BCV, intervențiile de stil de viață singure sunt dificil de întreținut, iar chirurgia bariatrică, disponibilă unui număr limitat de pacienți, poate fi asociată cu o riscuri. Orlistatul disponibil în prezent a demonstrat doar o pierdere moderată în greutate, iar aderența este limitată de tolerabilitate. Lorcaserin și PHEN/TPM ER au fost recent aprobate de FDA, iar studiile clinice au demonstrat atât o scădere semnificativă, durabilă în greutate în comparație cu placebo, cât și îmbunătățiri ale parametrilor glicemici și factori de risc cardiometabolici la pacienții supraponderali/obezi cu și fără T2DM. Atât lorcaserin, cât și PHEN/TPM ER au fost bine tolerate în studiile clinice și vor fi urmate pentru siguranță pe termen lung. Aceste rezultate sugerează că lorcaserin sau PHEN/TPM ER, atunci când sunt utilizate împreună cu modificări ale stilului de viață, pot reprezenta o terapie sigură și eficientă pentru gestionarea obezității la pacienții cu T2DM.
Mulțumiri
Dorim să recunoaștem și să mulțumim grupului Lockwood pentru asistență editorială (finanțarea a fost asigurată de VIVUS, Inc.) și VIVUS, Inc. colaboratori interni.
Note de subsol
☆ Dr. Henry a fost consilier pentru VIVUS, Inc. Dr. Garvey a fost consilier și investigator pentru VIVUS, Inc. și este, de asemenea, acționar al VIVUS, Inc. Dr. Chilton este consilier și vorbitor pentru VIVUS, Inc.
☆ ☆ Sprijinul acordat: nici unul.
★ Finanțare: VIVUS, Inc., pentru asistență manuscrisă.
- Remediile obezității naturale pe bază de plante; Opțiuni de tratament pentru obezitate organică Natural
- Hormonii sexuali, obezitatea și diabetul de tip 2 există o legătură
- Băuturi îndulcite cu zahăr, obezitate, risc de diabet de tip 2 și de boli cardiovasculare
- Protecție potențială împotriva diabetului de tip 2 în obezitate prin expresia CD36 inferioară și îmbunătățită
- Polimorfismele genei SREBF-1 sunt asociate cu obezitatea și diabetul de tip 2 la obezii francezi și