Alessandra Gambineri
Unitatea de endocrinologie, Departamentul de Științe Medicale și Chirurgicale, Spitalul St Orsola-Malpighi, Universitatea Alma Mater din Bologna, Bologna, Italia
Carla Pelusi
Unitatea de endocrinologie, Departamentul de Științe Medicale și Chirurgicale, Spitalul St Orsola-Malpighi, Universitatea Alma Mater din Bologna, Bologna, Italia
Abstract
Un dezechilibru al hormonilor sexuali are un impact important asupra diabetului de tip 2 (T2DM), în principal prin implicarea țesutului adipos visceral. Androgenii au o interesantă asociere sex-dimorfă cu T2DM, deoarece hiperandrogenismul la femei și hipogonadismul la bărbați sunt factori de risc pentru T2DM. Astfel, tratamentele care vizează corectarea hiperandrogenismului la femei și a hipogonadismului la bărbați pot preveni dezvoltarea T2DM sau pot ajuta la tratamentul acestuia.
Rolul sexului și genului asupra dezvoltării diabetului de tip 2
Există dovezi din ce în ce mai mari că diferențele de sex și gen influențează epidemiologia, fiziopatologia, tratamentul și rezultatele multor boli, inclusiv diabetul de tip 2 (T2DM) (1). Termenul de sex este folosit pentru a indica în primul rând diferențele biologice, iar termenul de gen descrie predominant diferențele psihosociale dintre sexe. Diferențele de sex între femei și bărbați includ diferențe în hormonii sexuali și efectele acestora asupra sistemelor de organe. Diferențele de gen apar din procesele socioculturale și includ diferite forme de nutriție, stiluri de viață sau stres sau atitudini față de tratamente și prevenirea bolilor. Diferențele de gen și sex sunt la fel de importante în ceea ce privește dezvoltarea, conștientizarea, prezentarea, diagnosticul și terapia, precum și prevenirea T2DM, influențându-se reciproc, mai ales prin impactul asupra obezității. Există un acord general potrivit căruia obezitatea este factorul de risc major pentru T2DM la ambele sexe, susținută de datele privind tiparele de prevalență ale T2DM în regiuni care seamănă cu cele ale obezității (2).
Această revizuire se concentrează pe legătura dintre hormonii sexuali și T2DM prin impactul pe care un dezechilibru al hormonului sexual îl are asupra țesuturilor metabolice, în special asupra țesutului adipos. Se subliniază dimorfismul sexual al androgenilor în fiziopatologia T2DM.
Diferențele hormonilor sexuali între sexe
Faptul că ambele sexe produc aceiași hormoni steroizi într-un mod similar înseamnă că diferențele fiziologice sunt neapărat cantitative în ceea ce privește (i) cât de mult androgen se face și (ii) ce procent din acea cantitate este transformat în estrogen. Dacă ne concentrăm pe testosteron și E2, cei mai puternici doi reprezentanți ai claselor lor și principalii hormoni sintetizați în gonade, sunt evidente două diferențe dramatice. Testiculul produce aproximativ 7000 μg de testosteron pe zi și transformă un sfert de 1% în E2, în timp ce ovarul produce doar 300 μg de testosteron pe zi, dar transformă pe deplin jumătate din acesta în E2. Astfel, bărbații produc cel puțin 20 de ori mai mult testosteron decât femeile; cu toate acestea, procentul de testosteron care este transformat în E2 la o femeie este de 200 de ori mai mare decât la un bărbat. La ambele sexe testosteronul induce estrogenul sulfotransferazei (EST), care inactivează sulfatul E2 și E2 (E2-S); prin urmare, cu cât nivelurile de testosteron sunt mai ridicate, cu atât este mai mare inactivarea E2 în sulfatul E2, contribuind astfel la diferențele cantitative ale steroizilor sexuali între sexe (4).
Cu toate acestea, există și o diferență calitativă între sexe care depinde de locul de producție al E2. La femeile sănătoase în premenopauză, E2 este produsă în principal de ovare și funcționează ca un hormon circulant care acționează asupra țesuturilor țintă îndepărtate. La bărbați și femei în postmenopauză, E2 nu funcționează ca un hormon circulant; mai degrabă, este sintetizat în principal în siturile extragonadale și acționează ca un factor paracrin și intracrin (4).
O parte a diferențelor hormonilor sexuali între sexe depinde și de globulina care leagă hormonul sexual (SHBG), care reglează efectul biologic al steroizilor sexuali (5). Androgenii și estrogenii sunt transportați în sânge de către proteine, în special SHBG și albumina care reglează accesul hormonilor steroizi la celulele lor țintă. Aceste proteine au afinități diferite de ligand: albumina leagă hormonii sexuali în mod indistinct și cu o afinitate scăzută, în timp ce SHBG leagă hormonii sexuali cu o afinitate ridicată, dar afinitatea cu testosteronul este de două ori mai mare decât E2 și distinctă între sexe. În plus, la femei, cantitatea de testosteron care este legată de SHBG este semnificativ mai mare decât cea la bărbați (77 vs 53%). Prin urmare, modificările nivelului de SHBG au un efect mai mare asupra nivelului de testosteron liber (și, prin urmare, asupra expresiei sale biologice) decât asupra nivelului corespunzător de E2 liber și acest lucru este evident mai ales în nivelul de testosteron liber al femelelor față de bărbați. Astfel, transportul seric de androgeni și estrogeni contribuie la diferențele bazate pe sex, prin reglarea nivelurilor relative de hormoni liberi disponibili pentru țesuturile țintă. Principalele diferențe ale hormonilor sexuali între sexe sunt rezumate în Tabelul 1 .
tabelul 1
Principalele diferențe hormonale sexuale între sexe.
| Testosteronul | Bărbații produc de 20 de ori mai mult testosteron decât femeile pe zi | (3) |
| Estradiol (E2) | Bărbații transformă testosteronul în E2 într-un procent de 200 de ori mai mic decât o femeie E2 la bărbați este sintetizat în siturile extragonadale și funcționează ca factor paracrin și intracrin E2 la femei este sintetizat în principal în ovare și funcționează ca un hormon circulant | (3, 4) |
| Estrogen sulfotransferaza (EST) | EST este mai activ la bărbați decât la femei | (4) |
| Globulină care leagă hormonul sexual (SHBG) | Testosteronul legat de SHBG este mai mic la bărbați decât la femei (53% vs 77%) | (5) |
Asocierea sex-dimorfă dintre androgeni și diabetul de tip 2 rezultă din studii clinice
Asocierea sex-dimorfă între testosteron și T2DM, care este observată în mod constant în grupurile rasiale și etnice, este deosebit de evidentă în studiile clinice (6). Există multe studii transversale, bazate pe populație, care demonstrează că nivelurile mai scăzute de testosteron la bărbați și nivelurile mai ridicate de testosteron la femei sunt asociate cu T2DM, în timp ce nivelurile mai mici de SHBG sunt asociate cu T2DM, în special la femei (7). Unele studii prospective bazate pe populație indică astfel faptul că testosteronul endogen poate influența diferențial riscul de T2DM la bărbați și femei. Nivelurile reduse de testosteron (atât total, cât și liber) la bărbați sunt de fapt asociate cu un risc mai mare de T2DM, în timp ce nivelurile mai ridicate de testosteron (atât totală, cât și liberă), precum și nivelurile mai scăzute de SHBG la femei sunt asociate cu un risc mai mare de T2DM ( 8).
Interesant este faptul că studiile prospective efectuate pe bărbați demonstrează că relația inversă dintre testosteron și riscul de diabet depinde în principal de fenotipul obezității abdominale. De fapt, după ajustarea pentru circumferința taliei, această relație se atenuează drastic (9). La femei, riscul de T2DM crește odată cu agravarea hiperandrogenismului (10) și devine evident mai ales în tulburările hiperandrogenice, cum ar fi sindromul ovarului polichistic (SOP).
Rezultate similare, dar cu o relație inversă, au fost propuse și la bărbați. Aproximativ o treime din bărbații cu T2DM sau sindrom metabolic au prezentat niveluri subnormale de testosteron total și liber asociate în principal cu concentrații scăzute inadecvate de LH și FSH (21, 22). Această afecțiune a fost definită recent ca hipogonadism funcțional caracterizat prin niveluri hormonale compatibile cu hipogonadismul hipogonadotrop, un răspuns normal al LH și FSH la stimulul GnRH și fără axa anormală hipotalamică - hipofizară - testiculară. Deși hipogonadismul hipogonadotropic pare a fi starea dominantă asociată cu pacienții cu T2DM, în literatura de specialitate s-a raportat că un procent minim de subiecți diabetici au niveluri scăzute de testosteron cu concentrații mari de gonadotropină (21). În orice caz, indiferent de forma biochimică a hipogonadismului asociat cu T2DM la bărbați, adică hiper- sau hipogonadotrop, toți pacienții diabetici cu testosteron scăzut prezintă de obicei simptome semnificative sugestive de hipogonadism, cum ar fi fatigabilitatea și disfuncția erectilă.
Asocierea dintre nivelurile scăzute de testosteron și T2DM la bărbați a fost pe deplin stabilită și considerată bidirecțională, deși există mai multă literatură care susține influența testosteronului scăzut asupra dezvoltării T2DM. S-a estimat că testosteronul scăzut la momentul inițial dublează aproximativ șansele de a dezvolta T2DM la bărbați (23, 24). Mai mult, o meta-analiză din 2011 a 52 de studii observaționale referitoare la sindromul metabolic la factorii determinanți ai testosteronului a arătat că bărbații cu cel mai înalt terț de testosteron au avut un risc mai mic de sindrom metabolic decât bărbații cu cel mai mic terț de testosteron (estimare RR: 0,38, 95 % CI 0,28-0,50). În plus, acei bărbați cu niveluri mai ridicate de SHBG au avut un risc redus de a dezvolta sindrom metabolic (estimare RR = 0,29, 95% CI 0,21-0,41) (25). Posibilitatea ca subiecții de sex masculin cu niveluri scăzute de testosteron să fie predispuși la T2DM a fost confirmată de studii longitudinale într-o meta-analiză cu o mediană de urmărire de 10 ani (26).
Pe de altă parte, mai multe studii au arătat că durata și severitatea hiperglicemiei nu par să fie responsabile pentru nivelurile scăzute de testosteron la pacienții cu T2DM (27), ci mai degrabă sunt adipozitatea și rezistența la insulină (24, 28, 29). Acest lucru este susținut de cazurile relativ rare de hipogonadism hipogonadotrop descris la pacienții cu diabet zaharat de tip 1 (30) și, de asemenea, de relația inversă bine stabilită între nivelurile circulante totale și libere de testosteron cu IMC (24, 31). În plus, citokinele produse de țesutul adipos pot contribui direct la suprimarea axei hipotalamice hipofizare - gonadale (32, 33) și, prin urmare, la dezvoltarea hipogonadismului hipogonadotrop. În consecință, asocierea observată între testosteron sau SHBG și nivelurile de glucoză la bărbații hipogonadi cu T2DM a fost semnificativ atenuată după ajustarea pentru adipozitate (34).
Deși obezitatea joacă un rol important în reducerea nivelului de testosteron în T2DM, unii pacienți diabetici cu un IMC normal pot avea hipogonadism hipogonadotrop (31), sugerând astfel rolul cheie direct al rezistenței la insulină. Unele studii la animale și la om au dovedit asocierea inversă între testosteron și rezistența la insulină (35, 36), precum și un risc crescut de T2DM (37). Șoarecii cu o întrerupere specifică neuronului a genei receptorului de insulină (șoareci NIRKO) s-au dovedit a dezvolta rezistență la insulină periferică și o reducere a concentrațiilor de LH și testosteron. Acest lucru sugerează astfel rolul important al semnalizării receptorilor de insulină în creier pentru menținerea integrității funcționale a axei hipotalamică - hipofizară - gonadică și a eliminării energiei (38).
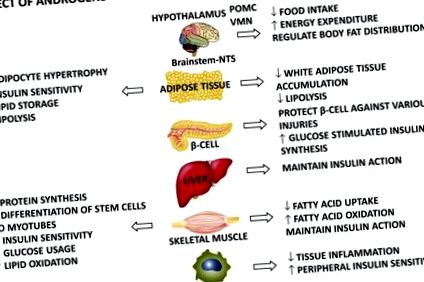
Efectele hormonilor sexuali asupra țesuturilor țintă metabolice la ambele sexe.
S-a emis ipoteza că la nivelurile de androgen fiziologic legat de sex, efectul net asupra miocitelor predomină atât la bărbați, cât și la femei, în timp ce la niveluri de androgeni patologici (hipogonadism la bărbați și hiperandrogenism la femei), efectul net asupra țesutului adipos conduce sistemul fenotip și dă naștere unor boli metabolice.
Interesant este faptul că mai multe modele de rozătoare, oi și primate au demonstrat recent că androgenii acționează direct asupra sistemului nervos central, influențând metabolismul într-o manieră dimorfă sexual, de asemenea, la niveluri fiziologice (42). Androgenii reglează direct producția sistemului nervos simpatic către țesutul adipos alb (WAT) și aportul de alimente, prin reglarea peptidei orexigenice proopiomelanocortină-POMC, sensibilitatea centrală la leptină și cheltuielile de energie într-o manieră dimorfă sexual. La femele, androgenii cresc producția simpatică la WAT, cresc aportul de alimente, produc rezistență la leptină și scad cheltuielile de energie, în timp ce au efect opus la bărbați. Acest efect dimorf sexual central al androgenilor contribuie probabil la obezitate abdominală, rezistență la insulină și T2DM în condiții hiperandrogenice și hipogonadice la femei și, respectiv, la bărbați.
Rolul estrogenilor în țesuturile țintă metabolice: un rol potențial în legarea hipogonadismului și a diabetului de tip 2 la bărbați
Luând în considerare toate aceste efecte metabolice pozitive ale estrogenilor, se poate ipoteza că starea hipoestrogenă care caracterizează hipogonadismul la bărbați poate participa la producerea și/sau agravarea T2DM prin impactul său asupra declanșării țesuturilor metabolice, în special a țesutului adipos.
Legătura dintre adipozitate, în special adipozitatea viscerală și diabetul de tip 2
Aceasta susține astfel asocierea dintre disfuncțiile steroizilor sexuali (hiperandrogenism la femei și hipogonadism la bărbați), adipozitatea viscerală și T2DM la ambele sexe.
Impactul metabolic al antiandrogenilor la femelele hiperandrogenice
În ceea ce privește femelele hiperandrogenice, în prezent există puține date care să susțină utilizarea antiandrogenilor pentru a preveni sau trata T2DM. Moghetti și colab. a demonstrat că câteva luni de tratament antiandrogen la femeile afectate de SOP au crescut semnificativ sensibilitatea la insulină evaluată de o clemă euglicemică - hiperinsulinemică (45). Grupul nostru a confirmat că 12 luni de terapie antiandrogenă la femeile PCOS supraponderale/obeze au îmbunătățit sensibilitatea la insulină și au scăzut TVA (46). De asemenea, am demonstrat că femeile SOP tratate pentru o perioadă lungă de timp cu contraceptive orale de generația a treia (OC), care pot fi considerate o terapie antiandrogenă, comparativ cu cele netratate de OC, au menținut o greutate corporală stabilă și rezistența la insulină nu se agravează, dar prin contrast toleranța la glucoză s-a îmbunătățit. Aceste rezultate sugerează că OCP în PCOS combate deteriorarea metabolică naturală a sindromului pe tot parcursul vieții (47). În general, aceste date sugerează că antiandrogenii ar putea fi utilizați pentru a preveni sau trata T2DM în PCOS; cu toate acestea, sunt necesare mai multe studii pentru a confirma aceste date.
Impactul metabolic al corecției testosteronului la bărbații hipogonadici
O nouă clasă de medicamente, modulatori selectivi ai receptorilor de estrogen, se administrează acum la pacienții cu hipogonadism funcțional, ducând la o creștere a concentrațiilor de androgeni la nivelul fiziologic, susținând astfel utilizarea lor viitoare potențială ca opțiune alternativă în acest domeniu (57). În special, citratul de clomifen care acționează ca un antagonist al estrogenului la nivelul glandei pituitare induce eliberarea de LH și FSH, care, la rândul său, conduce la producția endogenă steroidogenă la pacienții hipogonadi funcționali (58, 59). Până în prezent, doar câteva studii au evaluat efectul citratului de clomifen asupra compoziției corpului și asupra metabolismului glucozei, dar toate cu rezultate promițătoare (59, 60). Grupul nostru a constatat un efect pozitiv al citratului de clomifen în ameliorarea nivelurilor de glucoză și insulină la pacienții obezi dismetabolici cu niveluri scăzute de testosteron (59), susținând astfel utilizarea lor potențială la aceste tipuri de subiecți.
Deși constatările menționate mai sus sugerează cu tărie că creșterea nivelului de androgeni prin suplimentarea cu testosteron sau alte tratamente are un impact pozitiv împotriva T2DM la bărbații hipogonadici, sunt încă necesare studii clinice suplimentare pentru a confirma acest scenariu și pentru a determina abordările adecvate.
Concluzii
Modelul care explică contribuția diferiților factori la dezvoltarea T2DM atribuie roluri deosebit de importante obezității și grăsimii visco-abdominale, cu condiția să existe o predispoziție genetică și acest lucru este subliniat în prezența unui dezechilibru al steroizilor sexuali. Dimorfismul sexual al androgenilor în fiziopatologia T2DM sugerează că există inegalități atât în strategiile de prevenire, cât și în tratamentul dintre femei și bărbați și, de asemenea, evidențiază utilizarea potențială a unui medicament specific sexului. Sunt necesare studii suplimentare în acest domeniu interesant.
Declarație de interes
Autorii declară că nu există niciun conflict de interese care ar putea fi perceput ca prejudiciază imparțialitatea acestei revizuiri.
Finanțarea
Această lucrare nu a primit nicio subvenție specifică de la nicio agenție de finanțare din sectorul public, comercial sau non-profit.
- Obezitatea și sănătatea bucală - Există un link Un studiu observațional
- Protecție potențială împotriva diabetului de tip 2 în obezitate prin expresia CD36 inferioară și îmbunătățită
- Băuturi îndulcite cu zahăr, obezitate, risc de diabet de tip 2 și de boli cardiovasculare
- Noi opțiuni pentru tratamentul obezității și a diabetului zaharat de tip 2 (recenzie narativă),
- Polimorfismele genei SREBF-1 sunt asociate cu obezitatea și diabetul de tip 2 la obezii francezi și