Abstract
În bolile renale cronice (CKD), acumularea de toxine uremice este asociată cu un risc crescut de deces. Unele toxine uremice sunt ingerate împreună cu dieta, cum ar fi fosfatul și caramboxina derivată din fructe stelate. Altele rezultă din procesarea nutrienților prin microbiota intestinală, producând precursori ai toxinelor uremice sau toxinelor uremice. Acești nutrienți includ l-carnitină, colină/fosfatidilcolină, triptofan și tirozină, care sunt vândute și fără prescripție medicală ca suplimente nutritive. Medicii și pacienții trebuie să fie conștienți de faptul că, la pacienții cu BCR, utilizarea acestor suplimente poate duce la efecte potențial toxice. Din păcate, majoritatea pacienților cu BCR nu sunt conștienți de starea lor. Unele dintre componentele dietetice pot modifica microbiota intestinală, crescând numărul de bacterii care le procesează pentru a produce toxine uremice, cum ar fi trimetilamina N-oxid (TMAO), p-crezil sulfat, indoxil sulfat și indol-3 acid acetic. Nivelurile circulante de toxine uremice derivate din nutrienți sunt asociate cu un risc crescut de deces și boli cardiovasculare și există dovezi că această asociere poate fi cauzală. Dezvoltările viitoare pot include manevre pentru a modifica prelucrarea intestinului sau absorbția acestor nutrienți sau derivați pentru a îmbunătăți rezultatele pacienților cu CKD.
1. CKD și toxine uremice
2. Microbiota
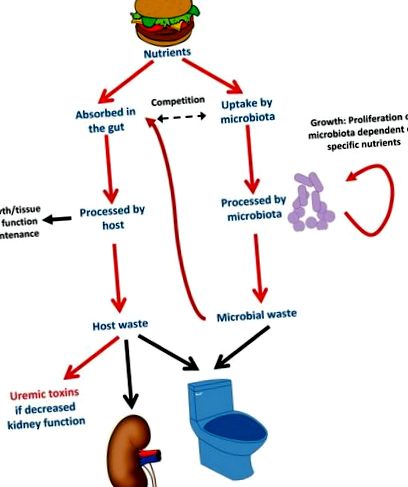
Microbiota - interacțiunea gazdă și modularea de către nutrienții din dietă. Când oamenii se hrănesc singuri, își hrănesc și microbiota. Elementele nutritive precise ingerate vor favoriza creșterea bacteriilor care se hrănesc cu substanțe nutritive ingerate, în detrimentul bacteriilor care se hrănesc cu substanțe nutritive pe care o persoană nu le ingerează. Microbiota concurează cu gazda pentru anumiți nutrienți, cum ar fi l-carnitina. Astfel, suplimentarea orală cu l-carnitină promovează creșterea bacteriilor care metabolizează l-carnitină și poate duce la scăderea absorbției l-carnitinei. Unele molecule reziduale din hrănirea bacteriană vor fi absorbite sistemic și metabolizate în toxine uremice care se acumulează dacă nu sunt excretate în urină.
Microbiota poate fi modificată de mulți factori și, prin urmare, poate contribui mai mult sau mai puțin la acumularea de toxine uremice. Acești factori includ fondul genetic al gazdei; cantitatea de fibre dietetice, proteine și precursori ai toxinei; afecțiuni medicale, inclusiv CKD și anumite terapii, în special antibiotice [21]. În acest sens, la pacienții cu CKD, Brachybacterium, Catenibacterium, Enterobacteriaceae, Halomonadaceae, Moraxellaceae, Nesterenkonia, Polyangiaceae, Pseudomonadaceae și Thiothrix au fost semnificativ crescute, în timp ce la șobolanii CKD, Lactobacillaceae și Prevotelli au fost. Din punct de vedere enzimatic, pacienții cu ESRD au prezentat o expansiune semnificativă a familiilor bacteriene care posedă enzime care formează urează, uricază și indol și p-crezol și contracție a familiilor care posedă enzime care convertesc fibra dietetică în acizi grași cu lanț scurt, cum ar fi butiratul [23].
3. Toxine uremice derivate din alimente
Moleculele găsite în alimente pot fi direct toxice. Unii nutrienți, cum ar fi fosfatul sau oxalatul, pot deveni toxici atunci când sunt acumulați în CKD. Pentru alte componente alimentare, cum ar fi caramboxina, nu se cunoaște niciun beneficiu nutrițional.
3.1. Fosfat
Aproximativ 1200 mg de fosfat sunt ingerate zilnic cu alimente, dintre care aproximativ 900 mg sunt absorbite și trebuie excretate în urină [24]. Rinichii ajustează nivelul fosfatului seric și previn acumularea fosfatului. În CKD, fosfatul se acumulează și fosfatul seric crește odată cu scăderea GFR. Fosfatul a fost considerat o toxină uremică asociată cu un risc cardiovascular ridicat la persoanele cu funcție renală normală și la pacienții cu BCR [24]. Fosfatul seric în intervalul normal ridicat (interval normal 2,5-4,5 mg/dl) este asociat cu un risc mai mare de boli cardiovasculare și mortalitate [25,26,27,28,29], precum și cu o progresie mai rapidă a BCR [30 ]. În studiile observaționale, utilizarea lianților fosfatici a fost asociată cu o mortalitate mai scăzută la pacienții cu hemodializă [31].
Conținutul de fosfat alimentar folosit pentru a fi strâns legat de conținutul de proteine și fosfatul asociat proteinelor animale este mai bine absorbit decât fosfatul din surse vegetale. Cu toate acestea, în societățile occidentale, fosfatul anorganic din sodă și aditivii alimentari reprezintă o sursă bogată de fosfat foarte ușor absorbit, nu întotdeauna asociat conținutului de proteine și nu întotdeauna bine etichetat în informațiile nutriționale ale alimentelor procesate.
Asocierea dintre creșterea fosfatului seric sau supraîncărcarea fosfatului și riscul cardiovascular ar putea rezulta din promovarea directă a leziunilor cardiovasculare, inclusiv calcificarea vasculară [32,33] sau din mecanismele de adaptare la fosfatul în exces. Un bilanț pozitiv al fosfatului activează hormonul paratiroidian al fosfatoninelor (PTH) și factorul de creștere a fibroblastelor-23 (FGF-23) care promovează fosfaturia [34]. FGF-23 are nevoie de un cofactor, α-Klotho, pentru a activa receptorul FGFR1 [35]. În CKD, inflamația renală reglează în jos Klotho, rezultând rezistență la FGF-23 și necesitatea sau chiar niveluri mai ridicate de FGF-23 [36,37]. Lipsa FGF-23 funcțional sau Klotho este asociată cu îmbătrânirea prematură, ateroscleroza și calcificarea vasculară, care este prevenită de o dietă cu fosfat scăzut [38]. În plus, FGF-23 reglează în jos sinteza calcitriolului prin inhibarea 1α-hidroxilazei tubulare proximale [39] și creșterea activității 24-OH-hidroxilazei care degradează calcitriolul. Excesul de FGF-23 și PTH circulant sau nivelurile reduse de calcitriol pot, de asemenea, să promoveze direct leziunile cardiovasculare și să interfereze cu apărarea antibacteriană [40,41,42,43,44].
3.2. Caramboxină
Carambola (fruct de stea) și caramboxina. Pacienții cu CKD ar trebui să fie instruiți să recunoască și să evite carambola din cauza riscurilor pe care le implică.
3.3. Oxalat
Oxalatul plasmatic este crescut la pacienții cu BCR și terapia de substituție renală nu este eficientă pentru reducerea permanentă a nivelurilor de oxalat [56]. Pe măsură ce funcția renală scade, colonul capătă, de asemenea, importanță în homeostazia și eliminarea oxalatului. Secreția colonică de oxalat poate fi crescută prin medicamente care cresc expresia AMPc și prin probiotice (de exemplu, Oxalobacter formigenes) [57]. Excesul de oxalat se poate depune și poate deveni el însuși nefrotoxic [58]. Într-adevăr, după cum sa menționat mai sus, se crede că oxalatul este componenta nefrotoxică din carambolă.
4. Nutrienți ca precursori ai toxinelor uremice prin intermediul microbiotei
Unele substanțe nutritive din alimente sunt procesate de microbiota intestinală pentru a genera toxine uremice sau precursori care sunt metabolizați în toxine din organism. N-oxidul de trimetilamină (TMAO), p-crezil-sulfatul (pCS), indoxil-sulfatul (IS) și acidul indol-3 acetic (IAA) sunt toxine uremice cheie provenite din nutrienții din dietă (Figura 3 și Figura 4).
De la nutrienți la toxine:(A) Căi metabolice pentru generarea toxinei uremice TMAO din l-carnitină și colină din dietă; (B) căi metabolice pentru generarea de toxine uremice p-crezil-sulfat și p-crezil-glucuronid din tirozină dietetică; și (C) căi metabolice pentru generarea de toxine uremice indoxil sulfat și indol-3-aldehidă din triptofan dietetic. Toxinele uremice astfel generate sunt excretate de rinichi la subiecții sănătoși, dar se acumulează ca toxine uremice la persoanele cu BCR.
Mecanisme de toxicitate pentru toxinele uremice derivate din nutrienți. Mecanismele moleculare ale toxicității uremice ale toxinei încep să fie elucidate. Cifra reprezintă câteva căi cheie descrise recent, prin care acestea pot contribui la cele două consecințe cheie ale ERC: progresia ERC și îmbătrânirea cardiovasculară accelerată.
4.1. Colina și l-carnitina sunt metabolizate la TMAO
Colina este disponibilă ca supliment alimentar sub formă de clorură de colină sau bitartrat de colină și ca lecitină, care conține de obicei aproximativ 25% fosfatidilcolină sau 3-4% colină în greutate. Suplimentele de colină sunt comercializate pentru sănătatea ficatului, memoria și performanța fizică îmbunătățită. În acest sens, suplimentarea cu colină a fost luată în considerare pentru o varietate de condiții, inclusiv exerciții fizice, sarcină și boala Alzheimer [64,65]. Concentrațiile plasmatice ale colinei sunt reduse cu aproximativ 40% în timpul alergării maratonului [66]. Cu toate acestea, prevenirea scăderii colinei plasmatice prin suplimentarea pe termen scurt a lecitinei înainte de un maraton nu a reușit să îmbunătățească performanța [67]. Mai mult, o analiză sistematică recentă a concluzionat că dovezile care confirmă efectele sugerate ale colinei asupra sănătății în diferite etape ale vieții sunt rare [68]. Dozele farmacologice de clorură de colină (10 g/zi) au fost asociate cu greață, diaree și o scădere mică a tensiunii arteriale la pacienții studiați în anii 70 [69].
Carnitina este un nutrient esențial numai la sugari, potrivit Comitetului pentru Alimentație și Nutriție al Institutului de Medicină. Suplimentele de l-carnitină sunt indicate pentru tratarea deficitului sistemic primar de carnitină, o boală ultrarară care rezultă din defecte genetice ale membranei plasmatice cu afinitate ridicată carnitină-purtătoare care duce la irosirea carnitinei renale [77]. Cu toate acestea, sportivii pot lua suplimente de l-carnitină pentru a spori performanța și aceste suplimente sunt comercializate online pentru a „arde grăsimile”.
TMAO este un oxid de amină din fructele de mare dietetice. Cu toate acestea, TMAO este generat în principal din colină dietetică și d, l-carnitină. Colina și d, l-Carnitina sunt metabolizate de microbiota intestinală în trimetilamină (TMA) [87], care este absorbită și oxidată de flavina monooxigenază-3 hepatică (FMO) la TMAO, care este în cele din urmă excretată, în principal în urină, dar și în transpirație și aer expirat (Figura 3 A) [88,89,90]. Deficiențele genetice în FMO previn conversia TMA maladoros în TMAO inodor, rezultând trimetilaminurie sau „sindromul mirosului de pește” [91]. Concentrațiile plasmatice de TMA, dimetilamină (DMA) și TMAO sunt crescute în uremie [92,93], din cauza scăderii RFG cu sau fără tulburări ale microbiotei intestinale [22]. Creșterea nivelului TMAO urinar la pacienții cu BCR poate reprezenta sinteza locală a TMAO renală sau excreția renală a TMAO circulant [94], în timp ce hemodializa elimină eficient TMAO din plasmă [92].
4.2. Triptofanul este metabolizat în sulfat de indoxil (IS) și acid acetic indol-3 (IAA)
Triptofan (Trp, W) este un aminoacid esențial la om, ceea ce înseamnă că nu poate fi sintetizat și trebuie obținut din dietă. FAO a estimat necesarul zilnic în 3,5 mg/kg/zi la adulți [115]. Este abundent în albuș de ou (1,4 g/100 g de alimente), produse concentrate din soia și cianobacterii spirulina (Arthrospira platensis) (0,93 g/100 g), lapte și brânză (0,5 g/100 g) și carne (0,4 g/100 g). Triptofanul este un precursor al niacinei și melatoninei, participând astfel la reglarea tulburărilor de somn. În plus, este metabolizat în 5-hidroxitriptofan care ulterior este transformat în neurotransmițător serotonină, un regulator al depresiei. Bacteriile intestinale care exprimă triptofanaza metabolizează triptofanul în indol și derivați.
Rinichii elimină derivați de triptofan și metabolizează triptofanul prin calea kinureninei. Niveluri mai ridicate de triptofan la pacienții cu ESRD sunt asociate cu colesterol total mai scăzut și tensiune arterială sistolică [116]. La pacienții cu hemodializă, catabolitii triptofanului căii kinureninei sunt crescute probabil datorită unei activități sporite a enzimei de degradare a triptofanului indoleamină 2,3-dioxigenază (IDO) inductibilă de stimuli proinflamatori [117,118]. Boala Parkinson, boala neuronilor motori și scleroza multiplă au fost asociate cu calea kinureninei [119].
Triptofanul este vândut fără prescripție medicală ca supliment alimentar pentru utilizare ca antidepresiv, anxiolitic și ajutător la somn. S-a sugerat că consumul de triptofan poate îmbunătăți depresia, starea de spirit și tulburările de anxietate prin creșterea serotoninei în creier. Cu toate acestea, această utilizare a triptofanului nu este susținută de dovezi științifice [120].
O varietate de toxine uremice rezultă din metabolismul triptofanului, incluzând toxine urolice indolice (IS, IAA și indoxil-β-d-glucuronidă) și toxine din calea kinureninei (kinurenina, acidul cinurenic, acidul antranilic, 3-hidroxikinurenina, 3-hidroxiantranilica acid și chinolinic) [121]. Aceștia sunt liganzi ai factorului de transcripție al receptorului hidrocarbonat arii (AhR), cunoscut și sub numele de receptor dioxin. Activarea AhR este cunoscută pentru a media cardiotoxicitatea, inflamația vasculară și un fenotip procoagulant și prooxidant al celulelor vasculare [121].
Sulfat de indoxil (ESTE) este un derivat de indol care se acumulează în uremie [122.123]. Triptofanaza bacteriană (TnaA) de la Citrobacter, Escherichia și Proteus, printre altele, procesează triptofanul în indol [124]. Indolul este absorbit și este oxidat în ficat la indoxil de citocromul p450-2E1 și apoi sulfatat de sulfotransferaza 1A1 pentru a forma IS [123] (Figura 3 C). Speciile Lactobacillus metabolizează triptofanul în indol-3-aldehidă care poate fi metabolizat și de ficat în IS [125,126].
Indol-3 acid acetic (IAA) a prezis mortalitatea și evenimentele cardiovasculare la pacienții cu BCR. În celulele endoteliale umane cultivate, IAA a activat o cale inflamatorie AhR/p38MAPK/NF-κB care a indus enzima proinflamatorie ciclooxigenază-2 și a crescut producția de ROS și expresia factorului tisular [135, 143].
4.3. Tirozina este metabolizată în sulfat de p-Cresil (pCS)
l-tirozină (para-tirozină, Tyr, Y) sau 4-hidroxifenilalanina este considerat un aminoacid condiționat indispensabil, care poate fi sintetizat din aminoacidul esențial l-fenilalanină din ficat. L-tirozina este un precursor al mai multor molecule active biologic, inclusiv neurotransmițători de catecolamină, hormoni și melanină [144, 145]. Cantități mari de tirozină se găsesc în albușul de ou și în produsele din soia uscate (3 g/100 g), spirulina (2,6 g/100 g), lapte și brânză (1,5-2,5 g/100 g) și carne (1,3 g/100 g )) [62]. FAO a estimat necesarul zilnic de tirozină și fenilalanină la 14 mg/kg/zi la adulți, aproximativ 1 g/zi [115]. Cu toate acestea, în NHANES III din 1988-1994, aportul mediu zilnic de tirozină a fost de 2,8 g/zi. Bărbații tineri au avut cel mai mare aport la 6,4 g/zi. Acest lucru sugerează că suplimentarea cu tirozină este de obicei inutilă. Într-adevăr, deficitul de tirozină este rar. La pacienții cu hemodializă, nivelurile de tirozină au fost mai mici decât la martorii sănătoși și au scăzut cu scăderea GFR [146,147].
5. Implicații terapeutice potențiale
Principalul mesaj din această revizuire este că medicii care iau în calcul suplimentarea pacienților cu substanțe nutritive care pot produce toxine uremice ar trebui să evalueze mai întâi funcția renală a pacienților lor. În plus, medicii ar trebui să exploreze, de asemenea, obiceiurile alimentare ale pacienților lor cu CKD, întrebând în mod specific despre aportul de suplimente nutritive. În plus, există cercetări foarte active asupra manevrelor de modificare a procesării intestinului sau a absorbției acestor substanțe nutritive sau derivați pentru a îmbunătăți rezultatul pacientului cu CKD. AST-120 a fost aprobat pentru utilizare clinică la pacienții japonezi cu CKD în 1991 pentru a întârzia progresia CKD. Se adsorbe indol în intestin și scade nivelul IS. Cu toate acestea, nu a reușit să prevină progresia CKD într-un mare proces multinațional [158,159]. În plus față de scăderea toxinelor uremice discutate mai sus, epuizarea microbiotei cu antibiotice cu spectru larg a scăzut inflamația și leziunile renale atenuate cauzate de ischemie-reperfuzie renală la șoareci, în timp ce transplanturile fecale la șoareci tratați cu antibiotice au abolit efectul protector al antibioticelor [160]. ]. Cu toate acestea, antibioticele nu pot fi promovate la niveluri mai scăzute de toxină uremică, deoarece riscurile așteptate depășesc cu mult beneficiile previzibile.
Mulțumiri
Fonduri de la FIS ISCIII FEDER (PI15/00298, PI16/02057, PI16/01900, ISCIII-RETIC REDinREN RD12/0021 RD16/0009), Fonduri de la EUTOX, Fonduri de la CYTED IBERERC. Programul de intensificare a activității investigatoare (ISCIII) către AO. Miguel Servet CP14/00133 către MDSN.
Contribuțiile autorului
Raul Fernandez-Prado, Raquel Esteras, Maria Vanessa Perez-Gomez, Carolina Gracia-Iguacel, Emilio Gonzalez-Parra, Alberto Ortiz și Maria Dolores Sanchez-Niño au scris proiectul. Maria Dolores Sanchez-Niño a proiectat structura și a integrat diferitele părți. RFP a făcut Figura 3 și Figura 4. Alberto Ortiz a realizat Figura 1 și Figura 2. Toți autorii au citit și au aprobat versiunea finală.
Conflicte de interes
Autorii nu declară niciun conflict de interese.
- Pacienții cu gută prezintă un risc cu 30% mai mare de boli renale cronice
- Rolul monitorizării ambulatorii a tensiunii arteriale 24 de ore la copiii cu afecțiuni renale cronice Gupta D.,
- Activitate fizica; Nutriție; Prevenirea bolilor cronice; Divizia de Promovare a Sănătății; Munca de politici
- Obezitatea este cel mai frecvent factor de risc pentru bolile hepatice cronice - Consilier în gastroenterologie
- Grăsimi vegetale, modele dietetice bogate în grăsimi vegetale și modulație microbiotică intestinală