Departamentul de Științe Alimentare și Nutriție, Universitatea Hallym, Chuncheon, Coreea.
Institutul coreean de nutriție, Universitatea Hallym, Chuncheon, Coreea.
Departamentul de Științe Alimentare și Nutriție, Universitatea Hallym, Chuncheon, Coreea.
Institutul coreean de nutriție, Universitatea Hallym, Chuncheon, Coreea.
Departamentul de Științe Alimentare și Nutriție, Universitatea Hallym, Chuncheon, Coreea.
Institutul coreean de nutriție, Universitatea Hallym, Chuncheon, Coreea.
Coreea Ginseng Corporation Institutul de Cercetare, Coreea Ginseng Corporation, Daejeon, Coreea.
Coreea Ginseng Corporation Institutul de Cercetare, Coreea Ginseng Corporation, Daejeon, Coreea.
Coreea Ginseng Corporation Institutul de Cercetare, Coreea Ginseng Corporation, Daejeon, Coreea.
Departamentul de Științe Alimentare și Biotehnologie, Universitatea Națională Kangwon, Chuncheon, Coreea.
Adresă corespondență către: Il-Jun Kang, dr., Departamentul de Știința Alimentelor și Nutriție, Universitatea Hallym, Chuncheon 24252, Coreea,
Departamentul de Științe Alimentare și Nutriție, Universitatea Hallym, Chuncheon, Coreea.
Institutul coreean de nutriție, Universitatea Hallym, Chuncheon, Coreea.
Abstract
Introducere
Obezitatea este o boală inflamatorie cronică modernă. 1 Obezitatea nu numai că afectează aspectul, ci provoacă și sindroame metabolice multiple, inclusiv hiperlipidemie, boli cardiovasculare, diabet de tip 2 și ficat gras nealcoolic. 2 Conceptul actual curent pentru tratarea obezității este gestionarea echilibrului metabolic între aportul și consumul de energie. 3
În tratamentul obezității, eficacitatea și siguranța produselor naturale sunt mai liniștitoare datorită efectelor secundare mai puține, comparativ cu medicamentele sintetice chimice tradiționale cunoscute ca cauzând diaree și vărsături. 4-6 În ultimii ani, multe studii au raportat că două sau mai multe produse naturale amestecate la rapoarte diferite au funcții mai pronunțate decât un singur produs natural. 7-10 Acest lucru s-ar putea datora efectelor sinergice ale compușilor activi prezenți în diverse produse naturale. 11
Ginsengul roșu este un soi de ginseng fermentat preparat prin uscare cu abur. 12 Poate reduce tensiunea arterială și poate preveni oxidarea. În plus, are efecte anticancerigene, anti-obezitate, hipolipidemice și hipoglicemiante. 13-16 Ginseng roșu fermentat își poate crește conținutul de ginsenozide totale, își poate îmbunătăți biodisponibilitatea și își poate îmbunătăți activitatea farmacologică. 17 Saponinele se numără printre principalii compuși activi ai ginsengului roșu. S-a raportat pe scară largă că saponinele pot inhiba activitatea lipazei, 18 pot reduce trigliceridele plasmatice (TG) și pot atenua adipogeneza. 19 Glycyrrhiza glabra L. este cultivat în multe țări20 și este bine cunoscut în medicina tradițională pentru tratarea afecțiunilor hepatice, durerilor de gât, astmului bronșic și a febrei. 21 În plus, s-a indicat că Glycyrrhiza glabra Extractul de L. (GG) poate reduce TG plasmatic la modelele de șobolani obezi. 22
În acest studiu, am amestecat fără precedent fracțiunea de saponină de ginseng roșu coreeană (RGS) și extractul de GG și am explorat dacă amestecul în proporții diferite ar putea spori efectul lor anti-obezitate.
Materiale și metode
pregătirea unei mostre
RGS și GG standardizate au fost achiziționate de la Korean Ginseng Corporation (Daejeon, Coreea). Extractele standardizate de ginseng roșu au fost fracționate cu cromatografie pe coloană Diaion HP20 folosind H2O, 30% etanol (EtOH) și 95% EtOH ca eluant într-un proces de eluție secvențială. Apoi fracția de EtOH 95% a fost concentrată în vid și uscată prin pulverizare pentru a obține fracția de saponină. GG uscat a fost extras de două ori cu 30% EtOH la 80 ° C, filtrat cu 1 μm dimensiunea porilor, concentrat sub presiune redusă și uscat prin pulverizare. Apoi, pulberile uscate de extract RGS și GG au fost amestecate la un raport de masă de 3: 1 (SG31), 1: 1 (SG11) sau 1: 3 (SG13).
Cultura și diferențierea celulară
Preadipocitele 3T3-L1 au fost achiziționate din colecția American Type Culture Collection (CL-173, Manassas, VA, SUA) și cultivate în mediul Eagle modificat de Dulbecco (Biowest, Riverside, MO, SUA) conținând 1% penicilină/streptomicină (P/S; Gibco, Grand Island, NY, SUA) și 10% ser de vițel bovin (Gibco) la 37 ° C cu 5% CO2. După 2 zile, celulele au atins confluența. Apoi celulele au fost induse prin mediu de diferențiere MDI care conținea 10% ser fetal bovin (FBS; Gibco), 1% P/S, 0,5 mM 3-izobutil-1-metilxantină (IBMX; Sigma-Aldrich, St. Louis, MO, SUA), 1 μM dexametazonă (Dex; Sigma-Aldrich) și 10 μg/ml insulină (Gibco) timp de 2 zile. Două zile mai târziu, celulele au fost induse în continuare cu mediu de diferențiere MDI timp de 2 zile (eliminat IBMX și Dex). După aceea, mediul obișnuit (10% FBS și 1% P/S) a fost reîmprospătat la fiecare 2 zile până în a 8-a zi. 23
Analiza viabilității celulare
Celulele au fost însămânțate la o densitate de 5 × 104 celule/godeu împreună cu extracte (0-300 μg/ml) timp de 24 de ore. Reactivul MTT a fost adăugat la mediu și incubat timp de 2 ore. Mediul a fost golit, iar sarea de formazan a fost redizolvată în dimetil sulfoxid (DMSO; Sigma-Aldrich), măsurată utilizând un spectrometru vizibil ultraviolet (UV) (Multiskan FC; Thermo Fisher Scientific, Inc., Waltham, MA, SUA) la 570 nm. 23
Test de colorare cu ulei roșu O
Celulele au fost însămânțate la o densitate de 5 × 104 celule/godeu și induse să se diferențieze împreună cu extracte (100 μg/ml). Aceste adipocite mature au fost spălate cu soluție salină tamponată cu fosfat (Lonza, Walkersville, MD, SUA) și asigurate în paraformaldehidă 4% la temperatura camerei timp de 1 oră. După clătirea celulelor securizate cu izopropanol 60%, acestea au fost colorate cu soluție roșu ulei O (Sigma-Aldrich) (0,35% vopsea roșie ulei O în izopropanol 60%) timp de 20 min și apoi spălate cu apă distilată. Celulele colorate au fost uscate în mod natural și apoi dizolvate în izopropanol 100%. Absorbanța a fost măsurată la 520 nm folosind un spectrometru vizibil la UV. 24
Proiectarea experimentelor pe animale
Șoarecii C57BL/6J de sex masculin de 5 săptămâni au fost obținuți de la Central Laboratory Animal Incorporated (Seoul, Coreea) și s-au acomodat la mediul de laborator (temperatura de 24 ° C ± 2 ° C, umiditatea relativă de 55% ± 5% și alternativă 12-h lumină/12-h ciclu întunecat) timp de 1 săptămână. Acești șoareci au fost apoi împărțiți în mod aleatoriu în două grupuri: (1) grup de controln = 8), șoarecii au fost hrăniți cu dietă cu grăsimi normale (NFD; 10% kcal grăsime, dieta ajustată cu calorii, nr. TD.06416; Envigo, Madison, WI, SUA) și (2) grup experimentaln = 64), șoarecii au fost hrăniți cu o dietă bogată în grăsimi (HFD; 60% kcal grăsime, dieta ajustată cu calorii, nr. TD.06414; Envigo). După inducerea obezității prin HFD timp de 2 săptămâni, șoarecii experimentali din grup au fost din nou împărțiți aleatoriu în șapte grupuri (n = 8 pentru fiecare grup): (1) grup HFD, (2) grup GC, un grup de control pozitiv cu efect de pierdere în greutate de Garcinia Cambogia extract de apă (GC, 100 mg/kg/zi), 25 (3) grup RGS, (4) grup GG, (5) grup SG31, (6) grup SG11 și (7) grup SG13). Toate extractele (cu excepția GC) au fost administrate oral șoarecilor timp de 10 săptămâni (200 mg/kg/zi), iar șoarecilor li s-a permis accesul gratuit la dietă și apă. Greutatea corporală, aportul de alimente și aportul de apă au fost înregistrate în fiecare săptămână. Comitetul instituțional de îngrijire și utilizare a animalelor (IACUC) al Universității Hallym a aprobat toate planurile și programele experimentale (numărul de aprobare: Hallym 2018-61).
Colectarea probelor de sânge și organe
După procesul de administrare orală, șoarecii au fost posti timp de 12 ore și anesteziați cu 2,2,2-tribromoetanol și 2-metil-2-butanol (Sigma-Aldrich), iar sângele a fost colectat din venele orbitale. 26 Serul a fost obținut prin centrifugare (3000 g timp de 15 minute la 4 ° C; centrifugă 5424R; Eppendorf, Hamburg, Germania) a probei de sânge și depozitat la -70 ° C. După colectarea probelor de sânge, țesuturile organelor au fost îndepărtate și clătite cu ser fiziologic. Umezeala a fost apoi îndepărtată și țesuturile organelor uscate au fost cântărite.
Analiza indicatorilor biochimici serici
Analiza serică a fost efectuată așa cum s-a descris anterior. 26 Alanina și aspartatul aminotransferazele (ALT și AST) din ser au fost testate pentru a determina dacă extractul a provocat toxicitate hepatică. TG, colesterolul total (TC), colesterolul cu lipoproteine cu densitate ridicată (HDL-C) și colesterolul cu lipoproteine cu densitate mică (LDL-C) au fost măsurate în ser ca componente lipidice. În plus, nivelurile de glucoză serică (GLU) au fost măsurate suplimentar. Toți indicatorii au fost testați cu ajutorul analizorului automat de chimie clinică (FUJI DRI-CHEM NX500i, Tokyo, Japonia).
Test imunoblot
Proteinele au fost extrase din adipocite 3T3-L1 și țesuturi adipose epididimale după omogenizare prin tampon RIPA (Thermo Fisher Scientific, Inc.). Concentrația totală de proteine a fost testată prin procesul cantitativ BCA (Thermo Fisher Scientific, Inc.). Apoi 10 μg de proteine au fost separate cu electrodoreză cu gel de poliacrilamidă 10-12% sulfat de dodecil (SDS-PAGE), iar proteina izolată a fost transmisă membranelor PVDF aplicând o celulă de transfer semisecă (Trans-Blot SD Cell; Bio-Rad, Hercules, CA, SUA) la 15 V timp de 60 min. Au fost utilizați următorii anticorpi: anti-iepure β-actină, receptor-gamma activat cu proliferatorul peroxizomului (PPARγ), C/EBPα, Adiponectină, proteină kinază activată cu AMP (AMPK), p-AMPK, acetil-CoA carboxilază (ACC), p-ACC (Cell Signaling Technology, Danvers, MA, SUA), SREBP-1c (proteină de legare a elementelor de reglare a sterolului 1c) și carnitina palmitoiltransferază I (CPT-1; Santa Cruz Biotechnology, Dallas, TX, SUA).
analize statistice
Datele au fost exprimate ca medii ± abateri standard și analizate printr-o analiză unidirecțională a varianței utilizând SPSS 25 (Statistical Package for Social Science, Inc.). Distincțiile între medii au fost considerate semnificative statistic la P 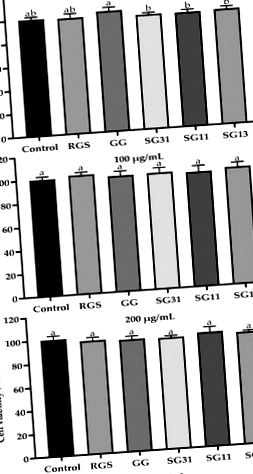
FIG. 1. Efectele RGS, GG și amestecul acestora asupra viabilității celulare a preadipocitelor 3T3-L1. Valorile sunt prezentate ca medie ± SD a experimentelor (n = 3). Diferite litere indicați diferențe semnificative între mijloace la P
Efecte inhibitorii ale RGS și/sau GG asupra acumulării de lipide
Inhibarea RGS și/sau GG asupra acumulării de lipide în celulele 3T3-L1 este prezentată în Figura 2. Nu a existat nicio diferență statistică între SG31, RGS și SG11. Cu toate acestea, în GG, RGS și în cele trei rapoarte diferite de amestecare ale acestora, SG31 a inhibat cel mai eficient acumularea de lipide. Ar putea exista un efect aditiv între RGS și GG atunci când raportul RGS din amestec a fost mai mare comparativ cu GG.
FIG. 2. Efectele inhibitorii ale RGS, GG și amestecului acestora asupra acumulării de lipide în adipocitele 3T3-L1. Valorile sunt prezentate ca medie ± SD a experimentelor (n = 3). (A) Preadipocitele 3T3-L1 postconfluente au fost tratate cu fiecare extract pentru a acumula trigliceride după 8 zile de diferențiere. (B) Roșu de ulei O colorare în ziua 8. Diferite litere indicați diferențe semnificative între mijloace la P
Efectele RGS și/sau GG asupra expresiei genelor adipogene și lipogenice în adipocitele 3T3-L1
Așa cum se arată în Figura 3, tratamentul cu RGS sau GG a redus ușor nivelurile de expresie ale PPARγ comparativ cu MDI (mediu de diferențiere conținând 10% FBS, 1% P/S, 0,5 mM IBMX, 1 μM Dex și 10 μg/mL insulină). SG31 a îmbunătățit întinderea PPARγ reducere, deși diferența în PPARγ reducerea dintre SG31 și RGS sau GG nu a fost semnificativă statistic. În mod similar, tratamentul cu GG a reglementat în continuare nivelul de expresie al C/EBPα comparativ cu tratamentul cu RGS, deși nu a existat nicio distincție statistică între cele două grupuri. Cu toate acestea, combinația RGS și GG la diferite proporții a redus semnificativ nivelul de expresie al C/EBPα comparativ cu MDI. În schimb, GG nu a afectat semnificativ nivelul de expresie al SREBP-1c în comparație cu MDI, în timp ce RGS a redus semnificativ nivelul de expresie al SREBP-1c și SG31 a redus în continuare expresia SREBP-1c.
FIG. 3. Efectele RGS, GG și amestecul lor asupra nivelurilor de expresie ale factorului de transcripție adipocitară 3T3-L1. Analiza Western blot a PPARγ, C/EBPα, și SREBP-1c a fost efectuat în ziua 8 de diferențiere celulară. Valorile sunt prezentate ca medie ± SD a experimentelor (n = 3). Diferite litere indicați diferențe semnificative între mijloace la P
Efectele RGS și/sau GG asupra modificărilor greutății corpului, organelor și aportului alimentar la șoarecii obezi C57BL/6J
Schimbările de greutate corporală ale șoarecilor sunt prezentate în Figura 4 și Tabelul 1. Nu a existat nicio distincție în greutatea corporală între fiecare grup înainte de începerea experimentării. După 10 săptămâni de administrare orală, greutatea grupului HFD a fost de 1,49 ori mai mare comparativ cu grupul NFD. Cu toate acestea, greutatea corporală a grupurilor RGS, SG31 și SG11 a fost semnificativ mai ușoară decât cele din grupul HFD. Grupul SG31 a câștigat cea mai mică greutate, similar cu grupul de control pozitiv.
FIG. 4. Efectele RGS, GG și ale amestecului lor asupra modificării greutății corporale la șoarecii obezi indusa de HFD C57BL/6J. Valorile sunt prezentate ca medie ± SD a experimentelor (n = 8). EtOH, etanol; GC, Garcinia Cambogia extract de apă; GG, Glycyrrhiza glabra L. extract; HFD, dietă bogată în grăsimi; NFD, dietă normală cu grăsimi; RGS, fracțiune saponină de ginseng roșu coreean; SG11, amestecul de RGS și GG cu un raport de masă de 1: 1; SG13, amestecul de RGS și GG cu un raport de masă de 1: 3; SG31, amestecul de RGS și GG cu un raport de masă de 3: 1.
Tabelul 1. Efectele fracțiunii de saponină de ginseng roșu coreean și/sau Glycyrrhiza glabra L. asupra modificărilor în greutatea corporală a șoarecilor obezi C57BL/6J induse de dietă bogată în grăsimi
Valorile sunt prezentate ca medie ± SD a experimentelor (n = 8). Diferite litere indică diferențe semnificative între mijloace la P
Tabelul 2. Efectele fracției de saponină roșie de ginseng și/sau Glycyrrhiza glabra L. privind consumul de alimente, consumul de apă și consumul de energie la șoarecii C57BL/6J induși cu diete bogate în grăsimi
Valorile sunt prezentate ca medie ± SD a experimentelor (n = 8). Diferite litere indică diferențe semnificative între mijloace la P
Tabelul 3. Efectele fracției de saponină de ginseng roșu și/sau Glycyrrhiza glabra L. pe greutatea viscerelor și a țesutului adipos la șoarecii obezi C57BL/6J induse de dietă bogată în grăsimi
Valorile sunt prezentate ca medie ± SD a experimentelor (n = 8). Diferite litere indică diferențe semnificative între mijloace la P
Tabelul 4. Efectele fracției de saponină de ginseng roșu și/sau Glycyrrhiza glabra L. pe biomarker seric la șoarecii obezi C57BL/6J induse de dietă bogată în grăsimi
Valorile sunt prezentate ca medie ± SD a experimentelor (n = 8). Diferite litere indică diferențe semnificative între mijloace la P
FIG. 5. Efectele RGS, GG și amestecul acestora asupra proteinelor legate de metabolismul energetic la șoarecii obezi C57BL/6J induși în grăsimi. Valorile sunt prezentate ca medie ± SD a experimentelor (n = 3). Diferite litere indicați diferențe semnificative între mijloace la P
Discuţie
Ginsengul coreean conține o varietate de ginsenozide, ale căror componente principale sunt Rb1, Rg1 și Rb2. 27 Ginsengul roșu coreean fermentat nu numai că mărește conținutul de ginsenozid inerent ginsengului coreean, dar produce și ginsenozide speciale precum Rg2 și Rg3. 28,29 Fracțiunea saponină a ginsengului este compusă din diferite ginsenozide. 30 Am îmbogățit ginsenozidele fracționând saponinele din extractul de ginseng roșu și îndepărtând zahărul și proteinele. Principalul ingredient activ al GG este o saponină triterpenoidă, numită glicirizină (acid glicirizic sau glicirizinat). 31.32 Este alcătuit din două molecule de acid glucuronic și o moleculă de acid gliciretinic. 33 Conținutul de glicirizină în GG este de aproximativ 4-20%, în funcție de regiune și varietate. 31–33
Cauza fundamentală a obezității este dezechilibrul metabolismului energetic. Excesul de energie crește acumularea de TG în țesutul adipos prin lipogeneză. 34 Ambele PPARγ și C/EBPα sunt factori esențiali de transcripție care reglementează diferențierea adipocitelor. 35 Reglează cu exactitate diferențierea celulară prin reglarea unei varietăți de enzime și hormoni din aval, 36 în timp ce SREBP-1c reglează sinteza lipidelor și a colesterolului prin exprimarea sintazelor lipidice multiple. 37 Ginsenoside Rg1, 38 Rg2, 39 Rg3, 40 Rb1, 41 și Rb2 42 au fost raportate pentru a suprima factorii adipogeni (cum ar fi PPARγ, C/EBPα, și SREBP-1c). Sistemul de matrice metaloproteinază (MMP) poate media aceste activități ale ginsenozidelor. 42 Da și colab. 43 au descoperit că formula tradițională pe bază de plante Oyaksungi-San (care conține glicirizină) poate inhiba formarea lipidelor în celulele 3T3-L1 prin suprimarea factorilor adipogeni. Deși aceste substanțe afectează căi diferite, ele reglează în cele din urmă expresia genelor specifice adipocitelor. În prezentul studiu, SG31, o combinație de RGS și GG, a suprimat în mod semnificativ acumularea de TG în adipocitele 3T3-L1 prin reglarea C/EBPα și SREBP-1c.
SG31 poate reduce sinteza și acumularea de TG în ficat și țesutul adipos prin mecanismul de mai sus pentru a reduce greutatea. Scăderea nivelului seric de TG poate demonstra, de asemenea, o acumulare redusă de lipide. Reducerea greutății diferitelor organe și țesut adipos poate duce în cele din urmă la o pierdere în greutate la șoarecii obezi. SG31 nu provoacă citotoxicitate și nici nu afectează alți indicatori serici ai lipidelor.
Amestecul 3: 1 de RGS și GG prezintă efecte anti-obezitate sporite, dar nu excludem că combinații mai diverse vor avea efecte neașteptate. În plus, am dedus un posibil mecanism anti-obezitate din compușii conținuți în extract și studii suplimentare trebuie să clarifice efectorii biologic activi.
În concluzie, un raport 3: 1 dintre RGS și GG a prezentat cea mai mare activitate anti-obezitate. SG31 a inhibat acumularea de TG in vitro și in vivo. De asemenea, a redus greutatea organelor, greutatea țesutului adipos și greutatea corporală la șoarecii induși de obezitate. Mai mult, SG31 a redus expresia factorilor de transcripție adipogenă/lipogenică și a activat calea AMPK, îmbunătățind în continuare echilibrul metabolismului energetic. Deși mecanismul efectului aditiv între RGS și GG este în prezent neclar, rezultatele noastre indică faptul că SG31 ar putea fi dezvoltat ca ingredient alimentar funcțional pentru prevenirea obezității.
Declarația de divulgare a autorului
Autorii declară că nu există conflicte de interese.
Informații de finanțare
Această cercetare a fost susținută de Fondul de cercetare al Universității Hallym, 2019 (HRF-201907-010).
- Nebunia de anorexie în rândul fetelor coreene ridică îngrijorări
- Efect anti-obezitate al extractului din Curcuma longa L fermentată
- Efectele anti-obezitate și antiinflamatorii ale oțetului de ginseng la șoarecii cu hrană bogată în grăsimi SpringerLink
- Efectele antidiabetice ale mildronatului singur sau în asociere cu metformina la șobolanii obezi Zucker -
- Efectele anti-obezitate ale extractului de apă fierbinte și ale extractului de usturoi cu presiune hidrostatică ridicată la șobolani
