Yang-Xi Liu 1 #, Ke-Jia Le 1 #, Chi Zhang 1, Min Cui 1, Hong Zhou 2, Ying-Jie Su 1, Zhi-Chun Gu 1
# Acești autori au contribuit în mod egal la această lucrare.
Cuvinte cheie: Reacție adversă la medicament (ADR); irinotecan; tegafur-gimeracil-oteracil potasiu (S-1); raport de caz; neurotoxicitate
Trimis pe 29 septembrie 2019. Acceptat pentru publicare 15 noiembrie 2019.
Introducere
Chimioterapia după o intervenție chirurgicală laparoscopică radicală variază de la stadiul neoplasmului diferit la pacienții cu cancer de colon. În prezent, terapia combinată cu irinotecan S-1 arată eficacitatea asupra cancerului colorectal metastatic (mCRC) (1). Cu toate acestea, efectele adverse substanțiale, cum ar fi toxicitatea gastro-intestinală și toxicitatea hematologică, scad eficacitatea tratamentului. Între timp, îngrijorarea crescută pentru calitatea vieții pacienților cu cancer limitează, de asemenea, utilizarea acestuia.
Irinotecanul, un analog al camptotecinei solubil în apă, a fost aprobat pentru tratamentul pacienților cu CRC avansat prin inhibarea enzimei nucleare topoizomeraza I (2). Principalele efecte adverse ale irinotecanului sunt diareea și neutropenia. Se raportează că evenimentele adverse au fost dependente de doză atunci când au fost combinate cu fluorouracil/acid folinic (3). Fluoropirimidina S-1 este activă într-o gamă largă de tumori solide prin inhibarea reversibilă a enzimei de limitare a vitezei în degradarea 5-fluorouracilului (5-FU) (4). În prezent, puține articole au raportat evenimente adverse ale S-1 și ale terapiei combinate. Chimioterapia combinată cu irinotecan și S-1 a fost aprobată pentru terapia de a doua linie a mCRC. Acesta este un raport de caz privind mielosupresia severă, diareea și neurotoxicitatea induse de o combinație de irinotecan și S-1.
Prezentarea cazului
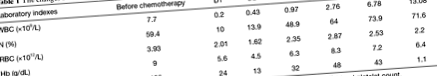
O femeie chineză în vârstă de 76 de ani, cu antecedente de 1 lună de sângerare în scaun, a fost diagnosticată cu cancer de colon ascendent. Pacientul a primit o intervenție chirurgicală laparoscopică radicală asupra cancerului de colon și a fost definit ca T3N0M0 prin examinarea caracteristicilor clinice și a patologiei celulare. Pacienta și-a revenit bine în timpul șederii sale de 11 zile la spital. La cincisprezece zile de la externare, s-a întors la spital pentru tratament chimioterapic. Datele de laborator privind admiterea înainte de prima chimioterapie au fost prezentate după cum urmează: număr de globule albe 7,7 × 10 9/L [referință, (3.97–9.15) × 10 9/L]; granulocit neutrofil 59,4% (referințe, 50-70%); număr de globule roșii 3,93 × 10 12/L [referință, (3,68-5,13) × 10 9/L]; hemoglobină 119 g/dL (referințe, 113–151 g/dL); număr de trombocite din sânge 186 × 10 9/L [referințe, (101-320) × 10 9/L]. Examenul fizic a arătat că pacientul are conștient clar și absența anomaliilor gastro-intestinale, în timp ce pacientul nu avea antecedente familiale de psihoză și era stabil mental.
Pacienta a primit un regim de chimioterapie de a doua linie care constă în irinotecan 240 mg prin portul de transfuzie venoasă încorporat și capsula S-1 (80 m/zi, bid, d1-14) pentru administrare orală, deoarece era alergică la oxaliplatină. Chimioterapia combinată s-a repetat la fiecare 21 de zile pentru fiecare ciclu. Pe parcursul întregului tratament al chimioterapiei, nu a existat o monitorizare regulată a examinării de rutină a sângelui, a funcției hepatice sau a examenului imagistic convențional.
La trei zile după cel de-al 6-lea tratament (la 124 de zile de la prima chimioterapie), pacientul a suferit de diaree care a apărut de 2-3 ori pe zi, însoțită de dureri abdominale ușoare, care nu au atras atenția pacientului. În următoarele patru zile, diareea s-a înrăutățit treptat și a apărut de 7-10 ori pe zi. La nouă zile după ultima rundă de chimioterapie, pacientul a prezentat delir și conștiință neclară și a fost internat la tratament de urgență. Temperatura a fost de 38,6 ° C (referință, 36,0–37,4 ° C), ritmul cardiac a fost de 126 de bătăi pe minut (referință, 60–100 bpm), frecvența de respirație a fost de 26 pe minut (referință, 16–20 pe minut) și sângele presiunea a fost de 105/65 mmHg (referință, 90-140/60-90 mmHg). Datele de laborator au arătat după cum urmează: număr de celule albe din sânge 0,20 × 10 9/L [referință, (3,97-9,15) × 10 9/L]; granulocit neutrofil 10,0% (referințe, 50-70%); număr de celule roșii din sânge 2,01 × 10 12/L (referințe, 3,68-5,13 × 10 12/L); hemoglobină 5,6g/dL (referințe, 11,3-15,1 g/dL); număr de trombocite din sânge 24 × 10 9/L [referințe, (101-320) × 10 9/L].
Discuţie
Pentru pacienții cu cancer de colon în stadiul III sau mai mare, chimioterapia adjuvantă după operație este o modalitate importantă de a îmbunătăți prognosticul. Chimioterapia bazată pe 5-FU, chimioterapia FOLFOX sau CAPOX au fost aplicate pe scară largă ca regimuri de primă linie de chimioterapie ale carcinomului colorectal (6). Cu toate acestea, pacientul a prezentat o reacție alergică la oxaliplatină, care a fost considerată regimul chimioterapiei de primă linie. Irinotecanul este un inhibitor al topoizomerazei I care prezintă eficacitate ca monoterapie în cancerul colorectal avansat (CRC) și este mai eficient în asociere cu fluorouracil. S-1 este o fluoropirimidină orală care include trei agenți diferiți: tegafur, gimeracil și oteracil. Unele cercetări au indicat că terapia combinată cu irinotecan și S-1 ar putea avea o eficacitate bună asupra mCRC, iar mai multe țări din afara Statelor Unite au folosit terapia combinată ca tratament de linia a doua.
Mielosupresia apare frecvent în chimioterapia combinată. Și diareea ar putea fi indusă atât de irinotecan, cât și de S-1, chiar dacă hiper enterita asociată cu S-1 a apărut mai puțin decât diareea cu debut întârziat indusă de irinotecan. Deși inconștiența ar putea fi cauzată de dezechilibrul electrolitic al apei, electroliții serici au fost normali în timpul spitalizării. Prin urmare, neurotoxicitatea asociată cu administrarea concomitentă de irinotecan și S-1 nu poate fi exclusă în conformitate cu scorul portocaliu de reacție adversă la medicamente (definit> 8 puncte, probabil 4-8 puncte, posibil 1-4 puncte, dubioase 0 puncte) . Scorul Naranjo al pacientului (Scala de probabilitate a reacției adverse la medicamente) fiind 6 a indicat faptul că diareea, mielosupresia și neurotoxicitatea care pun viața în pericol au fost probabil cauzate atât de irinotecan, cât și de S-1 (Tabelul 3).
În ceea ce ne privește, diareea și mielosupresia care pun viața în pericol sunt toxicități limitate la doză ale irinotecanului, care ar putea apărea și în chimioterapia S-1. Prin urmare, monitorizarea parametrilor sanguini și a efectelor adverse gastrointestinale sunt în mod normal necesare în timpul chimioterapiei. În mod vizibil, acest pacient nu a urmat sfatul medicului în timpul a 6 runde de tratament combinat cu irinotecan și S-1. Odată ce au apărut diaree severă și mielosupresie, pacientul a fost grav bolnav. Deși medicii au accelerat lucrările de salvare, pacientul a murit. Neurotoxicitatea este raportată mai întâi la terapia combinată cu irinotecan și S-1.
Diareea și neutropenia sunt principalele toxicități care limitează doza în monoterapie cu irinotecan (7). S-a raportat că 80% dintre pacienții care utilizează irinotecan au prezentat diaree, iar 30-40% dintre aceștia au fost de gradul 3-4 (2). Diareea cauzată de irinotecan are două tipuri: sindrom de tip colinergic, care apare de obicei acut în timpul sau imediat după perfuzie, o altă diaree cu debut întârziat apare la aproximativ 5-6 zile după administrare, la fiecare 3 săptămâni (8,9). Se raportează că diareea care pune viața în pericol poate fi legată de expunerea la gena SN-38 și UDP-glucuronosiltransferază 1A1 (10). Diareea legată de S-1 a fost raportată mai puțin decât diareea indusă de irinotecan, dar rata de incidență a diareei induse de S-1 peste gradul 3 a fost încă de 34,5% în timpul tratamentului (11). Pacientul a apărut diaree ușoară după cel de-al 6-lea tratament și sa dezvoltat până la gradul 4 diaree în ziua a 9-a (standard CTCAE), ceea ce ar putea elimina posibilitatea unui sindrom asemănător colinergic. Dar debutul întârziat cauzat de irinotecan și diareea legată de S-1 nu au putut fi excluse.
Mielosupresia este cel mai frecvent efect advers al tuturor agenților citostatici care duc întotdeauna la eșecul chimioterapiei. O supraveghere post-introducere pe piață a 13.935 de pacienți tratați cu irinotecan în Japonia a raportat o incidență ridicată a mielosupresiei (gradul 3 sau mai mult), cu leucopenie fiind de 23,8% și 38,3%, trombocitopenia fiind de 6,5% și 14,3% pentru utilizarea individuală și respectiv concomitentă (12) . Incidența tulburărilor de sânge și a sistemului limfatic legate de S-1 este de până la 68,47%, severitatea fiind de gradul I/II pentru majoritatea cazurilor. Se raportează că gena DPYP ar putea influența activitatea enzimei metabolice 5-FU, care ar putea contribui la diferența concentrației sanguine a S-1 (13). Prin urmare, pacienții cu activitate enzimatică mai scăzută pe S-1 ar putea suferi un risc mai mare de mielosupresie. De fapt, mielosupresia este previzibilă cu examinarea de rutină a sângelui, iar utilizarea antimicrobienelor, RHG-CSF și imunopotentiator ar putea ajuta la prevenirea infecției și a morții. În acest caz, pacientul nu a primit sfatul medicilor privind monitorizarea regulată a indicatorului de sânge.
Ca urmare, pacientul se afla într-o stare critică atunci când au fost găsite neutropenie severă și diaree (8). Neurotoxicitatea este raportată frecvent în regimurile pe bază de platină și rareori a apărut în irinotecan sau în chimioterapia relevantă S-1. În ciuda acestui fapt, neurotoxicitatea ar putea rezulta din dezechilibrul apă-electrolit care este indus de diaree, funcție anormală a ficatului sau a rinichilor. Cu toate acestea, pacientul în acest caz avea niveluri normale ale funcției renale și ale metabolismului electroliților. În consecință, posibilitatea era mare având în vedere că neurotoxicitatea a fost indusă de chimioterapie.
Concluzii
Combinația chimioterapiei cu irinotecan și S-1 poate provoca efecte adverse severe, cum ar fi mielosupresie, diaree sau chiar neurotoxicitate. Prin urmare, pentru a asigura siguranța și eficacitatea chimioterapiei, este important să se evalueze variația parametrilor biochimici în timpul tratamentului. În caz de efecte adverse severe, medicii trebuie să judece imediat și să acorde un tratament individualizat. Și auto-îngrijirea și auto-monitorizarea pacientului este, de asemenea, neacceptată o etapă timpurie a efectelor adverse.
Mulțumiri
Finanțare: Prezentul raport de caz a fost susținut de fondurile de cercetare ale comisiei de sănătate și planificare familială din Shanghai (20184Y0022), Fondul de cultivare a cercetării clinice a spitalului Renji (PY2018-III-06), Institutul de cercetare inovație în farmacie clinică din Școala Universității Jiao Tong din Shanghai Medicină (CXYJY2019ZD001, CXYJY2019QN004) și program pentru discipline cheie, dar slabe ale Comisiei municipale de sănătate și planificare familială din Shanghai (2016ZB0304).
Notă de subsol
Conflictele de interese: Autorii nu au conflicte de interese de declarat.
Declarație etică: Autorii sunt responsabili pentru toate aspectele lucrării, asigurându-se că întrebările legate de acuratețea sau integritatea oricărei părți a lucrării sunt investigate și rezolvate în mod corespunzător. Consimțământul informat scris a fost obținut de la rudele pacientului pentru publicarea acestui raport de caz.
- Husky în vârstă de 1 an, cu diaree recurentă
- Medicamente antidiareice Ameliorarea OTC pentru diaree
- Astaxantina, fără text, fără antioxidanți, previne afectarea mitocondrială indusă de izoproterenol
- ABC Detox Drink De ce mărul, sfecla roșie și morcovul este o combinație excelentă - Alimentele NDTV
- Hepatita acută indusă de droguri secundară unui produs de slăbire cumpărat de pe internet