Înțelegeți opțiunile disponibile cu un diagnostic de astrocitom.
Modificările dietare sunt o modalitate atrăgătoare de adaptare la realitatea diagnosticului de cancer, deoarece dieta este un aspect al vindecării care se află complet sub controlul pacientului. Un fapt binecunoscut în domeniul oncologiei este că fiecare tumoare și tip de tumoare au un profil genetic unic, cu un set individual de mutații, modificări ale numărului de copii, expresia proteinelor și așa mai departe. În consecință, diferite tumori, și în special tumori originare din țesuturi diferite, sau subtipuri diferite de tumori care apar în același țesut (de exemplu glioblastom versus astrocitom mutant IDH1) pot avea cerințe metabolice diferite și sensibilități diferite la diferite forme de privare de nutrienți. Așa cum nu există niciun medicament anticanceros care să funcționeze la fel de bine pentru fiecare tip de cancer, probabil că nu există o singură dietă anticanceroasă. În mod ideal, o dietă ar trebui adaptată la sensibilitățile unice ale tipului tumorii, dacă există astfel de cunoștințe.
Ce să includeți
Există o literatură extinsă cu privire la alimentele cu potențiale proprietăți anticanceroase. Dieta este o astfel de chestiune de gust personal, încât este mai bine ca fiecare persoană să facă o mare parte din propriile cercetări privind alegerile dietetice. Cea mai mare parte a alimentelor anti-cancer se încadrează în rubricile legume, fructe sau condimente. Câteva linii directoare de bază ar putea fi:
- Maximizați alimentele vegetale dense, cu conținut scăzut de calorii și micronutrienți
- Consumul general de fructe ar trebui monitorizat datorită conținutului de zahăr, deși multe tipuri de fructe de pădure se remarcă prin ingredientele lor anticanceroase, de exemplu pterostilbenul găsit în afine și struguri
- Determinați cât de multe proteine necesită corpul dvs. (probabil undeva în vecinătatea a 8-10% din calorii ca proteine (0,65-0,85 grame de proteină pe kilogram de greutate corporală) și limitați aportul de proteine la acel nivel. Cerința anumitor aminoacizi va crește cu toate acestea, la recuperarea după o intervenție chirurgicală sau radioterapie
- Încercați să păstrați un nivel stabil al glicemiei evitând prea mult zahăr, amidon și alimente cu indice glicemic ridicat
- Limitați acizii grași omega-6 (în principal uleiuri derivate din semințe) și includeți uleiurile omega-3 cu lanț lung EPA și DHA, care se găsesc în peștii cu apă rece. Importanța alegerii grăsimilor potrivite merită propria secțiune.
Grăsimi și uleiuri
Principalul lucru de reținut atunci când alegeți grăsimile și uleiurile din dieta dvs. este că cancerul prosperă cu acizii grași omega-6, în special acidul arahidonic cu 20 de carbon. Celulele canceroase folosesc acidul arahidonic ca precursor pentru construirea prostaglandinelor inflamatorii (cum ar fi PGE2) și a leucotrienelor, care promovează cancerul și un factor cauzal major pentru inflamația creierului. O parte din acidul arahidonic din celulele noastre este asamblat din acizi grași omega-6 cu lanț mai mic, cum ar fi acidul linoleic. Cu toate acestea, o proporție mult mai mare poate fi consumată direct în alimente. Ouăle sunt în mod inerent bogate în acid arahidonic, deoarece este necesar pentru dezvoltarea embrionilor. Carnea hrănită cu cereale poate fi, de asemenea, o sursă abundentă de acid arahidonic dietetic. Multe uleiuri din semințe sunt bogate în acid linoleic omega-6, cu excepția uleiului de in și a altora.
O altă modalitate de a limita inflamația care promovează cancerul este de a include cantități abundente de acizi grași omega-3 cu lanț lung, cum ar fi EPA și DHA, care concurează pentru aceleași enzime ca uleiurile omega-6 și au o acțiune antiinflamatoare. Sursa principală de EPA și DHA o constituie diverse specii de pești cu apă rece. Este important să vă asigurați că produsul dvs. din ulei de pește a fost testat pentru mercur și alți contaminanți industriali. Doza optimă de ulei de pește nu a fost stabilită cu fermitate în studiile clinice, deși s-a demonstrat că o doză zilnică de 3 grame de EPA și DHA combinate beneficiază într-un studiu de pacienți cu tumori cerebrale metastazate (secundare).
Substanțele nutritive și nutraceutice specifice (substanțe chimice derivate din alimente cu proprietăți asemănătoare medicamentelor) vor fi discutate în secțiunea Suplimente.
Strategii pentru limitarea accesului tumorii la nutrienți
Un studiu cu șobolani purtători de gliom ne spune că, în funcție de context, suplimentarea cu fier din dietă ar putea fi fie dăunătoare, fie benefică pacienților cu cancer (18). Fierul este un nutrient critic pentru proliferarea celulară, iar glioamele de înaltă calitate au o expresie crescută a receptorilor de transferină (19). Transferrina este principala proteină purtătoare de fier. În studiul pe șobolani (18), șobolanii masculi Wistar au fost implantați în șold cu o linie celulară de gliom de șobolan indusă chimic (tulpina 35) și, după formarea unui nod tumoral, șobolanii au fost împărțiți în mai multe grupuri de tratament. Șobolanilor martori li s-a administrat apă de la robinet conținând 0,2-0,3 mg/L de ioni de fier (Fe 2+). Un alt grup de șobolani a primit apă potabilă suplimentată cu 60-63 mg/L ioni de fier (Fe 2+). În grupul suplimentat cu fier, tumorile au crescut mai repede decât în grupul martor, iar șobolanii suplimentați cu fier au avut o durată de viață cu 34% mai scurtă decât grupul martor.
În contrast marcat, atunci când șobolanilor li s-a administrat o doză unică de radiație de 15 Gy în zona tumorii, șobolanii suplimentați cu fier au avut un răspuns mult mai bun la radiații și o supraviețuire mai lungă decât șobolanii tratați cu radiații, dar fără supliment de fier. Acești șobolani iradiați, suplimentați cu fier, au trăit de două ori mai mult decât șobolanii de control netratați. Celulele gliomice din grupul iradiat, suplimentat cu fier, au murit printr-o combinație de apoptoză și feroptoză, o formă de moarte celulară dependentă de fier. Astfel, fierul apare ca un radiosensibilizator eficient, dar poate stimula de fapt creșterea tumorii în afara contextului radiațiilor.
Restricție calorică
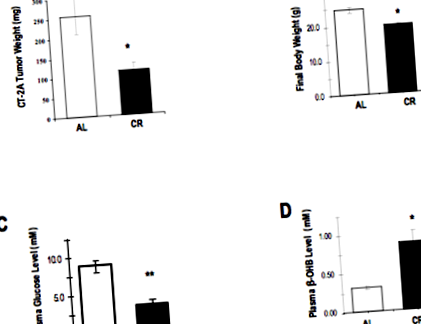
Experimente multiple cu șoareci au arătat beneficiul potențial al restricției calorice (CR) în încetinirea semnificativă a creșterii tumorilor cerebrale implantate. Aceste experimente au folosit astrocitomul CT-2A de șoarece foarte angiogen, implantat în șoareci imunocompetenți. Acest model poate fi considerat a imita glioamele umane foarte angiogene, în special glioblastoamele.
Într-unul din aceste studii (8), șoarecii au fost supuși unei diete de șobolan obișnuit, restricționată caloric cu 30% comparativ cu grupul de control nerestricționat. Acest grad de restricție calorică a determinat șoarecii să piardă 30% din greutatea corporală pe o perioadă de două săptămâni, moment în care toate animalele au fost sacrificate.
Rezultatele acestei restricții calorice asupra creșterii tumorii și a biologiei sunt destul de impresionante. La sfârșitul a două săptămâni, greutatea tumorii a fost redusă cu 65% în grupul CR comparativ cu șoarecii martor. Glicemia a fost redusă cu 63%, iar corpurile cetonice au fost crescute cu 114% la șoarecii CR.
Efectele restricției calorice (CR) față de hrănirea ad libitum (AL) la șoarecii purtători de gliom
La nivel molecular, activarea factorului nuclear de transcripție a factorului nuclear kappa beta (NF-KB) (a se vedea discuția în Targeting Invasion) a fost semnificativ redusă, la fel ca și nivelurile enzimei COX-2 (a se vedea discuția despre Celebrex în medicamente cu utilizare nouă). Ambele molecule sunt implicate în biologia gliomului malign și contribuie la procese precum invazia, angiogeneza și imunosupresia. Chemokina care atrage macrofagele CXCL2 (sau MIP-2) și markerul CD68 al macrofagelor au fost reduse semnificativ la șoarecii CR, dovezi ale scăderii infiltrației de macrofage în tumoră (vezi Macrofage/Microglia asociate cu tumorile).
Studii similare privind restricția calorică la șoareci cu glioame experimentale detaliază beneficii și mecanisme suplimentare prin care restricția calorică poate împiedica creșterea și invazivitatea tumorii. Un avertisment este că metabolismul șoarecilor este de aproximativ șapte ori mai rapid decât metabolismul uman. Prin urmare, ar fi necesară o restricție calorică mai severă pentru a reproduce aceste rezultate la om. Gradul de slăbire este un indicator mai precis al efectelor restricției calorice. Deoarece șoarecii din acest studiu au pierdut 30% din greutatea corporală în decurs de două săptămâni, acest grad de restricție calorică este în mod clar destul de extrem și nu ar fi durabil pe termen lung, deși menținerea pe termen lung a greutății corporale în intervalul normal ar fi probabil benefic.
Efectele stimulatoare ale restricției calorice asupra imunității anti-cancer sunt explorate pe pagina Reeducarea sistemului imunitar.
Restricția proteinelor și IGF-1
Dacă locuiți într-una dintre cele mai bogate țări ale lumii, probabil că luați mai multe proteine decât necesită corpul dumneavoastră. Dintre cele trei surse de calorii (carbohidrați, proteine și grăsimi), proteinele au probabil cea mai bună reputație ca fiind bune pentru sănătate, așa că nu auzim adesea despre beneficiile reducerii aportului de proteine.
Aportul mediu pentru nord-americani și nord-europeni este de aproximativ 15-18% din totalul caloriilor sub formă de proteine. Aceasta este semnificativ mai mare decât doza zilnică recomandată de 10% din calorii ca proteine (sau aproximativ 0,83 grame de proteine pe kilogram de greutate corporală). ADR este conceput pentru a satisface necesarul de proteine de 97,5% din populația adultă. Necesarul mediu de proteine pentru un adult sănătos este chiar mai mic decât acesta: 0,65 grame de proteine pe kilogram de greutate corporală, sau poate 8% din totalul caloriilor (9). Okinawanii, o populație cu rate foarte mici de cancer, iau aproximativ 9% din calorii ca proteine (10).
Factorul de creștere asemănător insulinei 1 (IGF-1), după cum sugerează și numele său, promovează creșterea celulară. Prin atașarea la receptorul său (IGF1R), inițiază activarea căii de semnalizare infame PI3K/Akt/mTOR, care este hiperactivă în multe tipuri de cancer, incluzând atât astrocitoame de grad înalt, cât și de grad scăzut (11). De fapt, unul dintre principalele medicamente testate în prezent în studiile clinice pentru gliom de grad scăzut este everolimus, un inhibitor al mTOR. Aici intervine importanța restricționării proteinelor.
Restricția proteinelor versus restricția calorică
Atât studiile efectuate pe animale, cât și la oameni au constatat că aportul de proteine este determinantul major al nivelurilor serice de IGF-1. Un studiu (9) a pus un grup de oameni pe o dietă cu restricție calorică de 20% timp de un an. În timp ce această restricție calorică moderată pe termen lung a redus nivelurile de insulină și proteina C reactivă (un marker de inflamație), IGF-1 seric nu a fost redus în acest grup. Anchetatorii au comparat apoi membrii Societății de Restricție a Caloriilor (consumând în medie 1800 kcal pe zi, 24% din totalul caloriilor din proteine) cu vegani fără restricții calorice care consumă doar 10% din totalul caloriilor ca proteine. Ambele grupuri au avut niveluri similare scăzute de insulină și proteine C-reactive, dar veganii cu conținut scăzut de proteine au avut niveluri mai scăzute de IGF-1 total și liber, în ciuda greutății corporale mai mari, a indicelui de masă corporală și a conținutului de grăsime corporală. Pentru a demonstra în continuare corelația aportului scăzut de proteine cu IGF-1 redus, șase membri ai grupului de restricție calorică și-au redus aportul de proteine cu 43%, la un nivel chiar peste cel al veganilor cu conținut scăzut de proteine, timp de trei săptămâni. Această intervenție a condus la o scădere cu 25% a IGF-1 seric.
Legătura dintre aportul de proteine, nivelurile de IGF-1 și creșterea tumorii a fost demonstrată în studii controlate pe animale. Același grup care a publicat studiul descris anterior (9) a efectuat, de asemenea, un studiu care a comparat 7% până la 21% din caloriile totale sub formă de proteine la șoareci îngropați cu celule de cancer de prostată și de sân (10). Când șoarecii au fost pregătiți cu dietele lor proteice de 21% sau 7% timp de patru săptămâni înainte de implantarea celulelor de cancer de prostată, diferența în consumul de proteine a dus la o reducere cu 81% a greutății tumorale pentru grupul proteic inferior până la sfârșitul studiului. Când restricția de proteine a fost inițiată la patru săptămâni după implantarea celulelor tumorale, grupul proteic inferior avea cu 50% tumori mai ușoare decât grupul proteic superior la sfârșitul studiului. În mod semnificativ, nu a existat nicio diferență în greutatea corporală sau nivelurile de glucoză între cele două grupuri, arătând că nivelurile de glucoză nu au avut niciun impact asupra restricției de creștere a tumorii observate în acest studiu. În mod impresionant, xenogrefele de cancer de prostată abia au crescut la șoarecii cu restricție proteică.
În același studiu, investigatorii au comparat apoi restricția proteinelor cu chimioterapia cu inhibitorul mTOR everolimus, precum și restricția proteinelor și everolimus combinate. Șoarecii cu restricție proteică (7% din caloriile totale ca proteine) și șoarecii cărora li s-a administrat everolimus au avut un grad similar de inhibare a creșterii tumorale. Tumorile au fost cele mai mici atunci când restricția proteinelor a fost combinată cu everolimus. Pentru a explica această inhibiție tumorală eficientă, au fost testate nivelurile de mTOR fosforilat (activ), S6K fosforilat (o țintă din aval a mTOR) și Ki67 (un marker al proliferării celulare). Restricția proteinelor a redus semnificativ fiecare dintre acești trei markeri, la fel ca terapia everolimus în monoterapie, cu cea mai mare inhibiție în urma restricției combinate de proteine și everolimus. Autorii notează că restricția de proteine este mai puternică decât restricția de calorii sau grăsimi în scăderea nivelului de IGF-1.
Aceste studii care arată eficacitatea restricției de proteine în reducerea nivelurilor de IGF-1 și încetinirea creșterii tumorii sunt foarte încurajatoare, în timp ce restricția calorică poate oferi beneficii pe termen scurt, consumul de mai puține calorii decât necesită organismul nu poate fi durabil pe termen lung. Beneficiile restricției proteice, pe de altă parte, sunt independente de restricția calorică și, prin urmare, pot fi susținute pe termen lung.
tumori mutante p53 și privarea de glucoză
Cele mai multe mutații ale genei TP53 în cancer determină supraexprimarea proteinelor p53 mutante, care au dobândit un câștig de funcție oncogen. Nu este pur și simplu o chestiune de pierdere a funcției supresoare tumorale p53, ci un câștig al funcției promotor tumoral de către proteinele mutante. Mutațiile TP53 sunt aproape universale în astrocitoamele mutante IDH și sunt, de asemenea, frecvente în oligoastrocitoamele mutante IDH și în anumite subtipuri de glioblastom. Un studiu (16) publicat în 2012 în revista Cell Cycle de un grup de la Universitatea Georgetown din Washington DC oferă dovezi că acumularea de proteine mutante p53 poate fi inhibată de o dietă cu restricție severă în carbohidrați, ceea ce duce la inhibarea semnificativă a creșterii tumorale la șoarecii cu mutanți. tumori p53.
Cercetătorii au arătat mai întâi că expresia proteinelor p53 mutante poate fi inhibată in vitro prin epuizarea concentrației de glucoză din mediul celular. În schimb, expresia p53 mutantă nu a fost afectată de epuizarea serului sau a aminoacizilor. S-a constatat că această inhibare a acumulării mutante de p53 după epuizarea glucozei se datorează degradării (descompunerii) proteinelor printr-un proces autofagic mai degrabă decât prin activitatea proteazomatică.
Această defalcare a p53 mutantă prin restricție de glucoză a fost apoi testată la șoareci. Șoarecii transgenici p53-mutanți (p53 A135V) și șoarecii de tip sălbatic (non-mutanți) au fost randomizați la una dintre cele trei diete: un chow normal de șoarece, o dietă săracă în carbohidrați și o dietă bogată în carbohidrați. Dieta cu conținut scăzut de carbohidrați a fost de 74% proteine, 24% grăsimi și 2% carbohidrați prin conținut caloric sau 71,7% proteine, 10% grăsimi și 1,9% carbohidrați în greutate (restul fiind fibre, vitamine și minerale). După conținutul caloric, dieta standard și dietele bogate în carbohidrați au fost 53% și 69% carbohidrați, 20% și 17% proteine.
Testele de sânge au arătat că șoarecii din dieta cu conținut scăzut de carbohidrați au redus semnificativ nivelul glicemiei la jeun: în jur de 100 sau împărtășiți acest lucru
- Distilatoarele de cereale oferă opțiuni de hrănire a porcilor săpate adânc pentru a valorifica DDGS National Hog Farmer
- Seria de conferințe distincte O dietă sănătoasă - Ce știm și ce este doar hype - Calendarul IRSC
- Produse alimentare livrate Jenny Craig - Resurse pentru slăbit
- Oferirea de știri despre dietă pacienților reticenți - Publicații Raenali
- INSTITUTUL DE ÎNVĂȚĂMÂNT AL DISTRICTULUI; FORMARE (DIETĂ), Nadia P