Ren-Di Jiang
un laborator cheie CAS pentru agenți patogeni speciali și biosecuritate, Institutul de Virologie Wuhan, Academia Chineză de Științe, Wuhan, China
b Universitatea din China, Academia de Științe, Beijing, China
Bei Li
un laborator cheie CAS pentru agenți patogeni speciali și biosecuritate, Institutul de Virologie Wuhan, Academia Chineză de Științe, Wuhan, China
Xiang-Ling Liu
un laborator cheie CAS pentru agenți patogeni speciali și biosecuritate, Institutul de Virologie Wuhan, Academia Chineză de Științe, Wuhan, China
Mei-Qin Liu
un laborator cheie CAS pentru agenți patogeni speciali și biosecuritate, Institutul de Virologie Wuhan, Academia Chineză de Științe, Wuhan, China
b Universitatea din China, Academia de Științe, Beijing, China
Jing Chen
un laborator cheie CAS pentru agenți patogeni speciali și biosecuritate, Institutul de Virologie Wuhan, Academia Chineză de Științe, Wuhan, China
b Universitatea din China, Academia de Științe, Beijing, China
Dong-Sheng Luo
un laborator cheie CAS pentru agenți patogeni speciali și biosecuritate, Institutul de Virologie Wuhan, Academia Chineză de Științe, Wuhan, China
b Universitatea din China, Academia de Științe, Beijing, China
Bing-Jie Hu
un laborator cheie CAS pentru agenți patogeni speciali și biosecuritate, Institutul de Virologie Wuhan, Academia Chineză de Științe, Wuhan, China
b Universitatea din China, Academia de Științe, Beijing, China
Wei Zhang
un laborator cheie CAS pentru agenți patogeni speciali și biosecuritate, Institutul de Virologie Wuhan, Academia Chineză de Științe, Wuhan, China
Shi-Yue Li
c Universitatea Wuhan, Wuhan, China
Xing-Lou Yang
un laborator cheie CAS pentru agenți patogeni speciali și biosecuritate, Institutul de Virologie Wuhan, Academia Chineză de Științe, Wuhan, China
Zheng-Li Shi
un laborator cheie CAS pentru agenți patogeni speciali și biosecuritate, Institutul de Virologie Wuhan, Academia Chineză de Științe, Wuhan, China
Date asociate
Abstract
Infecțiile cu ortoreovirus de mamifer (MRV) sunt omniprezente la mamifere. Dovezi din ce în ce mai mari sugerează că unele MRV pot provoca boli respiratorii severe și encefalită la oameni și la alte animale. Anterior, am izolat șase tulpini MRV de lilieci. Cu toate acestea, patogenitatea acestor virusuri de lilieci rămâne neclară. În acest studiu, am investigat gama gazdei și patogenitatea a 3 tulpini MRV de lilieci (WIV2, 3 și 7) care reprezintă trei serotipuri. Rezultatele noastre au arătat că toate acestea pot infecta liniile celulare de la diferite specii de mamifere și au afișat o eficiență de replicare diferită. Șoarecii BALB/c infectați cu MRV-uri de lilieci au prezentat simptome clinice cu infecție sistematică în special în plămâni și intestine. S-au găsit leziuni evidente ale țesuturilor în toți plămânii infectați. Una dintre tulpini, WIV7, a prezentat o eficiență mai mare de replicare in vitro și vivo și o patogeneză mai severă la șoareci. Rezultatele noastre oferă noi dovezi care arată o potențială patogenitate a MRV-urilor de lilieci la animale și risc probabil la om.
1. Introducere
Ortoreovirusurile de mamifere (MRV) aparțin genului Orthoreorivus din familia Reoviridae cu zece genomi de ARN dublu catenar segmentați (Day, 2009; Mayor și colab., 1965). MRV sunt prototipul reovirusului și patru serotipuri au fost definite în funcție de reacția de neutralizare a serului anti-MRV și de capacitatea de a inhiba hemaglutinarea (Attoui și colab., 2001; Rosen, 1960; Sabin, 1959; Vasquez și Tournier, 1962) . Acestea sunt larg distribuite în întreaga lume. Particulele virale infecțioase pot fi găsite în apa râului și în canalizarea brută (Matsuura și colab., 1988, 1993). De la descoperirea sa, MRV-urile umane au fost izolate în mod repetat de probele de tract respirator și enteric ale copiilor. Deși cauzează de obicei simptome respiratorii/gastro-intestinale ușoare sau boli asimptomatice (El-Rai și Evans, 1963; Leers și Rozee, 1966; Sabin, 1959), unele cazuri au fost raportate recent la oameni, arătând că MRV-urile au fost responsabile de pneumonie severă și encefalită (Ouattara și colab., 2011; Steyer și colab., 2013; Tyler și colab., 2004).
Liliecii sunt singurele mamifere zburătoare cu peste 50 de milioane de ani de istorie evolutivă (Teeling și colab., 2005). Liliecii sunt bine cunoscuți ca rezervoare naturale ale unor agenți patogeni umani importanți, cum ar fi coronavirusul asociat sindromului respirator acut sever (SARS-CoV), virusul Marburg și virusul Nipah (Botvinkin și colab., 2003; Chua și colab., 2002; Ge și colab. al., 2013; Leroy și colab., 2005; Yang și colab., 2015a). Orthoreovirusurile au fost detectate la lilieci din întreaga lume (Jansen van Vuren și colab., 2016; Lelli și colab., 2015; Lorusso și colab., 2015; Yang și colab., 2015b). Ortoreovirusurile cunoscute de lilieci sunt împărțite în principal în 2 grupe, ortoreovirusurile pteropine (PRV) și MRV-urile liliecilor (Kohl și colab., 2012; Lelli și colab., 2013; Li și colab., 2016). Unele PRV, cum ar fi virusul Melaka și virusul Kampar, izolate de lilieci au fost suspectate a fi responsabile pentru bolile umane (Chua și colab., 2007, 2008). Au existat unele studii privind patologia PRVs și MRVs de lilieci izolate de alte mamifere (Egawa și colab., 2017; Kanai și colab., 2018; Li și colab., 2015). Cu toate acestea, patogenitatea MRV-urilor de lilieci la oameni și animale rămâne neclară.
Anterior, am izolat 6 tulpini MRV din fecale de lilieci și probe de urină (Yang și colab., 2015b), iar secvențele lor genomice au o asemănare mare cu izolatele de nurcă bolnavă, purcei sau copii (Dai și colab., 2012; Lian și colab. ., 2013; Ouattara și colab., 2011). Aceste MRV de lilieci aparțin serotipului 1, 2 sau 3. al ortoreovirusului la mamifere. Cu toate acestea, patogenitatea și potențialul lor de transmitere a speciilor nu au fost analizate. În acest studiu, am selectat fiecare dintre cele 3 serotipuri și am evaluat gama gazdelor lor în diferite linii celulare și patogeneza la șoareci.
2. Materiale și metode
2.1. Declarație de etică
Toate animalele infectate cu MRV-uri pentru lilieci au fost manipulate în instalații pentru animale de nivel 2 pentru biosecuritate, în conformitate cu recomandările pentru îngrijirea și utilizarea Consiliului de revizuire instituțională al Institutului de virologie Wuhan al Academiei de Științe din China (numărul de etică WIVA05201401). Șoarecii au fost inoculați cu virus sub anestezie adecvată și s-au făcut toate eforturile pentru a minimiza orice durere și suferință potențială.
2.2. Viruși și linii celulare
Liliacul MRV-WIV2, WIV3 și WIV7, reprezentând serotipurile 1, 2 și respectiv 3, au fost izolate din probele de lilieci așa cum s-a descris anterior (Yang și colab., 2015b). Toți virușii au fost înmulțiți și titrați în celule renale de maimuță verde africană (Vero E6) (ATCC CRL-1586). Supernatantul virusului a fost diluat în serie în mediul Eagle modificat (DMEM) al lui Dulbecco (Gibco, Waltham, SUA) și adăugat la celulele Vero E6 însămânțate într-o placă cu 96 de godeuri. După 1 oră de incubație, supernatantul a fost îndepărtat și s-a adăugat DMEM suplimentat cu 2% cu ser fetal bovin (FBS) (Gibco, Waltham, SUA). Plăcile au fost observate zilnic timp de 5-7 zile pentru a urmări dezvoltarea efectului citopatic (CPE). Doza infecțioasă cultură mediană de țesut (TCID50) a fost calculată prin formula Reed-Muench.
Rinichiul Myotis ricketti (MdKi), celulele pulmonare Hipposideros pratti (HpLuT) și celulele renale Pteropus alecto (PaKi) au fost cultivate în amestecul Dulbecco modificat mediu/nutritiv F-12 (DMEM/F-12) (Gibco, Waltham, SUA) cu 10% FBS la 37 ° C și 5% CO2. Celule epiteliale bazale alveolare umane A549 (ATCC CCL-185), celule de col uterin uman Hela (ATCC CCL-2), celule renale de maimuță LLC-MK2 (ATCC CCL-7), celule renale feline FK (ATCC CCL-94) și Madin- Celulele renale darby canine MDCK (ATCC CCL-34) au fost cultivate în DMEM suplimentat cu 10% FBS la 37 ° C și 5% CO2.
2.3. Testul tropismului celular
Celulele au fost însămânțate în 24 de plăci de godeuri cu o zi înainte și infectate cu virus la infecția multiplă (MOI = 1) (Ge și colab., 2013). După 24 de ore de infecție, celulele au fost spălate cu soluție salină tamponată cu fosfat (PBS), fixate cu 4% paraformaldehidă și permeabilizate cu 0,1% Triton X-100. Celulele permeabilizate au fost blocate cu ser albumină bovină (BSA) (Sangon Biotech, Shanghai, China) și apoi incubate cu anticorpi primari (anticorp policlonal anti-WIV3 de iepure). Celulele au fost spălate cu PBS și colorate cu anticorp secundar anti-iepure marcat cu izotiocianat de fluoresceină (FITC) (PTGLab, Rosemont, SUA) și 4 ′, 6-diamidino-2-fenilindol, dihidroclorură (DAPI) (Roche, Basel, Elveția). Imaginile au fost achiziționate cu ajutorul unui microscop confocal FV1200 (Olympus, Tokyo, Japonia). Curba de creștere a fost determinată prin reacția în lanț a polimerazei cu transcripție inversă (RT-qPCR) descrisă mai jos. Pe scurt, 200 pl de supernatant de cultură celulară au fost colectate la 0, 12, 24, 48 și 72 h post-infecție (hpi) din celule însămânțate, respectiv. A fost extras ARN viral și s-a efectuat RT-qPCR pentru a determina încărcătura virală.
2.4. Experimente de infectare a animalelor
Șoarecii femele BALB/c în vârstă de patru săptămâni (Laboratory Animal Center din Wuhan Institute of Virology, CAS) au fost anesteziați cu 250 mg/kg de Averdin (Sigma-Aldrich, St. Louis, SUA) înainte ca animalele să fie inoculate intranazal cu 10 5 TCID50 din WIV2, WIV3, WIV7 sau DMEM ca control fals. Simptomele clinice și greutatea corporală au fost monitorizate în fiecare zi până la 21 de zile. Replicarea virusului și patogeneza au fost determinate pe țesuturile colectate de la șoareci la 1, 3, 5, 7, 10, 14 și 21 de zile după infecție (dpi). Probele de ser au fost separate de întregul sânge prin coagulare la 37 ° C timp de 1 oră și centrifugare la 3.000 × g timp de 10 minute.
2.5. Histopatologie și imunohistochimie (IHC)
Țesuturile colectate au fost secționate și utilizate pentru colorarea hematoxilinei și eozinei (H&E) și a IHC pentru detectarea antigenului MRV. Pentru IHC, secțiunile de țesut deshidratat cu parafină au fost plasate în tampon de reparare a antigenului pentru recuperarea antigenului într-un cuptor cu microunde. Feliile au fost plasate într-o soluție de peroxid de hidrogen 3% și incubate cu lumină pentru a bloca peroxidaza endogenă. Țesutul a fost acoperit uniform cu 3% BSA și incubat la temperatura camerei. Un anticorp primar (anticorp policlonal anti-WIV 3 de iepure) a fost adăugat în picături la secțiuni și apoi spălat în PBS. După ce feliile au fost ușor uscate, țesuturile au fost acoperite cu peroxidază de hrean (HRP) marcată împotriva imunoglobulinei de iepure G (IgG, Proteintech, Rosemont, SUA). După spălare în PBS, s-a adăugat soluție de 3,3'-diaminobenzidină (DAB) proaspăt preparată, iar apoi nucleele au fost incubate cu hematoxilină. Informațiile despre imagine au fost colectate utilizând sistemul Pannoramic MIDI (3DHISTECH, Budapesta, Ungaria).
2.6. Determinarea replicării virusului in vivo
2.7. Expresia genelor legate de citokine
Plămânii omogenizați au fost preparați așa cum s-a descris anterior. S-au folosit o sută de microlitri de suspensie pentru a extrage mARN-ul gazdei cu RNAprep Pure Cell/Bacteria Kit (TIANGEN, Beijing, China). RT-qPCR relativ a fost efectuat așa cum s-a descris anterior (Zeng și colab., 2016). Secvențele de exemplu au fost utilizate pentru amplificarea genelor țintă (tabelul suplimentar S1). ARNr-ul din anii 18 a fost utilizat ca control endogen pentru a normaliza intrarea ADNc. Expresia genică legată de citokine a fost determinată utilizând software-ul StepOne.
2.8. Analize statistice
Analizele statistice au fost efectuate folosind PRISM ™ 5.01 pentru Windows (GraphPad, San Diego, SUA). Diferențele semnificative între grupuri au fost determinate utilizând analiza de varianță în două direcții (ANOVA).
3. Rezultatul
3.1. MRV-urile de lilieci au prezentat tropism cu celule largi in vitro
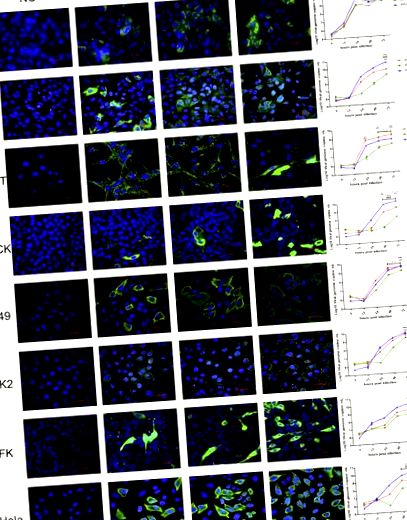
Toate liniile celulare, inclusiv de la om, maimuță, câine, pisică și liliac, au fost susceptibile la MRV-urile cu 3 lilieci. Cinetica creșterii a arătat că cei 3 viruși au eficiențe de replicare diferite (Fig. 1). WIV7 a arătat cea mai mare eficiență de replicare în 6 din 8 linii celulare testate. WIV2 s-a reprodus mai bine decât WIV3 în toate liniile celulare testate.
Greutatea corporală se modifică după infecția virală. Șoarecii BALB/c femele în vârstă de patru săptămâni au fost infectați cu 105 5 liliaci TCID50 MRV WIV2, WIV3 sau WIV7 pe calea internă. Greutățile corporale au fost măsurate la 0, 1, 2, 3, 4, 5, 6, 7, 10, 14 și 21 de zile după infecție. Bara de erori indică eroarea standard. ** P Fig. 3, Fig. Suplimentare. S2). Toate aceste tulpini provoacă infecții sistemice la șoareci. Virușii s-au reprodus bine în plămâni, splină, ficat și intestine. Cea mai mare încărcare virală a fost observată în plămâni pentru toate tulpinile urmate de intestine. WIV2 s-a reprodus mai bine decât WIV3 în toate liniile celulare testate, dar nu a fost detectat în creier, spre deosebire de WIV3 a fost detectat din ziua 10 până la punctul final. WIV7 a arătat o eficiență de replicare mai mare la șoareci decât celelalte 2 tulpini, prezentând o încărcare virală mai mare și o persistență mai lungă a infecției în majoritatea organelor testate, în special în creier. Un nivel scăzut de viremie a fost găsit doar în serul șoarecilor infectați cu WIV7 între 3 și 7 dpi (Tabelul suplimentar S2).
Sarcina ARN virală în țesuturile pulmonare și cerebrale după infecția cu MRV liliac. Plămânul și creierul de la șoareci BALB/c infectați la 1, 3, 5, 7, 10, 14 și 21 dpi au fost detectați pentru încărcarea virală de ARN. WIV2, WIV3 și WIV7 arată o eficiență diferită a infecției la șoarecii BALB/c. N = 3 în fiecare punct de timp. Bara de erori indică eroarea standard. Subliniul negru reprezintă comparația între grupurile indicate, * P Fig. 4 A și E, Suplimente Fig. S1). Au fost găsite leziuni și inflamații evidente ale țesuturilor în toate secțiunile pulmonare infectate. Plămânii infectați cu WIV2 și WIV3 au prezentat o grosime alveolară distinctă și cu o anumită infiltrare limfocitară în jurul vaselor (Fig. 4 B, C Fig. S1 suplimentar). La șoarecii infectați cu WIV7, structura alveolară a scăzut masiv în plămâni și a prezentat mai multă infiltrație limfocitară în țesutul interstițial (Fig. 4 D). Nu s-au observat diferențe în alte țesuturi comparativ cu grupul martor pentru toți virusii testați (Fig. S3 suplimentară). Antigenele virale au fost detectate în zonele leziunilor pulmonare prin colorarea IHC (Fig. 4 F, G și H).
Infecția cu MRV de liliac provoacă pneumonie severă la șoarecii BALB/c. Lobul pulmonar stâng al șoarecilor BALB/c la 14 dpi a fost supus examenului patologic prin colorare H&E și test IHC, imaginile au fost luate de la baza plămânilor. A și E, șoareci infectați simulat examinați prin colorare H&E și, respectiv, IHC. B-D, șoarecii infectați cu WIV2, WIV3 și respectiv WIV7, au fost examinați prin colorare H&E. Țesuturile testate au prezentat pneumonie severă cu îngroșare alveolară distinctă, reducere a bronhiolelor și alveolelor (cutie neagră) și infiltrație limfocitară (săgeată neagră). Bara de scară este de 200 μm. Pentru testul IHC, anticorpul policlonal anti-WIV3 de iepure a fost utilizat ca anticorp primar și IgG anti-iepure de capră marcat HRP a fost folosit ca anticorp secundar. Zona pozitivă este galben maroniu și poate fi observată în plămânii infectați cu WIV2- (F), WIV3- (G) și WIV7 (H). Bara de scală este de 100 μm.
3.5. Răspuns imun la șoareci infectați cu virus
Cele 3 MRV-uri de lilieci au prezentat diferite profiluri de tropism tisular și eficiență de replicare. Toate virusurile s-au reprodus în inimă, ficat, splină, plămâni, intestin și țesuturi cerebrale, cu cea mai mare replicare în plămâni urmată de intestine. Dintre cele trei tulpini, WIV7 a arătat cea mai mare eficiență de replicare în 6 din 8 linii celulare testate. In vivo, replicarea mai mare a WIV7 a fost, de asemenea, detectată în plămâni chiar și până la 10 dpi în comparație cu WIV2 și WIV3, precum și în creier, ceea ce poate facilita patogenitatea sa ridicată. În plus, niveluri scăzute de viremie au fost observate numai la șoarecii infectați cu WIV7 în stadiul incipient al infecției, ceea ce poate ajuta la diseminarea virusului pentru infecția sistemică. Șoarecii infectați cu WIV7, structura alveolelor au scăzut masiv în plămâni și au prezentat mai multă infiltrare limfocitară decât țesuturile pulmonare infectate cu WIV2 și WIV3, care au prezentat, de asemenea, grosime alveolară distinctă și cu o anumită infiltrare limfocitară în jurul vaselor.
Combinând replicarea mai mare în celule și țesuturi, în special creierul, precum și deteriorarea mai severă a țesutului pulmonar și răspunsul imun înnăscut mai slab și întârziat la șoarecii infectați cu WIV7, bănuim că WIV7 are o patogenitate mai mare decât WIV2 și 3 și WIV2 are cea mai mică patogenitate. Ar trebui luată o supraveghere viitoare asupra acestui virus. În concluzie, am demonstrat riscul potențial al transmiterii MRV de lilieci la oameni sau alte animale, oferind dovezi ale tropismului lor celular, patogenității și răspunsului imun la șoareci. Rezultatele au arătat că unele MRV-uri de lilieci sunt potențial patogene pentru populațiile de animale și de oameni din care nu există anticorp preexistent din cauza căii de transmisie a MRV-ului și a contactului strâns dintre lilieci și societatea umană. Supravegherea continuă a acestor virusuri de lilieci și educația pentru a se ține departe de animalele sălbatice ar trebui efectuate pe termen lung.
Declarația contribuției autorului
Ren-Di Jiang: Conceptualizare, metodologie, investigație, scriere-Proiect original Bei Li: metodologie, resurse, validare Xiang-Ling Liu: validare Mei-Qin Liu: anchetă Jing Chen: investigație Dong-Sheng Luo: validare Bing-Jie Hu: Investigație Wei Zhang: Resurse Shi-Yue Li: Resurse Xing-Lou Yang: Conceptualizare, metodologie, organizarea datelor, scriere-revizuire și editare Zheng-Li Shi: conceptualizare, analiză formală, supraveghere, scriere-revizuire și editare.
Mulțumiri
Mulțumim Centrului de Analiză Instrumentală și Metrologie al Institutului de Virologie Wuhan, CAS, pentru asistență în realizarea fotografiilor confocale la microscop (Ding Gao) și a experimentelor de histologie (Juan Min). Mulțumim Centrului pentru animale de laborator din institutul de virologie Wuhan, CAS, pentru asistență în experimentele pe animale (Xue-fang An și Fan Zhang).
Acest studiu a fost finanțat în comun de către Fundația Națională pentru Științe Naturale din China Grant (31400143) către XLY. Programul strategic de cercetare prioritară al Academiei Chineze de Științe (XDB29010101) către ZLS.
Note de subsol
Anexa A Datele suplimentare la acest articol pot fi găsite online la https://doi.org/10.1016/j.virol.2020.05.014.
Anexa A. Date suplimentare
Următoarele sunt datele suplimentare la acest articol:
- Medicamentele antidepresive care cauzează pierderea în greutate (produse de top) Cele mai bune pastile pentru creșterea în greutate
- Un stil de viață sedentar ar putea fi cauza coccidiniei
- 11 20 2019) Pastile Adhd Cauză Pierdere în Greutate Pastile lichide pentru slăbit Pilule extreme pentru slăbit ilegal
- 9 exerciții nepopulare de ab t Cauză dureri de spate
- 5 alimente care cauzează grăsimea abdominală