Ole H. Petersen
Grupul MRC, Școala de Biosștiințe Cardiff, Universitatea Cardiff, Clădirea Științelor Biomedicale, Avenue Museum, Cardiff, CF10 3AX, Marea Britanie
Abstract
Pancreasul exocrin sintetizează toate enzimele necesare pentru descompunerea intestinală a proteinelor, grăsimilor și carbohidraților din dieta noastră. Din păcate, proteazele necesare pentru digestia cărnii pe care o consumăm pot, dacă sunt activate în mod necorespunzător în interiorul celulelor acinare, să digere și pancreasul în sine, precum și țesuturile din jur, ceea ce se întâmplă în bolile umane uneori fatale, pancreatita acută. Boala este în prezent netratabilă, dar recent s-au făcut progrese semnificative în înțelegerea proceselor fundamentale care inițiază modificările patologice care stau la baza autodigestiei pancreatice. Acum este clar că activarea intracelulară a tripsinei - un pas crucial în patogeneză - se datorează eliberării excesive de Ca 2+ din depozitele intracelulare, în principal prin intermediul a două tipuri de receptor de inozitol trisfosfat. Descoperirea recentă neașteptată a unui mecanism de protecție intrinsec cauzată de calmodulină intracelulară și, în mod specific, constatarea că acest efect protector poate fi stimulat de o peptidă ca Ca 2+ permeabilă la membrană sunt promițătoare.
Introducere și context
Există un acord general conform căruia activarea proteazei intracelulare este etapa crucială de inițiere și că acest proces depinde de eliberarea substanțială de Ca 2+ din depozitele interne urmată de intrarea Ca 2+ din spațiul extracelular. De asemenea, este clar că evenimentul biochimic inițial, și anume activarea proteazei, are loc în același timp cu - și este într-un fel legat de - vacuolizarea intracelulară; adică transformarea granulelor de zimogen (vezicule secretoare care conțin proenzimă densă de electroni) în vacuole cu aspect gol. Vacuolizarea, la fel ca activarea proteazei, este un proces dependent de Ca 2+. Demonstrația că activarea tripsinei a fost inițiată în vacuolele post-exocitotice endocitice a fost constatarea crucială care leagă activarea proteazei (tripsina) și vacuolizarea [6].
Stimul fiziologic - cuplarea secreției și stimulul patologic - activarea proteazei
Un alt aspect foarte important de luat în considerare în ceea ce privește patogeneza este producția de energie. Piroanele citosolice repetitive de Ca 2+ cauzează repete creșteri ale creșterii mitocondriale [Ca 2+] care, la rândul său, activează dehidrogenazele din ciclul Krebs dependent de Ca 2+, generând producția de ATP mitocondrială. În schimb, o creștere susținută a [Ca 2+] citosolicului dă naștere doar la o explozie inițială de creștere mitocondrială [Ca 2+] și, prin urmare, o singură perioadă tranzitorie de generație ATP [7]. Deoarece ATP este necesar pentru procesul secretor, acesta este, fără îndoială, un motiv pentru lipsa secreției de protează la niveluri ridicate (nefiziologice) de stimulare, precum și la pancreatita acută.
Acizii biliari induc pancreatita acută
O cauză frecventă a pancreatitei acute este calculii biliari, despre care se crede că provoacă boli prin blocarea canalului pancreatic sau prin obstrucționarea unui canal comun (biliar - pancreatic). Acest ultim mecanism ar permite refluxul de bilă în pancreas și ar provoca leziuni pancreatice, deși importanța acestui mecanism special a fost dezbătută [9]. În orice caz, s-a demonstrat că absorbția de acid biliar mediată de transportator determină moartea celulară dependentă de Ca 2+ în celulele acinare pancreatice in vitro [10]. Efectul principal al acizilor biliari intracelulari este de a elibera Ca 2+ atât din reticulul endoplasmatic cât și din depozitele de acid din regiunea granulară apicală prin activarea receptorilor de inozitol trisfosfat (IP3) și a rianodinei (canalele de calciu intracelulare) [11], inducând fie apoptoza, fie necroză. Nivelul ATP intracelular pare a fi crucial în determinarea tipului de moarte celulară. Acest lucru poate fi demonstrat în experimentele de înregistrare a celulelor întregi (unde interiorul celulei este în contact direct cu un volum mare de soluție de pipetă), care arată că prezența ATP în soluție duce la acizi biliari care provoacă apoptoză, spre deosebire de necroză. [12].
Alcool: Este periculos pentru pancreas?
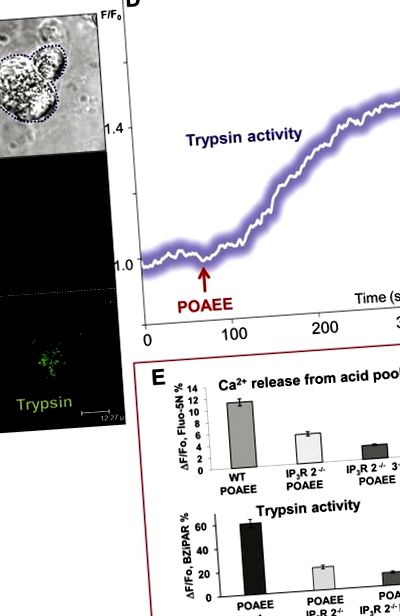
Nivelul activității tripsinei este corelat cu gradul de eliberare de Ca 2+ din depozitele de acid din polul apical granular prin receptorii de inozitol trisfosfat (IP3) de tipurile 2 și 3.A) Imagine de lumină transmisă care prezintă două celule acinare. Celula stângă a fost permeabilizată cu doi fotoni. (B) și (C) Imagini de fluorescență care arată (în C) localizarea inițială a activității tripsinei după stimularea cu POAEE (sonda BZiPAR devine fluorescentă atunci când tripsina scindează cele două lanțuri laterale oligopeptidice). (B) Înainte și (C) după începerea stimulării cu POAEE (100 μM). (D) Evoluția în timp a creșterii activității intracelulare a tripsinei după începerea stimulării cu 100 μM POAEE. (E) Rezultatele din experimentele în care eliberarea de Ca 2+ din polul granular acid al celulelor permeabilizate și activarea tripsinei la șoareci de tip sălbatic (WT) au fost comparate cu rezultatele de la șoareci la care receptorii IP3 de tip 2 au fost șterse (IP3R 2 -/- ) și de la șoareci la care ambii receptori IP3 de tip 2 și 3 au fost șterse (IP3R 2 -/- 3 -/-). Adaptat după Gerasimenko și colab., 2009 [13].
Pentru a rezuma, deși alcoolul (etanolul) în sine are în mare parte doar efecte acute minore asupra celulelor acinare pancreatice, există o minoritate de celule care produc semnale mari de Ca 2+ susținute atunci când sunt expuse la etanol [6]. Date recente arată că, deși etanolul are capacitatea de a provoca eliberarea unor cantități substanțiale de Ca 2+ din depozitele intracelulare, celulele intacte normale au un mecanism de protecție încorporat, discutat mai jos [16] (Figura 2).
(A) Urme tipice din două experimente în care modificările în stocul [Ca 2+] au fost evaluate după stimularea cu etanol. În absența CaM, 10 mM etanol (EtOH) evocă o scădere clară a depozitului [Ca 2+], în timp ce această concentrație de etanol nu reușește să producă nici o eliberare atunci când CaM (2,5 μM) este adăugat la soluția externă în contact direct cu soluție intracelulară prin porul generat de permeabilizarea cu doi fotoni). O concentrație mult mai mare de etanol (100 mM) poate evoca în continuare eliberarea de Ca 2+. (B) CaM inhibă activarea tripsinei indusă de etanol într-un mod foarte similar cu efectul său protector împotriva eliberării intracelulare de Ca 2+. În plus, cea mai mică urmă demonstrează că peptida asemănătoare cu Ca2+ CALP-3 - în prezența CaM - elimină efectul activator al tripsinei chiar și a unei concentrații foarte mari de etanol (100 mM). Adaptat din Gerasimenko și colab., 2011 [16].
Activarea proteinei omniprezente care leagă calciul calmodulina protejează împotriva eliberării intracelulare de Ca 2+ indusă de alcool și activarea tripsinei
Înțelegerile recente au arătat cum ar putea fi prevenită eliberarea de Ca 2+ indusă de alcool. S-a constatat că, atunci când calmodulina proteică care leagă Ca 2+ este spălată din celule, alcoolul însuși are un efect toxic puternic și acut asupra celulelor acinare. Readmiterea calmodulinei (la o concentrație intracelulară normală) are un efect protector. Este deosebit de interesant faptul că datele recente arată că un activator peptidic mic permeabil la membrană al calmodulinei (peptida asemănătoare Ca 2+ cunoscută sub numele de CALP-3), atunci când este adăugat în exteriorul celulelor izolate, previne acțiunile toxice concentrațiile de alcool [16] (Figura 2), deoarece acest lucru sugerează că poate avea ca agent terapeutic potențialul de a reduce daunele pancreatice induse de alcool.
Căile morții celulare
Pancreatita se caracterizează prin moartea celulară, dar prognosticul depinde în mare măsură de procesul de moarte celulară [17,18]. Apoptoza este mecanismul „fiziologic” al morții celulare și apare fără a pierde integritatea membranei plasmatice, în timp ce necroza are ca rezultat pierderea constituenților celulelor în lichidul interstițial, favorizând inflamația. Apoptoza necesită energie sub formă de ATP, deci dacă funcția mitocondrială este afectată semnificativ de depolarizarea completă a membranei mitocondriale interioare, singurul mecanism de moarte celulară disponibil este necroza (Figura 3).
Săgețile din partea de jos a figurii etichetate + ATP și –ATP indică faptul că echilibrul dintre apoptoză și necroză este într-o oarecare măsură dictat de prezența sau absența ATP. Δψm, diferența de potențial electric între membrana mitocondrială interioară; CCK, colecistochinina; ER, reticul endoplasmatic; FAEE, ester etilic al acidului gras; ROS, specii reactive de oxigen, ZG, granule de zimogen. Adaptat după Criddle et al., 2007 [17].
Posibile căi terapeutice
Concluzii
În concluzie, principalele puncte care au ieșit din progresele recente în domeniu sunt că: (a) încărcarea excesivă de Ca 2+ citosolică inițiază activarea proteazei intracelulare care duce la pancreatită acută; (b) intrarea excesivă de Ca 2+ în citosol se datorează în principal și în principal eliberării de Ca 2+ din depozitele de acid Ca 2+ din partea granulară a celulelor acinare mediate prin receptorii IP3 de tipul 2 și 3; (c) o proteină intracelulară care leagă Ca 2+, calmodulina, exercită un efect protector împotriva pancreatitei asociate alcoolului prin reducerea probabilității de deschidere a canalelor receptorului IP3; și (d) activarea calmodulinei de către o peptidă Ca-2+ permeabilă la membrană stimulează efectul protector al calmodulinei împotriva activării proteazei intracelulare indusă de alcool. Sperăm că, înțelegând mai multe despre etiologia acestei boli, vom ajunge mai aproape de a oferi metode preventive și terapeutice mai bune pentru ameliorarea suferinței celor afectați de această afecțiune.
Mulțumiri
Lucrările experimentale din laboratorul autorilor au fost susținute de un Program Grant de la The Medical Research Council (UK). OHP este profesor al Consiliului de cercetare medicală.
- South Bend IN Medici gastroenterologi - Pancreatită acută și cronică Simptome, tratament, cauze
- Obezitatea este un factor de risc pentru pancreatita acută biliară și alcoolică severă - PubMed
- Obezitatea este un factor de risc pentru boala acută de munte, un studiu prospectiv pe calea ferată din Tibet
- Pancreatita necrotizantă Radiologie Articolul de referință
- Ficatul gras acut postpartum al sarcinii un raport de caz Journal of Medical Case Reports Text integral