Departamentul de Medicină, Divizia de Geriatrie și Științe Nutritive și Centrul de Nutriție Umană, Universitatea Washington, Școala de Medicină, St Louis, Missouri, SUA
Departamentul de Pediatrie, Divizia de Gastroenterologie Pediatrică, Universitatea Washington, Facultatea de Medicină, St Louis, Missouri, SUA
Departamentul de Medicină, Divizia de Geriatrie și Științe Nutritive și Centrul de Nutriție Umană, Universitatea Washington, Școala de Medicină, St Louis, Missouri, SUA
Departamentul de Pediatrie, Divizia de Gastroenterologie Pediatrică, Universitatea Washington, Facultatea de Medicină, St Louis, Missouri, SUA
Departamentul de Medicină, Divizia de Geriatrie și Științe Nutritive și Centrul de Nutriție Umană, Universitatea Washington, Școala de Medicină, St Louis, Missouri, SUA
Departamentul de Medicină, Divizia de Geriatrie și Științe Nutritive și Centrul de Nutriție Umană, Universitatea Washington, Școala de Medicină, St Louis, Missouri, SUA
Departamentul de Nutriție și Dietetică, Universitatea Harokopio, Atena, Grecia
Departamentul de Medicină, Divizia de Geriatrie și Științe Nutritive și Centrul de Nutriție Umană, Universitatea Washington, Școala de Medicină, St Louis, Missouri, SUA
Departamentul de Medicină, Divizia de Geriatrie și Științe Nutritive și Centrul de Nutriție Umană, Universitatea Washington, Școala de Medicină, St Louis, Missouri, SUA
Departamentul de Medicină, Divizia de Geriatrie și Științe Nutritive și Centrul de Nutriție Umană, Universitatea Washington, Școala de Medicină, St Louis, Missouri, SUA
Departamentul de Pediatrie, Divizia de Gastroenterologie Pediatrică, Universitatea Washington, Facultatea de Medicină, St Louis, Missouri, SUA
Departamentul de Medicină, Divizia de Geriatrie și Științe Nutritive și Centrul de Nutriție Umană, Universitatea Washington, Școala de Medicină, St Louis, Missouri, SUA
Departamentul de Pediatrie, Divizia de Gastroenterologie Pediatrică, Universitatea Washington, Facultatea de Medicină, St Louis, Missouri, SUA
Departamentul de Medicină, Divizia de Geriatrie și Științe Nutritive și Centrul de Nutriție Umană, Universitatea Washington, Școala de Medicină, St Louis, Missouri, SUA
Departamentul de Medicină, Divizia de Geriatrie și Științe Nutritive și Centrul pentru Nutriție Umană, Universitatea Washington, Școala de Medicină, St Louis, Missouri, SUA
Departamentul de Nutriție și Dietetică, Universitatea Harokopio, Atena, Grecia
Departamentul de Medicină, Divizia de Geriatrie și Științe Nutritive și Centrul pentru Nutriție Umană, Universitatea Washington, Școala de Medicină, St Louis, Missouri, SUA
Departamentul de Medicină, Divizia de Geriatrie și Științe Nutritive și Centrul de Nutriție Umană, Universitatea Washington, Școala de Medicină, St Louis, Missouri, SUA
Abstract
Introducere
Rata de prevalență a obezității la copii s-a triplat în ultimii 30 de ani ((1)) și este probabil responsabilă pentru creșterea marcată a complicațiilor metabolice legate de obezitate observate la populația pediatrică, cum ar fi toleranța la glucoză orală afectată, diabetul de tip 2, și boli hepatice grase nealcoolice (NAFLD) (2), (3), (4), (5)). Adolescenții obezi sunt deosebit de predispuși la tulburări metabolice din cauza sensibilității scăzute la insulină care apare în timpul pubertății ((6), (7), (8)). Am descoperit recent că NAFLD este un marker important al rezistenței la insulină la adolescenții obezi și că copiii obezi cu NAFLD au o acțiune afectată a insulinei atât în ficat, cât și în mușchii scheletici, comparativ cu copiii obezi care sunt egalați în funcție de vârstă, sex, stadiu Tanner, IMC și procent de grăsime corporală (9).
La adulți, scăderea moderată în greutate scade conținutul de trigliceride intrahepatice (IHTG) și îmbunătățește acțiunea insulinei în ficat și mușchii scheletici ((10), (11), (12)). Pierderea în greutate îmbunătățește, de asemenea, măsurile surogate ale sensibilității la insulină a întregului corp, derivate din concentrațiile plasmatice de glucoză și insulină în plasă și testarea toleranței orale la glucoză, la adolescenții obezi (13), (14), (15), (16), (17), (18)). Cu toate acestea, aceste studii nu au furnizat informații cu privire la efectele pierderii în greutate asupra conținutului de IHTG și a acțiunii insulinei în organe specifice.
Scopul prezentului studiu a fost de a evalua efectul pierderii moderate în greutate asupra conținutului de IHTG, a cineticii bazale a glucozei și a sensibilității la insulină la nivelul mușchilor scheletici și al ficatului la adolescenții obezi. Spectroscopia de rezonanță magnetică a fost utilizată pentru a determina conținutul de IHTG și o perfuzie stabilă marcată izotopic în combinație cu tehnica clemei hiperinsulinemică-euglicemică a fost utilizată pentru a evalua cinetica substratului bazal și acțiunea insulinei în ficat și mușchiul scheletic înainte și după pierderea în greutate.
Metode și proceduri
Subiecte de studiu
Subiecții au fost recrutați din ambulatoriile Spitalului de Copii St Louis, din cabinetele locale de pediatrie și din baza noastră de date actuală de voluntari eligibili. Opt adolescenți obezi (IMC ≥95 percentilă pentru vârstă și sex; 15,3 ± 0,6 ani; stadiul Tanner 4,4 ± 0,3; 7 băieți, 1 fată; 6 albi și 2 afro-americani) au participat la acest studiu. Acești subiecți reprezintă un subset de subiecți ale căror date metabolice inițiale au fost raportate anterior ca parte a unui alt studiu (9).
Toți subiecții au fost supuși unei evaluări medicale, care a inclus un istoric și un examen fizic, test de toleranță orală la glucoză de 2 ore și teste de sânge. Au fost excluși subiecții care au afectat concentrația de glucoză în repaus alimentar, diabet, hipertrigliceridemie severă (> 300 mg/dl) sau antecedente de boli hepatice, altele decât NAFLD. Niciunul dintre subiecți nu a consumat alcool, a fumat produse din tutun sau a luat medicamente despre care se știe că provoacă steatoză hepatică sau că afectează metabolismul glucozei sau al lipidelor.
Studiul a fost aprobat de Oficiul pentru Protecția Cercetării Umane și Comitetul consultativ al Centrului General de Cercetare Clinică al Școlii de Medicină a Universității Washington din St Louis, MO. Toți subiecții au fost de acord să participe la studiu după ce li s-a oferit o explicație detaliată studiului lor și părinților lor. Consimțământul informat scris a fost obținut de la părinții fiecărui subiect și acordul informat scris a fost obținut de la fiecare subiect înainte de înscrierea în studiu.
Evaluări ale compoziției corpului
Masa totală de grăsime corporală și masa fără grăsimi (FFM) au fost determinate utilizând absorptiometria cu raze X cu energie duală (densitometrul Delphi W echipat cu software-ul versiunii 12.4; Hologic, Waltham, MA) (19)). Volumele totale de grăsime abdominală, subcutanată și intraabdominală au fost determinate utilizând imagistica prin rezonanță magnetică cu un scaner de 1,5 T (Siemens, Iselin, NJ). Opt imagini axiale cu grosimea de 10 mm au fost obținute începând de la interspațiul L4 - L5 și analizate pentru conținutul de grăsime subcutanată și intraabdominală utilizând software-ul Analyze 6.0 (Fundația Mayo, Biomedical Imaging Resource, Rochester, MN); volumul de grăsime a fost calculat pentru fiecare felie și s-au adăugat valorile. Conținutul IHTG a fost determinat utilizând spectroscopia de rezonanță magnetică a protonului cu un scaner de 1,5 T (MAGNETOM Sonata; Siemens, Erlangen, Germania) (20)).
Hiperinsulinemic - clemă euglicemică
Program de slăbire
Subiecții au primit sesiuni individuale de terapie comportamentală cu un psiholog care are o experiență considerabilă în terapia obezității pentru adolescenți. Principiile programului de modificare a comportamentului au fost adaptate din programul de slăbire a obiceiurilor sănătoase dezvoltat pentru această grupă de vârstă pentru a stabili obiective comportamentale pentru reducerea aportului de calorii și creșterea treptată a activității fizice ((24)). Părinții au participat la sesiunea inițială, iar implicarea lor continuă a fost flexibilă în funcție de vârsta adolescentului, preferințele familiei și la discreția psihologului. Adolescenții au fost încurajați să se auto-monitorizeze și să țină evidența consumului de alimente și băuturi și a activității fizice; li s - au furnizat formulare de auto - monitorizare și o copie a Contorul de calorii pentru grăsimi și carbohidrați Calorie King® ((25)) pentru a ajuta la estimarea aportului de calorii și grăsimi. La fiecare întâlnire, adolescenții au fost cântăriți și a fost abordată legătura dintre schimbarea lor de greutate și comportamentele de echilibru energetic. Adolescenții au fost încurajați să-și reducă treptat aportul caloric la 2001-200-1 500 kcal/zi. Recomandările dietetice specifice au fost individualizate, pe baza modelului alimentar al adolescentului și a preferințelor alimentare.
Când subiecții au pierdut cel puțin 5% din greutatea corporală și au fost greutăți stabile timp de cel puțin 4 săptămâni, s-au repetat analizele compoziției corporale și procedura de clamp hiperinsulinemic - euglicemiant efectuată înainte de terapia de slăbire.
Analize de probă
Concentrația de glucoză plasmatică a fost determinată utilizând un analizor automat de glucoză (YSI 2300 STAT Plus, Yellow Springs Instruments, Yellow Springs, OH). Concentrația de insulină plasmatică a fost măsurată prin radioimunotest (Linco Research, St Louis, MO). Concentrațiile de acid gras fără plasmă (FFA) au fost cuantificate utilizând cromatografia gazoasă (HP 5890 Seria II GC; Hewlett-Packard, Palo Alto, CA) după adăugarea acidului heptadecanoic în plasmă ca standard intern (26).
TTR de glucoză plasmatică a fost determinat folosind cromatografie cu gaz de ionizare cu impact electronic - spectrometrie de masă (Agilent Technologies/Sistemul GC seria HP 6890 - Detector selectiv de masă 5973; Hewlett-Packard) așa cum s-a descris anterior ((27)). După formarea derivatului heptafluorobutiril al glucozei, glucoza plasmatică TTR a fost determinată prin monitorizarea selectivă a ionilor la m/z 519 și 521.
Calcule
Stările de echilibru metabolice și izotopice au fost realizate în ultimele 30 de minute ale perioadei bazale (între 150 și 180 de minute) și procedura hiperinsulinemică - clemă euglicemică (între 330 și 360 de minute). Prin urmare, rata totală de apariție a glicemiei (endogenă și exogenă) (Ra) în plasmă în condițiile bazale și procedura hiperinsulinemică-clemă euglicemică a fost calculată prin împărțirea ratei de perfuzie a trasorului de glucoză la media TTR a glucozei plasmatice între 150 și 180 min și 330 și 360 min (clemă). Glucoza endogenă bazală Ra a fost calculată utilizând ecuația lui Steele pentru condiții de echilibru (28). S-a presupus că rata de dispariție a glucozei din plasmă a fost egală cu glucoza totală Ra în starea de echilibru.
Sensibilitatea la insulină hepatică a fost evaluată utilizând indicele de sensibilitate la insulină hepatică, care este inversul produsului ratei de producție bazală a glucozei hepatice (în olmol/kg FFM/min) și concentrația de insulină plasmatică în repaus alimentar (în mU/l) (29), (30)). Sensibilitatea la insulină a mușchilor scheletici a fost determinată ca creșterea ratei de dispariție a glucozei în timpul perfuziei de insulină (9).
analize statistice
Datele au fost testate pentru normalitate și pentru Student t‐Testul pentru eșantioane asociate (pentru variabilele distribuite în mod normal) sau testul semnat de Wilcoxon (pentru variabilele care nu sunt distribuite în mod normal) a fost utilizat pentru a evalua diferențele înainte și după pierderea în greutate. Relațiile dintre variabilele de interes au fost evaluate utilizând coeficienții de corelație Pearson (pentru variabilele distribuite în mod normal) sau Spearman (pentru variabilele care nu sunt distribuite în mod normal). O analiză a varianței cu măsuri repetate a fost utilizată pentru a evalua semnificația statistică a diferențelor în rata de dispariție a glucozei în condițiile bazale și perfuzia de insulină între cele două puncte de timp. Un cu două cozi P valoarea ≤0,05 a fost considerată semnificativă statistic. Analizele statistice au fost efectuate folosind SPSS (versiunea 13.0; SPSS, Chicago, IL). Toate datele sunt prezentate ca mijloace ± s.e.m.
Rezultate
Caracteristicile și compoziția corpului participanților la studiu
Subiecții au pierdut 8,2 ± 2,0% din greutatea corporală și 9,6 ± 1,6% din IMC în timpul programului de terapie pentru scăderea în greutate, ceea ce a dus la o scădere concomitentă a masei grase și a volumului de grăsime intraabdominală, dar nu s-au modificat semnificativ FFMtabelul 1). În plus, conținutul de IHTG a scăzut cu> 60% odată cu pierderea în greutate (P = 0,01). Scăderea conținutului IHTG s-a corelat direct cu conținutul IHTG inițial (r = 0,93, P 0,2). Scăderea conținutului de IHTG a dus la o rezoluție a steatozei (Tabelul 1. Compoziția corporală a participanților la studiu înainte și după pierderea în greutate
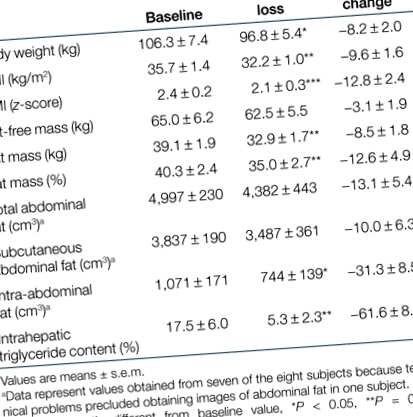 |
Variabile metabolice
Scăderea în greutate a scăzut concentrația plasmatică de insulină în repaus alimentar, dar nu a modificat semnificativ concentrațiile plasmatice de glucoză în plasmă sau FFA (masa 2). Pierderea în greutate a avut tendința de a îmbunătăți concentrațiile plasmatice de lipide și transaminaze, dar majoritatea acestor diferențe nu au fost semnificative statistic din cauza numărului mic de subiecți și a variabilității datelor (masa 2).
Cinetică la glucoză și sensibilitate la insulină
Pierderea în greutate a scăzut glicemia bazală totală Ra de la 937 ± 34 la 852 ± 49 µmol/min (P
Efectul pierderii în greutate asupra cineticii glucozei. (A) Rata de dispariție a glucozei (Rd) din plasmă în timpul condițiilor bazale și în timpul perfuziei de insulină (procedura hiperinsulinemică - clemă euglicemică) la adolescenții obezi înainte și după pierderea în greutate. (b) Sensibilitatea la insulină a mușchilor scheletici, determinată ca capacitatea perfuziei de insulină de a stimula glucoza Rd peste nivelurile bazale înainte și după pierderea în greutate. * Valoare semnificativ diferită de valoarea inițială, P
Indicele de sensibilitate la insulină hepatică la adolescenții obezi înainte și după pierderea în greutate. Valorile sunt mijloace ± s.e.m. * Valoare semnificativ diferită de valoarea inițială, P = 0,01.
Discuţie
Rezistența la insulină este o complicație obișnuită a obezității și un factor de risc important pentru diabet și alte complicații metabolice. În studiul de față, am constatat că pierderea moderată în greutate crește atât sensibilitatea la insulină a ficatului, cât și a mușchilor scheletici la adolescenții obezi. Subiecții noștri au avut toleranță orală normală la glucoză și concentrații plasmatice de glucoză în repaus alimentar. Prin urmare, îmbunătățirea sensibilității la insulină nu a fost detectabilă prin teste de sânge de rutină și a necesitat o evaluare sofisticată a acțiunii insulinei prin evaluarea cineticii glucozei în condițiile bazale și a hiperinsulinemiei induse experimental. Aceste rezultate demonstrează că pierderea moderată (~ 8%) în greutate are efecte metabolice benefice importante la adolescenții obezi care nu au dovezi evidente ale anomaliilor metabolice după evaluarea printr-un examen medical standard.
În studiul de față, am recrutat adolescenți obezi care aveau toleranță normală la glucoză și am folosit tehnica clemei hiperinsulinemică-euglicemică pentru a identifica modificările subtile ale acțiunii insulinei tisulare. Îmbunătățirea sensibilității la insulină observată după scăderea în greutate este în concordanță cu rezultatele studiilor anterioare efectuate la adulți obezi care au avut, de asemenea, toleranță normală la glucoză pe cale orală (11), (31), (32), (33), (34)). Un studiu anterior realizat la copii obezi prepubertali și peri - puberali a demonstrat că reducerea cu aproximativ 7% a greutății corporale, indusă de 14 zile de restricție severă a caloriilor, a crescut, de asemenea, eliminarea glucozei mediată de insulină (35). Mecanismele responsabile de îmbunătățirea sensibilității la insulină cauzate de scăderea în greutate nu sunt pe deplin clare. Acumularea IHTG este un factor determinant major al rezistenței la insulină a mușchilor hepatici și scheletici atât la adolescenți (9), cât și la adulți (23). Prin urmare, reducerea conținutului de IHTG după pierderea în greutate ar fi putut contribui la îmbunătățirea acțiunii insulinei la adolescenții noștri obezi.
În concluzie, rezultatele acestui studiu demonstrează că pierderea în greutate moderată indusă de dietă reduce conținutul de IHTG și îmbunătățește sensibilitatea la insulină atât la nivelul ficatului, cât și la nivelul mușchilor scheletici la adolescenții obezi. Mai mult, îmbunătățirea metabolismului glucozei mediat de insulină a avut loc chiar dacă subiecții au avut o toleranță normală la glucoză la momentul inițial.
Mulțumiri
Acest articol a fost susținut de numărul de subvenție UL1 RR024992 de la Centrul Național pentru Resurse de Cercetare (NCRR), o componentă a National Institutes of Health (NIH), National Institutes of Health granturi DK 37948, DK 56341 (Clinical Nutrition Research Unit), RR 00954 (Resursă de spectrometrie de masă biomedicală) și NIDDK 5 T32 DK077653 (Premiul Serviciului Național de Cercetare Ruth L. Kirschstein). Mulțumim personalului medical al Centrului pentru Științe de Cercetare Aplicată pentru ajutorul acordat în efectuarea studiilor: Bruce Patterson, Freida Custodio, Junyoung Kwon, Adewole Okunade și Gary Skolnick pentru asistența lor tehnică și subiecții studiului pentru participarea lor.
Dezvăluire
Autorii nu au declarat niciun conflict de interese.
- Rolul genelor implicate în lipoliză în programul de slăbire la persoanele supraponderale și obeze
- Femeia spune că excesul de piele din cauza pierderii în greutate este mai rău decât a fi obez - Slăbirea excesivă a pielii
- Pierderea în greutate a apei pentru un ficat sănătos - Amsety
- Pierderea în greutate și densitatea minerală osoasă la adulții obezi o analiză longitudinală a influenței
- Ce este mai rău Să fii obez SAU să ai atât de multă piele desprinsă după pierderea lor în greutate (supraponderal,
