Bine ați venit la Prism Online
O nouă disciplină inginerească se așteaptă înainte la fabricarea de organe personalizate pentru testare sau înlocuire.
Kaiming Ye, profesor de bioinginerie la Universitatea Binghamton, are o viziune asupra viitorului asistenței medicale: un pacient merge la medicul său plângându-se de dureri în piept și este diagnosticat cu boli cardiace grave. Unele dintre celulele sale sunt colectate, probabil dintr-o biopsie sau o probă de sânge. Celulele sunt procesate și devin materialul de bază pentru a crea o inimă nouă, sănătoasă - posibil realizată cu un prototip rapid sau cu o imprimantă 3D - care este unic pentru el. Curând după aceea - poate chiar mai târziu în aceeași zi - noua inimă este gata să fie implantată în corpul pacientului, înlocuind vechiul său ticker deteriorat. Prevedeți că procese similare sunt utilizate pentru a înlocui multe alte țesuturi și organe umane deteriorate sau bolnave. Într-adevăr, orice tehnologie care poate produce un mușchi la fel de complex ca o inimă ar putea produce cu ușurință organe mai simple, cum ar fi ficatul și rinichii.
Piesele de schimb personalizate pentru oameni rupți pot suna ca ficțiunea științifică, dar Ye este convins că o astfel de revoluție medicală este relativ aproape - cu condiția să se poată dezvolta o bază industrială care să o susțină. „Această industrie nu există încă; există doar o colecție de laboratoare individuale ”, spune el. De aceea, de câțiva ani încoace, el face parte dintr-un număr de academicieni care au activat într-un efort condus de Fundația Națională pentru Științe (NSF) pentru a crea atât o disciplină de inginerie, cât și o industrie: biofabricarea avansată. Scopul este de a oferi baza de fabricație nu numai pentru ingineria țesuturilor - construirea de țesuturi și organe umane întregi pentru screening-ul medicamentelor și, în cele din urmă, pentru transplanturi - ci și pentru domeniul în creștere rapidă a terapiilor bazate pe celule și personalizate, sau medicina regenerativă, care folosesc celule, fie ca imunizări, fie ca parte a plasturilor și implanturilor, pentru a vindeca o serie de afecțiuni.
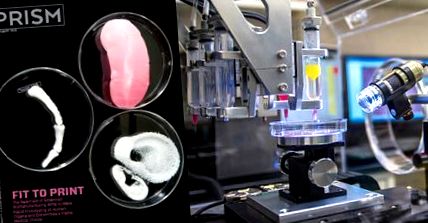
Istoria ingineriei țesuturilor și a medicinei celulare este relativ scurtă. A fost un domeniu definit abia de la mijlocul anilor 1980, iar versiunile moderne de astăzi au început la sfârșitul anilor '90, cu dezvoltarea tehnologiilor de celule stem, în special invenția unui proces de reprogramare a celulelor adulte mature înapoi în celule stem sau celule stem pluripotente., care poate fi coaxial pentru a crește orice tip de țesut. Un succes timpuriu a avut loc în 1999. Atunci, Anthony Atala, directorul Wake Forest Institute for Regenerative Medicine, a folosit cu succes schelele acoperite cu celule stem pentru a crea vezici artificiale pentru șapte copii care suferă de bifida coloanei vertebrale. Mai recent, în 2013, chirurgii au transplantat cu succes o trahee bioinginerată într-o fetiță de 2 ani, deși copilul a murit ulterior din cauza altor complicații.
Propulsat de noile tehnologii - în primul rând imprimarea 3D - câmpul s-a transformat în overdrive. O lucrare importantă de acum doi ani, scrisă de o echipă condusă de Wendell Lim, profesor de farmacologie celulară și moleculară la Universitatea din California, San Francisco, susținea că „astăzi, biomedicina se află pe vârful unei noi revoluții: utilizarea a celulelor microbiene și umane ca motoare terapeutice versatile ”, care ar deveni un nou„ al treilea pilon ”al medicinei dominat acum de produsele farmaceutice și biologice cu molecule mici, cum ar fi hormonii recombinați și medicamentele pe bază de anticorpi. Dar această revoluție naștere, a adăugat, "va necesita dezvoltarea unei științe fundamentale de inginerie celulară care oferă un cadru sistemic pentru modificarea și reglarea în siguranță și previzibilă a comportamentelor celulare." Și aici se îndreaptă „către biofabricarea avansată”, spune Athanassios Sambanis, director de program al Diviziei NSF pentru Chimie, Bioinginerie, Mediu și Sisteme de Transport.
Procese de standardizare
Este necesară o nouă disciplină „pentru a identifica provocările critice și barierele care trebuie depășite pentru a avansa pe teren” și pentru a educa inginerii și oamenii de știință care l-ar conduce, explică Sambanis, care este, de asemenea, profesor de chimie și biomoleculară. inginerie la Georgia Tech. În esență, NSF își orientează influența și abilitățile de finanțare pentru a crea și numi o nouă disciplină de inginerie axată pe laser pe medicina regenerativă. Noțiunea câștigă laude din partea cercetătorilor în medicina regenerativă. „Cu siguranță este nevoie de standardizarea proceselor pentru terapiile de medicină regenerativă elaborate cu țesuturi, pentru a reduce costurile și pentru a face procesele de fabricație mai economice, eficiente și durabile”, spune Atala, al cărui institut a inițiat un program de cercetare cu o inginerie industrială a participat la unul dintre atelierele avansate de biofabricare ale NSF.
Când NSF a sponsorizat un atelier din iulie 2013 privind biofabricarea avansată, definiția de lucru a fost mai largă și cuprinde tehnologii de biofabricare mai tradiționale, cum ar fi ingineria bacteriilor pentru a produce produse farmaceutice, combustibili și materiale noi. NSF a început în mod intenționat cu o definiție mai incluzivă pentru a se asigura că nu au fost trecute cu vederea zone importante, spune Sambanis. De atunci, NSF a sponsorizat 15 sau mai multe ateliere și a evoluat o definiție mai îngustă și mai precisă, care se concentrează în totalitate pe medicina regenerativă. „Vrem să distingem acest lucru de industria bio tradițională”, explică Ye. „Aceasta nu este fermentarea medicamentelor; nu sunt bioreactoare. "
În afara NSF, ceea ce se numește biofabricare avansată rămâne destul de largă și elastică, iar acest lucru poate fi confuz. De exemplu, Universitatea din Sheffield din Marea Britanie se mândrește cu un centru avansat de biofabricare, dar cercetările sale sunt cuprinzătoare și includ domenii pe care NSF nu le aparține disciplinei - procesele biologice de producere a substanțelor chimice, a energiei și a produselor alimentare, de exemplu. „La nivel global, până în prezent, nu există un acord cu privire la ceea ce este biofabricarea avansată”, spune Alexander Leonessa, profesor asociat de inginerie mecanică la Virginia Tech, care conduce programul NSF General and Age-Related Disability Engineering. Numele „nu surprinde de fapt munca reală implicată”, spune el. Unii implicați se gândesc acum să găsească un nou nume.
Țesuturi crescute la comandă
Voi credeți că organele construite de la zero ar putea fi ușor disponibile în termen de cinci până la zece ani, cel puțin cele mai elementare, cum ar fi pancreasele și ficatul. Inimile sunt foarte complexe, desigur, iar cele artificiale cultivate în laborator sunt probabil la câteva decenii distanță. Există cel puțin trei metode diferite pentru a construi organe din celule vii. Cea care primește cea mai mare atenție este imprimarea 3D, care folosește o cerneală biologică bogată în celule, sau hidrogel, pentru a construi un organ un strat ultra-subțire la un moment dat, bazat pe modele tridimensionale computerizate complexe care includ sisteme vasculare. Există, de asemenea, metoda originală de a construi organe cu celule pe schele, așa cum Atala și-a modelat vezicele. Schelele sale biodegradabile au fost formate din colagen sau dintr-un compozit de colagen și acid poliglicolic. O a treia metodă, utilizată în principal în Japonia, este o construcție bidimensională care își dezvoltă, de asemenea, propria matrice și se autoasamblează într-un organ tridimensional.
O altă tehnologie posibilă este așa-numitul organ pe un cip, un microcip pe care sunt încorporate și celule cablate sacrificate de la un pacient pentru a determina modul în care un medicament ar afecta în mod unic unul dintre organele sale. Deja există companii care lucrează pentru comercializarea acestui tip de tehnologie. "Este un mare avans, dar este limitat", spune Sambanis. Deși poate determina impactul unui medicament asupra unuia sau poate asupra a două organe, nu poate reproduce modul în care ar putea afecta întregul corp al pacientului. Pentru a evita acest lucru, spune Ye, cercetătorii lucrează pentru a compartimenta întregul corp uman în module individuale, „ca un individ care funcționează” și pentru a plasa și conecta toate aceste module pe un singur cip. NSF speră să programeze în curând un atelier de lucru pentru a încerca să vadă dacă se poate ajunge la un consens între anchetatori cu privire la criteriile pentru a judeca în cele din urmă care metodă funcționează cel mai bine.
Potențial de reducere a costurilor
În timp ce în cele din urmă cercetătorii se așteaptă ca organele create de om să fie utilizate pentru transplanturi, cel mai probabil vor fi utilizate mai întâi pentru screeningul medicamentelor, evitând nevoia unor teste pe animale și pe oameni. Acest lucru ar reduce costurile de dezvoltare. Într-adevăr, costul ridicat actual al aducerii pe piață a unor noi terapii este una dintre atracțiile medicinei celulare. Modul în care reacționează pacienții la medicamentele cu molecule mici și biologice este greu de prezis, motiv pentru care aceste medicamente durează, în medie, 14 ani pentru a se dezvolta și au o rată de eșec mai mare de 95%. Comercializarea cu succes a unei noi terapii medicamentoase poate costa aproximativ 2 miliarde de dolari. După cum a remarcat studiul UCSF, terapiile celulare sunt extrem de complexe, dar această complexitate „ar putea de fapt face ca acești agenți să fie mai previzibili în clinică decât molecule mici sau biologici” și, prin urmare, mai ieftin de dezvoltat.
Deocamdată, ingineria țesuturilor și terapiile celulare sunt extrem de costisitoare. Cu toate acestea, unele companii folosesc deja celulele imune ale pacienților pentru a trata cancerul. „Există avantaje”, spune Sambanis, în principal că, spre deosebire de chimioterapie, nu există efecte secundare dure. Dar până acum aceste terapii, pe lângă faptul că sunt foarte scumpe, nu au performanțe spectaculoase mai bune decât alte medicamente. Asta pentru că felul în care sunt fabricate acum este ineficient, spune Ye. În prezent, totul se face manual, astfel încât rezultatele depind de cine colectează celulele și cine le modifică. „Aveți nevoie de mai mult control al calității”, insistă el. Scopul este de a concepe sisteme automatizate standardizate care se bazează pe bune practici de fabricație pentru recoltarea și manipularea celulelor înainte de a fi injectate, încorporate pe plasturi sau implanturi sau crescute într-un organ întreg, transplantabil. „Trebuie să creștem eficiența proceselor”, afirmă Bettinger.
O altă problemă este cum să mărești medicamentul personalizat. Dacă vorbiți despre transplantul de inimi, de exemplu, fiecare persoană are nevoie doar de una, dar poate fi un milion de oameni care au nevoie. Deci, acesta este un milion de inimi, toate unice. Și spre deosebire de producția tradițională, care se bazează pe tipuri și cantități uniforme de materii prime, fiecare terapie personalizată va avea nevoie de materii prime diferite. Și totuși rezultatele finale trebuie să aibă o oarecare unitate - fiecare inimă poate fi o construcție singulară, dar trebuie să funcționeze ca o inimă. Nu va fi ușor să îndeplinești aceste sarcini, avertizează David Williams, profesor și director de afaceri internaționale la Wake Forest Institute. Williams - care este, de asemenea, președinte al Societății Internaționale de Inginerie a Țesuturilor și Medicină Regenerativă (TERMIS) - a co-autorizat anul trecut o lucrare în Science Translational Medicine, care sublinia dificultățile în încercarea de a standardiza și automatiza procesele de fabricație care produc tratamente specifice pacienților.
De asemenea, industriile au nevoie de lanțuri de aprovizionare. Pentru aceasta, furnizorii cheie ar furniza elementele de bază ale biologiei sintetice, care sunt adesea numite biobricks. Aceste blocuri de secvențe de ADN sunt plasate în celule vii - cele umane, dar adesea celulele bacteriei E. coli - ca LEGO, ca să le reconecteze pentru a induce o funcție care nu există în mod natural, să zicem, poate oprind supraproducția unei proteine care provoacă o boală. „Este construirea unui întreg sistem, de la nivelul celular”, explică Leonessa.
De asemenea, important pentru biofabricarea avansată, dar care nu face parte din aceasta, vor fi tehnologii de monitorizare și imagistică mai eficiente, care vor permite mai bine medicilor să vadă cum funcționează transplanturile. Dispozitivele neinvazive care monitorizează crearea de țesut sau organe noi trebuie, de asemenea, inventate. Dacă preparați un medicament nou într-un bioreactor, este posibil să scoateți o probă mică pentru testare. „Dar dacă crești o inimă din celule stem, dacă scoți o celulă, oprești procesul”, explică Ye.
Indiferent cum s-ar numi, disciplina în plină dezvoltare ar putea aduce o creștere a finanțării pentru cercetarea de inginerie a țesuturilor. „Crearea noii discipline va ajuta cu siguranță să solicite și să promoveze mai multe finanțări pentru cercetarea în acest domeniu”, prezice Ye. Deocamdată, însă, unii avocați spun că finanțarea a fost prea mică. În decembrie 2013, Fundația Methuselah din Virginia a lansat un Premiu New Liver Liver de 1 milion de dolari, un concurs de cinci ani pentru a avansa ingineria țesuturilor și medicina regenerativă și pentru a susține mai multe finanțări. Grupul deplânge faptul că finanțarea pentru domeniu se ridică la mai puțin de 500 de milioane de dolari pe an în Statele Unite, o sumă nesemnificativă în comparație cu ceea ce cheltuiesc împreună NSF și Institutele Naționale de Sănătate pentru cancer și HIV/SIDA. Într-un e-mail către Prism ca răspuns la acea critică, NSF a subliniat că „a jucat un rol important de câteva decenii în apariția ingineriei țesuturilor ca domeniu”, adăugând: „NSF continuă să vadă biofabricarea avansată ca o zonă critică” și „O zonă importantă de investiții”.
Deși nu există până acum nicio estimare a cât de mare ar putea fi construită o industrie internă sau globală în jurul producției avansate de biofabricare, angajații NSF spun că industria ar putea da un impuls economic semnificativ economiei Americii. Recent, un grup de susținători au călătorit în Europa și Asia pentru a evalua starea globală a cercetării avansate în biofabricare. „Ei [cercetătorii europeni și asiatici] investesc puternic în acest domeniu”, spune Sambanis. Ei cred că acesta este viitorul, nu numai pentru tratarea pacienților, ci și pentru o oportunitate economică. De exemplu, o lucrare recentă a cercetătorilor portughezi a subliniat progresele realizate în tehnicile de biofabricare pentru regenerarea și repararea pielii deteriorate și provocările care rămân; Cercetătorii de la Universitatea din Edinburgh vor începe în curând studii clinice pe o terapie celulară pentru a stimula celulele stem hepatice să formeze țesuturi noi, sănătoase și să repare daunele cauzate de ciroză; și cercetătorii de la Universitatea suedeză din Göteborg fac eforturi de pionierat în bioinginerii uterelor pentru tratarea femeilor sterile.
Orice disciplină capabilă să revizuiască modul în care sunt oferite asistența medicală va fi, fără îndoială, uriașă. Și, spune Leonessa, marile companii farmaceutice acordă atenție și mulți consideră că este necesar să se implice. Big pharma produce și câștigă miliarde de dolari dintr-o varietate de medicamente, inclusiv din cele care, să zicem, tratează diabetul. Dar dacă inginerii produc în cele din urmă pancreasuri noi, transplantabile din celulele stem, cererea de insulină va dispărea. „Va revoluționa ceea ce fac [marea farmaceutică] sau îi va scoate de pe piață”, spune Leonessa.
O stigmă și cuvinte de precauție
Susținătorii avansați ai biofabricării sunt de acord cu toții că un obiectiv cheie este să se asigure că o nouă generație de ingineri și oameni de știință este educată pentru a satisface nevoile disciplinei. Dar există încă dezbateri cu privire la dacă ar trebui să existe programe de diplomă în disciplină. „Cred că se va întâmpla”, spune Leonessa, poate inițial ca minoră, avansând la un certificat și, în cele din urmă, extinzându-se într-o diplomă de absolvire înainte de a deveni o diplomă de licență. Williams spune că aplaudă efortul de a spori educația pentru disciplină, adăugând că „la acest lucru lucrez în cadrul TERMIS”. Însă Bettinger își face griji că stigmatul producției ar putea fi descurajant pentru unii studenți. "Sună ca o guler albastru, dar nu este deloc așa." Leonessa este de acord: „Fabricarea este un cuvânt mare cu o mulțime de bagaje atașate la el”.
Există, desigur, cuvinte de precauție. Williams a organizat o conferință despre medicina regenerativă la Xi’an, China, care a evidențiat unele dintre barierele rămase. Acestea includ dificultăți în dezvoltarea unei abordări de inginerie a sistemelor pentru a integra toate noile tehnologii cu dezvoltare rapidă utilizate în biofabricarea avansată, cum ar fi știința celulelor stem, tehnicile de biofabricare și imagistica țesutului regenerat; lipsa unor standarde acceptate la nivel internațional pentru testarea țesutului prelucrat; atitudinile conservatoare ale multor agenții de reglementare; costuri ridicate și finanțare insuficientă; și preocupări etice. Într-adevăr, compania de consultanță tehnologică Gartner Inc. a avertizat în 2013 că tehnologia bioimprimării organelor avansează atât de repede încât va declanșa o dezbatere etică majoră imediat ce anul viitor. „Capacitatea de a imprima organe și țesuturi umane va avansa mult mai repede decât înțelegerea generală și acceptarea ramificațiilor acestei tehnologii”, a spus Pete Basiliere, directorul de cercetare al Gartner. Va exista îngrijorări dacă celulele neumane sunt utilizate în organe și îngrijorări cu privire la calitatea și tehnicile de producție, a spus el.
De aceea, este important să se dezvolte de urgență o bază industrială pentru biofabricare avansată, plină de control al calității, spune Ye. Buna practică de fabricație va ajuta să convingă autoritățile de reglementare - și publicul - că tratamentele pe bază de celule sunt sigure și previzibile, susține el. De asemenea, sunteți încrezători că atracția tehnologiilor care pot vindeca afecțiunile și nu doar să le trateze se va dovedi irezistibilă. Din punct de vedere al marketingului, acesta este punctul de vânzare unic al biofabricării avansate - și este unul puternic.
De Thomas K. Grose
Thomas K. Grose este corespondentul principal al Prism, cu sediul în Regatul Unit.
Proiectat de Nicola Nittoli
Imagini prin amabilitatea Institutului Wake Forest pentru Medicină Regenerativă
- Cum se stabilește un deficit caloric pentru pierderea de grăsime; Performanță umană completă
- Câți carbohidrați să completeze glicogenul după ridicare; Performanță umană completă
- Poate fi denumită ca rețea umană
- Cum este fabricat aspiratorul - fabricare, fabricare, istorie, uzat, piese, mașină, istorie, brut
- Restricția calorică pe termen lung îmbunătățește procesele celulare de control al calității la nivelul mușchilor scheletici umani