Provocările cistinuriei în secolul al XXI-lea - o mini recenzie
Louise F. Øbro 1, Katja V. Pedersen 2, Søren K. Lildal 1, Susanne S. Osther 1, Helene U. Jung 1, Kim H. Andreassen 1 și Palle J. S. Osther 1, *
1 Departamentul de Urologie, Centrul de Cercetări Urologice, Spitalul Lillebaelt, Universitatea din sudul Danemarcei, Fredericia, Danemarca
2 Departamentul de genetică clinică, Spitalul Lillebaelt, Universitatea din sudul Danemarcei, Vejle, Danemarca
Abstract:
Cistinuria este o afecțiune genetică rară cauzată de mutații ale genelor care codifică cele două subunități de transport ale aminoacizilor, rezultând în eșecul absorbției aminoacizilor dibazici filtrați, inclusiv cistina din tubii proximali. În ciuda noilor cunoștințe despre baza moleculară a cistinuriei, aceasta continuă să fie una dintre cele mai provocatoare boli de piatră. Nu există tratament curativ al cistinuriei, iar pacienții vor avea risc pe tot parcursul vieții de formare a calculilor, intervenții chirurgicale repetate, afectarea funcției renale și a calității vieții. Managementul cistinuriei necesită o abordare multimodală în centre dedicate pentru a îmbunătăți rezultatul tratamentului și conformarea pacientului. Evoluțiile recente în inhibitorii creșterii cristalelor de cistină pot promite o prevenire mai eficientă a pietrei în viitor.
Introducere
Cistinuria este o afecțiune genetică rară care continuă să fie una dintre cele mai provocatoare boli ale pietrelor la rinichi. Este cauzată de mutații ale genelor care codifică cele două subunități de transport ale aminoacizilor, ducând la eșecul absorbției aminoacizilor dibazici filtrați, incluzând cistina din tubulii 1 proximali. Deoarece cistina are o solubilitate foarte limitată în domeniul fiziologic al pH-ului urinei, aceasta duce la formarea de pietre la rinichi complicată și recurentă, care prezintă un risc mai mare de boli cronice la rinichi decât cea mai frecventă boală a pietrei la rinichi cu oxalat de calciu. Cistinuria reprezintă aproximativ 1% din adulți și 3-10% din boala de piatră pediatrică 1,2. Prevalența mondială a cistinuriei este de aproximativ 1 din 7000 de nou-născuți, variind de la aproximativ 1: 2000 la Coasta Mediterană de Est până la 1: 100000 în Suedia 2.3 .
Baza genetică a cistinuriei
Modelul de moștenire a cistinuriei este complex. În mod tradițional, cistinuria a fost clasificată în trei subtipuri diferite. Mai târziu, această clasificare a fost criticată și o nouă clasificare bazată pe genele afectate SLC3A1 și SLC7A9 a fost făcută de Della Strologo și colab. 4 .
Cistinuria de tip A este cauzată de mutații ale genei SLC3A1 localizate pe cromozomul 2. Gena SLC3A1 codifică subunitatea grea a transportorului de aminoacizi renali (rBAT), care este necesară pentru a localiza transportorul către membrana plasmatică 5. Modul de moștenire pare a fi cu adevărat autosomal recesiv, iar penetrarea este mare 6. O persoană afectată are două copii defecte ale genei și fiecare dintre părinți poartă un exemplar. Purtătorii au de obicei niveluri normale de urină cistină și nu prezintă un risc crescut de a dezvolta urolitiază în comparație cu populația generală 5 .
Cistinuria de tip B este cauzată de mutații ale genei SLC7A9 localizate pe cromozomul 19. Gena SLC7A9 codifică subunitatea ușoară a transportorului de aminoacizi renali, care compromite componenta catalitică, de transport 5. Modul de moștenire pare a fi autosomal recesiv sau autosomal dominant cu penetranță incompletă 7. Pentru homozigoti penetrarea este similară cu tipul A 6 .
Purtătorii precum părinții, frații și copiii au adesea niveluri ridicate de cistină în urină, iar formarea de pietre este raportată în 2-18% din cazuri 4.6. În cazuri mai rare, pacientul prezintă mutații în ambele gene (SLC3A1 + SLC7A9). Acest subgrup este clasificat ca cistinurie de tip AB. Se raportează că frecvența este de 1,2% - 4% 4,8,9. Astăzi 160 de mutații diferite în gena SLC3A1 și 116 în gena SLC7A9 sunt listate în baza de date a mutației genomului uman 10 .
Până în prezent nu s-au găsit diferențe clinice (vârsta de prezentare, numărul de episoade de calculi, intervenții) între tipul A și tipul B 4,9,11. Implicațiile complete ale stării de tip A, B sau AB nu sunt încă pe deplin înțelese, deși au fost sugerate implicații pentru prognostic, management și tratament.
Diagnostic
Diagnosticul se bazează pe istoricul medical, analiza calculilor, investigațiile de laborator și imagistica. Cistinuria trebuie suspectată întotdeauna în cazul debutului timpuriu al pietrelor la rinichi (12. Microscopia urinei care dezvăluie cristale hexagonale sunt patognomonice 2.13. Testul colorimetric cu cianură-nitroprusidă detectează cistina în urină la o concentrație prag de 75 mg/l. O analiză cromatografică cantitativă a o probă de urină de 24 de ore confirmă diagnosticul. Rata normală de excreție a cistinei este de aproximativ 0,10 mmol/zi; cistinuricul homozigot excretă de obicei mai mult de 1,7 mmol/zi.
Imagistica
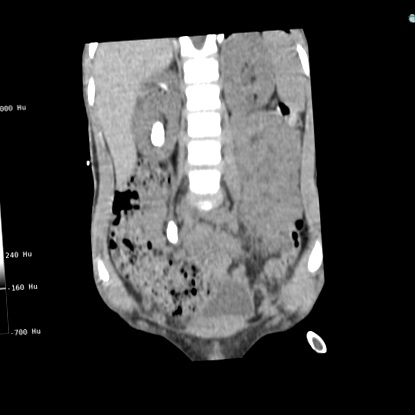
Pietrele cu cistină sunt radiopace slabe pe radiografiile simple. Valoarea de atenuare (unitatea Hounsfield, HU) a pietrelor de cistină pe tomografie computerizată (CT) variază 14. Un HU scăzut poate susține suspiciunea de pietre de cistină, dar există suprapuneri semnificative între pietre de diferite compoziții, în special pentru pietre de cistină și acid uric, ceea ce face o diferențiere definitivă provocatoare 15-17. CT cu energie dublă și procesarea automată a imaginilor pot îmbunătăți diferențierea 18,19. CT poate fi, de asemenea, util în prezicerea fragilității pietrei prin evaluarea morfologiei pietrei, pietrele neomogene cu regiuni goale fiind mai fragile 20-22 (Figura 1). Ecografia renală este mai puțin precisă, dar reprezintă baza pentru urmărirea formatorilor de cistină pentru a evita expunerea frecventă la radiații.
Figura 1: CT cu doze mici, fără contrast (vedere coronală) la un băiat de 6 ani cu cistinurie care prezintă o piatră renală mare și o piatră ureterică foarte mare pe partea dreaptă. Pietrele sunt omogene cu o unitate Hounsfield de 900, ceea ce le-a făcut nepotrivite pentru litotrizia cu unde de șoc. Pietrele au fost tratate utilizând o abordare chirurgicală percutanată. Pacienții cistinurici prezintă deseori o boală bilaterală cu sarcină mare ca pietre staghorn sau pietre mari rotunjite ca în acest caz. Băiatul a rămas liber de piatră pe o combinație de hidratare și terapie cu citrat de potasiu.
Management chirurgical
În ciuda terapiei medicale agresive, este probabil ca pacienții cistinurici să sufere episoade recurente frecvente de calculi care necesită intervenție urologică 13. Pacienții cistinurici vor avea adesea proceduri invazive anterioare, solicitând utilizarea celor mai puțin invazive metode pentru a minimiza complicațiile și morbiditățile mai multor proceduri 11. Pe de altă parte, deoarece fragmentele reziduale după tratamentul cu pietre la pacienții cu cistinurice, mai devreme sau mai târziu, vor avea ca rezultat o boală simptomatică a pietrei, clearance-ul complet al pietrei este de cea mai mare importanță. Astfel, provocarea chirurgicală în cistinurie este de a găsi echilibrul între siguranța procedurilor și necesitatea unui clearance complet al pietrei 23 .
Prevenirea pietrei
Principiul principal al tratamentului constă în diluarea urinară, alcalinizarea urinară și reducerea cistinei la metabolitul său mai solubil, cisteina, utilizând agenți de legare a tiolului 28,29 .
Nu există studii prospective controlate care să folosească formarea calculilor ca obiectiv pentru orice terapie pentru cistinurie. Cu toate acestea, studiile care utilizează criteriile finale ale excreției de cistină și studiile de trecere a pietrei folosind pacienții ca propriile controale istorice oferă date rezonabile pe baza cărora se pot baza alegeri terapeutice.
Măsuri dietetice
Diluție urinară: Creșterea debitului de urină va reduce concentrația de cistină, scăzând astfel nivelul de saturație a cistinei în urină. Nivelul de flux de urină necesar depinde de excreția de cistină a pacientului, dar majoritatea pacienților adulți trebuie să producă cel puțin 3,5 litri de urină pe zi pentru a preveni formarea de pietre. De obicei, se recomandă ca pacientul să se trezească cel puțin o dată pe noapte pentru a anula și a bea apă suplimentară 28.29 .
Sodiu: În mai multe studii s-a demonstrat că încărcarea cu sodiu crește excreția urinară de cistină și că restricția de sodiu este anticistinurică 30-32. Pacienții cistinurici trebuie sfătuiți să reducă aportul de sodiu (27. Aportul alimentar de sodiu poate fi evaluat prin excreția de sodiu în urină.
Proteină: În mod potențial, restricția proteinelor ar trebui să fie atractivă la pacienții cistinurici, pentru a reduce aportul de aminoacizi metionină care conține sulf, din care este derivat sulf pentru formarea cistinei. Un singur studiu a explorat efectul cantitativ al restricției de proteine asupra excreției de cistină 33. În acest studiu, o dietă săracă în proteine a redus excreția de cistină cu 20%, comparativ cu o dietă bogată în proteine. O reducere a acestei magnitudini pare a fi foarte modestă în lumina potențialelor probleme de malnutriție pe care o dietă săracă în proteine le-ar putea induce la această populație. Pe de altă parte, pare recomandabil să se mențină un aport normal de proteine și să se evite lăcomia proteinelor, deoarece acest lucru va reduce în plus încărcătura cu acid din dietă, crescând astfel pH-ul urinei și solubilitatea cistinei cu 34,35. Conținutul de proteine din dietă nu trebuie să depășească 0,8 g/kg greutate corporală/zi.
Tratamentul farmacologic
Alcalinizarea urinară: Solubilitatea cistinei crește odată cu creșterea pH-ului, cu toate acestea, solubilitatea nu crește semnificativ până când nu se atinge un nivel de pH în urină peste 7-7,5. Pentru a atinge acest obiectiv este nevoie de doze semnificative și frecvente de alcali, pe care majoritatea pacienților le este dificil de respectat 30. Mai mult, doza optimă de alcali este dificil de estimat la un anumit pacient, deoarece s-a demonstrat că solubilitatea cistinei variază considerabil între indivizi 36. Diluarea urinei în sine duce la o creștere a pH-ului, iar combinația dintre diluția urinei și terapia alcalină este primul pas fundamental în gestionarea cistinuriei. Mai mult, creșterea pH-ului urinei crește eficacitatea solubilizantă a cistinei medicamentelor tiolice (vezi mai jos) 37. Alcalinul de potasiu pare a fi de preferat, deoarece alcalinul de sodiu va crește excreția de cistină și calciu, aceasta din urmă crescând potențial riscul cristalizării fosfatului de calciu într-o urină alcalină 28, 29, 35. Controlul pH-ului urinei monitorizat de pacient este important pentru terapia alcalinizării cu succes.
Figura 2: Algoritm pentru prevenirea calculilor la pacienții cistinurici
Conducta de tratament cu cistinurie
În ciuda opțiunilor de tratament menționate mai sus, o proporție semnificativă de pacienți prezintă o boală severă recidivantă de piatră renală și noi opțiuni de tratament preventiv mai eficiente sunt extrem de justificate. Recent, aplicarea microscopiei cu forță atomică la cistinurie a identificat dimetilesterul L-cistină (CDME) ca un impostor molecular eficient al L-cistinei, capabil să inhibe creșterea cristalelor in vitro 47. Potențialul CDME a fost evidențiat în continuare prin demonstrarea capacității sale de a inhiba creșterea cristalelor de cistină in vivo utilizând un model 48 de murin. Dezvoltarea ulterioară a diamidelor de L-cistină mai eficientă decât CDME în ceea ce privește menținerea concentrațiilor mai mari de L-cistină în soluția 49, care echivalează cu inhibarea creșterii cristalelor, ar putea reprezenta o descoperire mult așteptată în gestionarea cistinuriei. Viitoarele studii clinice vor confirma, sperăm, aceste rezultate promițătoare.
Urmărirea și conformarea pacientului
Urmărirea atentă a pacienților este importantă pentru identificarea recidivelor de piatră și monitorizarea efectelor secundare ale terapiei farmacologice. Pietrele cu cistină la începutul unei recurențe tind să fie eterogene, evidențiind importanța urmăririi regulate (la fiecare 3-6 luni), pentru a oferi pacienților opțiunile de tratament cel mai puțin invazive.
Eșecul terapiei farmacologice poate contribui, în mare măsură, la probleme de conformitate. S-a demonstrat că necesitatea intervenției urologice pentru calculii recidivali a scăzut odată cu respectarea medicală și că introducerea unei clinici dedicate cistinuriei a redus la jumătate rata de intervenție 50. Centralizarea managementului pacienților cu cistinurie la centrele dedicate, prin urmare, poate fi un pas la fel de important spre o mai bună gestionare a acestui grup complicat de pacienți cu piatră. Un algoritm pentru managementul medical al cistinuriei este prezentat în Figura 2.
Concluzie
Evaluarea și tratarea cistinuriei continuă să reprezinte o provocare majoră. Farmacoterapia acestei boli grave a pietrei nu s-a îmbunătățit în decenii în ciuda noilor cunoștințe cu privire la baza molecular-genetică a bolii, cu toate acestea, studii recente care implică inhibarea creșterii cistinei prin mimică moleculară, pot introduce o paradigmă complet nouă pentru prevenirea eficientă a pietrei în cistinurie. Pacienții cistinurici trebuie gestionați în centre dedicate care oferă modalități minime de tratament invaziv, permițând un tratament personalizat și sporind complianța pacientului.
- Revizuirea imparțială a alimentelor pentru pisici Purina One 2020 - Noi; Re All About Cats
- Ce au mâncat texanii în revista Houstonia din secolul al XIX-lea
- Acești călugări din secolul al XVII-lea au făcut o bere de post pentru Postul Mare
- Revizuirea cărții de corp de 4 ore (Pro; Contra) - BuiltLean
- The Diet Diet - Diet Review