Putem modifica compozițiile macronutrienților din dietă și ameliora boala mitocondrială?
TOALETA. Aw, N. A. Youngson și J. W. O. Ballard
Școala de biotehnologie și științe biomoleculare, Universitatea din New South Wales, Sydney, Australia
Abstract
Mitocondriile sunt un regulator important al fitnessului organismului și organul cheie de conversie a energiei. Fluxul de energie din eucariote implică conversia macronutrienților pentru a forma substraturi care conduc respirația mitocondrială. Modificarea raportului relativ al macronutrienților din dietă poate influența flexibilitatea metabolică și poate modifica producția de metaboliți mitocondriali, cum ar fi speciile reactive de oxigen (ROS), care pot influența funcțiile mitocondriale și pot afecta sănătatea organismului. În această revizuire, descriem diferențele în producția mitocondrială datorită compoziției macronutrienților dietetici la indivizii cu mutații complexe I. Mutațiile non-sinonime în subunitățile complexului mitocondrial I sunt o cauză comună a bolilor mitocondriale cu debut precoce. Discutăm despre posibilitatea manipulării raporturilor de macronutrienți ca tratament pentru unele cazuri de disfuncție mitocondrială ușoară.
Introducere
Influența dietei asupra funcțiilor mitocondriale a fost o întrebare de lungă durată în știința biomedicală. Descoperirea interacțiunilor dintre dietă și mitocondrii poate duce la un mecanism tractabil pentru îmbunătățirea sănătății umane și ar putea oferi o perspectivă asupra fiziopatologiei bolilor mitocondriale 1. Funcțiile mitocondriale sunt determinate de o strânsă coordonare între ADNmt, ADN nuclear și starea metabolică a celulelor, care este puternic influențată de dietă. Din punct de vedere mecanic, dieta poate afecta funcțiile mitocondriale ale diferitelor haplotipuri mitocondriale 2,3. Astfel, sugerăm că va fi necesar să se asocieze funcția mitocondriilor cu dieta pentru a oferi o înțelegere mai robustă a mutațiilor specifice ale genelor mitocondriale.
Subunitățile lanțului de transport al electronilor funcționează pentru a transforma energia conținută în nutrienți în legăturile energetice ridicate ale ATP prin fosforilare oxidativă (OXPHOS). Energia și substraturile care antrenează respirația mitocondrială pot fi obținute fie din glicoliza glucozei, beta-oxidarea acizilor grași, fie din oxidarea aminoacizilor 4,5. Produsele finale ale respirației mitocondriale diferă între aceste surse de substrat și aceste diferențe pot exacerba sau ameliora boala mitocondrială. În această revizuire, evaluăm potențialul ca diferite compoziții dietetice de macronutrienți să fie utilizate pentru tratarea pacienților cu mutații în complexul mitocondrial I.
Macronutrienții influențează flexibilitatea metabolică
Celulele trebuie să adapteze oxidarea combustibilului (oxidarea aminoacizilor, glicoliza și beta-oxidarea) la disponibilitatea combustibilului (carbohidrați, proteine și grăsimi) și aceasta este cunoscută sub numele de „flexibilitate metabolică” 6. Flexibilitatea metabolică este crucială pentru ca un organism să se adapteze la o varietate de condiții fiziologice, permițând organismelor să treacă de la un tip de combustibil la altul ca răspuns la modificările dietetice. Reglarea flexibilității metabolice este complexă și implică mecanisme compensatorii, inclusiv răspunsuri anterograde (controlul nuclear al funcțiilor mitocondriale) și retrograde (modificări nucleare ca răspuns la semnalizarea mitocondrială) 7-9. Este posibil ca flexibilitatea metabolică să fie în primul rând substrat, așa cum este descris de ciclul Randle. Ciclul Randle este un mecanism biochimic care reglează fin echilibrul dintre glucoză și oxidarea acidului gras în țesutul muscular și adipos. Acest ciclu reglează selecția combustibilului și adaptează oferta și cererea substratului din țesutul 10 .
Recent s-au sugerat modificări ale compozițiilor macronutrienților din dietă pentru a modifica locația electronilor care intră în ETC și, eventual, pentru a influența metabolismul mitocondrial. De exemplu, electronii care intră prin Complexul I pot genera un total de 10 H +, dar numai șase H + pot fi generați când electronii ocolesc Complexul I și intră prin Complexul II 4 (datorită fie disponibilității nutrienților, compoziției dietei, fie complexului I mutaţie). Aceste diferențe în concentrația de protoni cauzate de diferite puncte de intrare vor influența gradientul electrochimic transmembranar și vor afecta în cele din urmă rata ATP produsă de Complexul V 2. În secțiunea următoare, vom discuta despre influențele macronutrienților asupra funcțiilor mitocondriale. Ca model, vom studia mutațiile complexului I pentru a facilita înțelegerea acestor interacțiuni ADN macronutrienți-mitocondriale.
Mutații complexe I.
Influența proteinelor dietetice asupra mutațiilor complexului I.
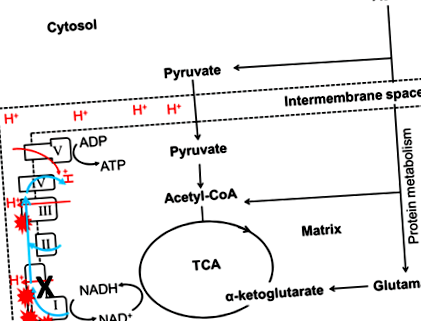
Până în prezent, doar câteva studii au investigat relația dintre macronutrienți și funcțiile mitocondriale. Un studiu asupra Drosophila a arătat că muștele hrănite cu un raport ridicat de proteine: carbohidrați (P: C) au fost asociate cu o activitate mai mare de citrat sintază, care este un biomarker al conținutului mitocondrial 3. În plus, aportul restricționat de aminoacizi esențiali metionină la șobolan s-a dovedit a se asocia cu o scădere a conținutului mitocondrial, urmată de o creștere a funcțiilor mitocondriale și scăderea stresului oxidativ 23-25. Într-adevăr, un aport crescut de metionină a dovedit, de asemenea, că crește producția mitocondrială de ROS și daunele oxidative ale ADN-ului mitocondrial în ficatul de șobolan [26]. Combinând aceste descoperiri, sugerează că aportul unei diete bogate în proteine sau a anumitor aminoacizi ar putea crește conținutul mitocondrial ROS și conținutul mitocondrial. Aminoacizii pot genera ATP doar într-o manieră mitocondrială dependentă. Astfel, mai multe ROS vor fi produse atunci când proteinele sunt utilizate ca principal combustibil pentru generarea de energie (Figura 1). Creșterile ROS duc la creșterea stresului oxidativ 27,28, despre care se crede că este un factor major la patogeneza degradării neuronale asociate bolii mitocondriale 13,29, a fertilității reduse 30 și a diabetului 31 .
Figura 1: Influența proteinelor dietetice asupra mutațiilor complexului I. I, II, III, IV și V au notat Complexul I, Complexul II, Complexul III, Complexul IV și respectiv Complexul V. Ciclul TCA generează substraturi (NADH) pentru OXPHOS și folosește acest substrat pentru a alimenta respirația mitocondrială. Complexele mitocondriale vor colecta electroni (linia albastră) din oxidarea substratului și vor transporta protonii (linia roșie) în spațiul intermembranar (linia punctată). Mutațiile MtDNA din Complexul I (cruce neagră) reduc eficiența transferului de electroni sau a transportului de protoni, ceea ce duce la o creștere a producției ROS (simbol exploziv roșu). În acest caz, aminoacizii pot genera ATP doar într-o manieră mitocondrială dependentă. Astfel, mai multe ROS vor fi produse atunci când proteinele sunt utilizate ca principal combustibil pentru generarea de energie.
Concentrația de oxigen celular poate influența, de asemenea, formarea ROS într-o manieră specifică mitotipului. De obicei, un conținut mai scăzut de oxigen generează mai puține ROS și un conținut mai mare, mai mult ROS 32-34. Cu toate acestea, există exemple în care formarea ROS este prevenită sau cel puțin scăzută prin creșterea consumului de oxigen pentru a scădea concentrația de oxigen celular 35-37. Probabil, mutațiile ADNmt care determină diferențe în funcțiile mitocondriale vor influența ratele consumului de oxigen 38, producția de ATP 39 și, prin urmare, formarea ROS 39,40. Lucrările suplimentare asupra acestor efecte de compunere vor fi importante dacă aceste interacțiuni vor fi pe deplin înțelese în sănătate și boală.
Pur și simplu creșterea cantității de mitocondrii într-o celulă pentru a compensa disfuncția nu este întotdeauna un răspuns eficient la mutațiile genelor mitocondriale. Pentru mitocondriile sănătoase, reglarea în sus a conținutului mitocondrial va provoca o cantitate mică de producție de ROS, care poate fi benefică pentru organism, deoarece sunt necesare niveluri scăzute de ROS pentru reglarea homeostaziei 41. Cu toate acestea, o creștere a conținutului mitocondrial ar putea avea un impact sever asupra organismelor care adăpostesc mutații ale ADNmt 28. De exemplu, sa demonstrat că substituția His182Tyr din proteina ND2 (parte a complexului I) din Drosophila crește producția mitocondrială de ROS și afectează producția de energie 3.17. Această mutație ND2 induce o creștere a numărului de copii mtDNA, dar cu compromisul duratei de viață reduse 16.17. Potențial, o reglare ascendentă a mitocondriilor nesănătoase va oferi un beneficiu pe termen scurt pentru organism, dar poate duce în cele din urmă la acumularea de daune ale radicalilor liberi în timp și la inducerea stresului citotoxic celular. În sprijinul acestui fapt, un studiu recent realizat pe viermi a arătat că disfuncția mitocondrială OXPHOS va duce la activarea răspunsului proteic mitocondrial desfășurat, propagarea ADNmt dăunător și a bolilor potențial mitocondriale 42 .
Influența carbohidraților dietetici asupra mutațiilor complexului I.
Studiile empirice au arătat că disfuncția în mitocondrii poate provoca trecerea de la respirația mitocondrială la glicoliză aerobă pentru a reduce stresul oxidativ 43-46, care ar putea fi considerat a fi un efect de tip Warburg 47. De fapt, această trecere de la respirația mitocondrială la glicoliză aerobă sa dovedit a fi cel puțin parțial mediată de complexul respirator I 48. S-a arătat că mutația greșită a proteinei ribozomale mitocondriale S12 (cine) care reduce activitatea complexelor I, III și IV modifică modelul expresiei genice în Drosophila 49-51. Proteina ribozomală mitocondrială S12 este codificată de gene nucleare și este responsabilă pentru sinteza proteinelor în cadrul mitocondriei. Analiza la nivelul transcriptomului la nivelul expresiei genetice arată că muștele mutante 25t care experimentează un comutator de metabolism pentru a compensa defectul OXPHOS. Mai exact, muștele mutante 25t experimentează o reglare ascendentă a lactatului dehidrogenază care a sugerat trecerea la glicoliză pentru producția de ATP 50. În prezent, nu se știe dacă acest comutator rezultă din disfuncție complexă I sau un răspuns retrograd mediat de ROS.
Aici, sugerăm că un potențial răspuns retrograd pentru stresul oxidativ este schimbarea producției de energie de la calea mitocondrială dependentă (mitocondrială OXPHOS) la calea independentă mitocondrială (glicoliză). Ipotezăm că acest răspuns poate fi inițiat numai în prezența carbohidraților, astfel, dietele cu conținut ridicat de carbohidrați ar trebui să ofere plasticitate mai mare și să aibă avantaje specifice pentru un organism care adăpostește mutații ADNmt sinonime în genele OXPHOS. Pe baza acestui fapt, prezicem că dietele bogate în zahăr ar putea ameliora fenotipul mutant cauzat de disfuncția mitocondrială. Dacă ipoteza este susținută, ar putea sugera o cale potențială pentru gestionarea macronutrienților pacienților cu un subgrup de boli mitocondriale. O problemă potențială cu această ipoteză este că ATP produs din glicoliză ar fi de aproximativ 20 de ori mai mic decât cel produs din OXPHOS. Cu toate acestea, o trecere a producției de energie de la OXPHOS mitocondrial la glicoliză poate duce, de asemenea, la acumularea de lipide care ar putea forța organismul să utilizeze lipidele ca sursă alternativă de combustibil 46 (Figura 2).
Figura 2: Influența carbohidraților asupra mutațiilor complexului I. Mutația în complexul mitocondrial I provoacă o deplasare a OXPHOS mitocondrial la glicoliză (săgeată verde). Prin urmare, se produc mai puține ROS și mai mult lactat. Conversia piruvatului în lactat va crește NAD + pentru continuarea procesului de glicoliză. O acumulare de lactat va duce în cele din urmă la încetarea glicolizei. Pentru a evita acest lucru, piruvatul va fi transformat în acetil-CoA pentru lipogeneză.
Influența grăsimilor asupra mutațiilor complexului I.
O recenzie recentă din Ballard și Youngson 2 a sugerat că modificările compozițiilor dietetice de macronutrienți ar putea modifica punctul de intrare al electronilor care intră în sistemul de transport al electronilor 40 și ar putea influența funcțiile mitocondriale. Este posibil ca grăsimile din dietă să crească rata de beta-oxidare și să modifice concentrația de FADH2 și NADH. De exemplu, metabolismul unei molecule de glucoză produce un raport NADH: FADH2 de 5: 1, în timp ce beta oxidarea cu acizi grași cu lanț lung produce un raport NADH: FADH2 de aproximativ 2: 1 52 .
În acest caz, o mutație ușor dăunătoare non-sinonimă în complexul mitocondrial I poate induce mai mulți echivalenți reducători sub formă de acil-CoA gras prin beta-oxidare a acidului gras și poate provoca o proporție mai mare de FADH2. Acești cofactori FADH2 reduși ar putea transporta ulterior o serie de electroni către ETC prin flavoproteină de transfer de electroni (ETF). ETF este o componentă a ETC care formează o comandă rapidă pentru transferul electronilor de la beta-oxidare la ETF-ubiquinonă oxidoreductază (ETF-QO) 53. Sistemele ETF-QO ar putea funcționa ca o cale scurtă de electroni pentru a ocoli complexul ușor dăunător I. Stând la baza acestei ipoteze sunt dovezi care arată că șoarecii knock-out subunitate 5 alfa subcomplex NADH-ubiquinonă oxidoreductază 1 (NDUFA5) au o creștere a ETF. Acest lucru sugerează că o creștere a transferului de electroni prin ETF către UQ poate fi inițiată ca un mecanism compensatoriu pentru a reduce stresul oxidativ generat de Complexul I 54 .
Care dieta este cea mai bună pentru bolile complexe I.?
Există o creștere la nivel mondial a prevalenței dietelor bogate în grăsimi și bogate în carbohidrați 55. Aceste diete produc niveluri ridicate de ROS, care contribuie major la dezvoltarea bolilor metabolice 56. Acest mediu de hiper nutriție poate exacerba fenotipurile pacienților cu boală complexă I, împingând potențial indivizii cu mutații „ușoare/subclinice” pentru a produce ROS la niveluri patogene. Propunem ca studiile raportate mai sus să susțină ideea că anumite diete sunt mai favorabile pacienților cu boală mitocondrială cu disfuncție complexă I (Tabelul 1).
| Dieta bogată în grăsimi (și dieta ketogenică) | Scăzut | Suficient | Scăzut |
| Dieta bogată în carbohidrați | Mare adică dăunătoare | Suficient | Înalt |
| Dieta bogată în carbohidrați cu trecerea la glicoliză, lipogeneză și beta-oxidare | Scăzut | Suficient | Scăzut |
| Dieta bogată în carbohidrați, cu doar glicoliză | Scăzut | Scăzut | Înalt |
| Dieta bogată în proteine | Mare adică dăunătoare | Suficient | Înalt |
| Dieta bogată în grăsimi și bogată în carbohidrați | Extrem de ridicat, adică dăunător | Suficient | Depinde de utilizarea relativă a oxidării beta, glicolizei și piruvatului în TCA pentru energie |
tabelul 1. Variația prezisă în produsele dietelor în disfuncția complexului I a
a Dietele care produc cantități reduse de ROS și ATP suficient cu un raport scăzut NADH: FADH2 sunt prezise benefice pentru persoanele cu disfuncție ușoară OXPHOS Complex I.
Dietele bogate în proteine sau dietele bogate în carbohidrați care produc cantități mari de NADH donator de Complex I sunt nefavorabile datorită tendinței lor de a produce cantități mari de ROS. Reducerea ROS și, prin urmare, reducerea stresului oxidativ ar putea fi realizată în două moduri. Fie prin reducerea respirației mitocondriale prin creșterea glicolizei, fie prin ocolirea complexului I prin creșterea cantității relative de acil-CoA gras derivat din beta-oxidare. Odată cu creșterea glicolizei, există un compromis între producția de ROS și producția de energie, astfel încât un metabolism dependent de glicoliză să nu producă suficientă energie pentru o sănătate bună. Cu toate acestea, trecerea la beta-oxidare într-o dietă bogată în grăsimi sau o dietă bogată în carbohidrați, care a crescut lipogeneza, poate permite o producție suficientă de energie, reducând în același timp producția de ROS.
Intervențiile dietetice sunt deja printre tratamentele testate în prezent la pacienții cu boli mitocondriale. Dietele ketogenice (bogate în grăsimi, proteine moderate și carbohidrați slabi) care favorizează respirația mitocondrială mai degrabă decât glicoliza pentru metabolismul energetic au fost testate ca terapii pentru mai multe boli, inclusiv cancerul, epilepsia și boala mitocondrială 57,58. În sprijinul utilizării dietelor ketogenice pentru pacienții cu mutații complexe I este faptul că dietele cresc beta-oxidarea (care va produce mai mult acil-CoA gras care ocolește complexul I prin sistemele ETF-QO) și reduce stresul oxidativ. Dietele cresc, de asemenea, biogeneza mitocondrială, care ar putea fi nefavorabilă dacă aceasta crește cantitatea de ADNmt care poartă mutații. Cu toate acestea, studiile pe linii celulare sugerează că dieta ar putea duce de fapt la schimbarea heteroplasmatică, ceea ce crește cantitatea relativă de ADNmt mutant 58,59 .
Interesant este că unele dintre tratamentele medicamentoase în curs de testare pentru pacienții cu disfuncție complexă mitocondrială I influențează aceleași procese ca și intervențiile dietetice (revizuite în Koopman și colab. 60). Medicamente precum curcumina, Idebenona și EPI-743 cresc nivelul de antioxidanți celulari pentru a reduce nivelul ROS. Idebenona livrează, de asemenea, electroni direct la complexul III, ocolind astfel un complex deficitar I. Suplimentarea coenzimei Q10/ubiquinonă a fost testată în primul rând pentru proprietățile sale antioxidante, dar poate crește și funcția sistemului ETF-QO pentru a permite ocolirea complexului I.
Există mai multe avertismente potențiale pentru potențialul terapeutic al dietelor bogate în grăsimi sau bogate în carbohidrați. În special riscul potențial de a genera obezitate în dietele cu conținut ridicat de energie. Mai mult, pentru a evalua potențialul dietelor propuse pentru tratarea pacienților cu boli mitocondriale complexe I, trebuie, de asemenea, să stabilim dacă creșterea lipogenezei și beta-oxidarea sunt metabolice favorabile în dietele bogate în carbohidrați. De asemenea, va trebui să stabilim dacă sistemul ETF-QO poate fi reglementat suficient pentru a satisface cerințele de energie. Trebuie făcută mai multă muncă în organismele model (de exemplu, Drosophila, șoareci) pentru a testa fezabilitatea acestor intervenții dietetice pentru bolile complexe I. Pentru a înțelege efectele dietelor asupra metabolismului energetic, măsurarea metaboliților, inclusiv ROS, ATP, lactat (ca marker pentru glicoliză), malonil-CoA (ca marker pentru lipogeneză), cetone (ca marker pentru derivate în grăsimi metabolismul energetic), iar raportul NADH: FADH2 (cu microscopie fluorescentă) 61 ar fi necesar. Potențial, metoda de măsurare a raportului NADH: FADH2 ar putea necesita o anumită dezvoltare tehnică în organismul viu.
Concluzii
Propunem ca bolile umane rare care sunt cauzate de mutații în complexul mitocondrial I să fie exacerbate de compoziția macronutrienților din dietă. Mai mult, dovezile actuale sugerează că dieta poate modula funcțiile mitocondriale și poate afecta sănătatea organismului. Dacă este adevărat, acest lucru implică posibilitatea manipulării raporturilor de macronutrienți ca tratament pentru unele boli asociate disfuncției mitocondriale.
- Modificări ale conținutului de grăsimi și carbohidrați din dietă modifică ceasul central și periferic la oameni -
- Descrierea fracțiilor de măcinare a semințelor de hrișcă, compoziția macronutrienților și fibra dietetică -
- Dieta cu 6 sfaturi o abordare dietetică simplificată la pacienții cu boală renală cronică
- Un studiu randomizat, de 6 săptămâni, cu o dietă scăzută FODMAP la pacienții cu boală inflamatorie intestinală -
- O revizuire a nutrienților dietetici (fito) pentru susținerea glutationului - PubMed