Abstract
SCOPUL REVIZUIRII
Obezitatea este o problemă majoră de sănătate la nivel mondial. Creșterea în greutate în exces este cea mai semnificativă, prevenită, cauză a creșterii tensiunii arteriale (TA) la pacienții cu hipertensiune arterială semnificativă și crește riscul de boli cardiovasculare și renale. Scopul nostru este de a revizui mecanismele care leagă obezitatea de hipertensiune, cu accent deosebit pe rolul leptinei și al sistemului melanocortin al creierului în stimularea activării simpatice în obezitate.
CONSTATĂRI RECENTE
În ciuda interesului crescut pentru obezitate ca risc major pentru apariția hipertensiunii, mecanismele precise care leagă creșterea în greutate în exces cu creșterea TA sunt încă evazive. Dovezile actuale sugerează că activitatea crescută a sistemului nervos simpatic (SNS) contribuie la alterarea naturii presiunii renale și a retenției de sodiu în obezitate. Descoperirile recente indică faptul că hormonul derivat din adipocite, leptina, activează centrele creierului care reglează activitatea SNS printr-o cale dependentă de sistemul melanocortinei. Interacțiunea dintre leptină și sistemul melanocortin din creier reprezintă un domeniu important de cercetare pentru a ne înțelege mai bine mecanismele care conduc la activarea simpatică în obezitate.
REZUMAT
Supraactivitatea simpatică este o legătură importantă între creșterea în greutate în exces și creșterea TA. Hormonii/citokinele secretate de țesutul adipos care interacționează cu căile neuronale (de exemplu, sistemul melanocortin) par să joace un rol cheie în contribuția la activarea simpatică în obezitate și reprezintă potențiale noi ținte pentru terapii.
INTRODUCERE
În ultimii 25-35 de ani am asistat la o creștere fără precedent a prevalenței obezității în țările în curs de dezvoltare, precum și în țările industrializate, unde se estimează că peste 1 miliard de persoane sunt obeze sau supraponderale [1]. In Statele Unite ale Americii. aproximativ 35,7% dintre adulți sunt obezi cu indicele de masă corporală (IMC) mai mare de 30 și mai mult de 2/3 din populație este supraponderal, reprezentând peste 150 miliarde dolari/an în costuri medicale. [2 **] Și mai alarmant este numărul crescând de copii și adolescenți supraponderali și obezi, care sa triplat din 1980; estimările recente indică faptul că 18,4% dintre copiii de 4 ani sunt obezi și se observă rate chiar mai mari de obezitate la copiii negri și nativi americani, precum și la copiii de origine hispanică [3].
Obezitatea deplasează distribuția TA către valori mai mari
A fi supraponderal sau obez crește semnificativ riscul de boli cardiovasculare prin mai multe mecanisme, inclusiv diabet, dislipidemie, ateroscleroză, boli renale și hipertensiune arterială [4, 5]. De exemplu, estimările de risc din studiile populației sugerează că creșterea excesivă în greutate poate contribui la 80% până la 90% din riscul de diabet și alte tulburări metabolice și până la 65% până la 75% din riscul de hipertensiune arterială esențială [4] . Deși prevalența hipertensiunii arteriale este mai mare la populațiile obeze decât la populațiile slabe, nu toți indivizii obezi, atunci când sunt evaluați prin criterii clinice standard, se dovedesc a fi hipertensivi. Cu toate acestea, creșterea în greutate în exces deplasează distribuția TA către valori mai mari. Astfel, subiecții obezi care nu sunt clasificați ca fiind hipertensivi ar avea TA mai mică la o greutate corporală mai mică [5, 6]. Acest concept este susținut de relația aproape liniară dintre indicele de masă corporală (IMC) și TA, de faptul că creșterea excesivă în greutate prezice dezvoltarea viitoare a hipertensiunii [7] și că pierderea în greutate ajută la prevenirea dezvoltării hipertensiunii și reduce TA în majoritatea indivizi hipertensivi [8].
Mecanisme de creștere a TA în obezitate: rol important al sistemului nervos simpatic (SNS)
În ciuda importanței constatate a obezității ca cauză majoră a hipertensiunii arteriale esențiale, mecanismele prin care creșterea în greutate în exces crește TA nu sunt pe deplin înțelese. Hipertensiunea arterială legată de obezitate este asociată cu retenția de sodiu și alterarea naturii presiunii renale (deplasarea spre dreapta a curbei presiune-natriureză către niveluri hipertensive) [7, 9]. Aceasta pare a fi mediată, cel puțin parțial, de activarea sistemului renină-angiotensină-aldosteron (RAAS), comprimarea fizică a rinichilor prin îngrășarea viscerală înconjurătoare și creșterea grăsimii sinusului renal și creșterea activității sistemului nervos simpatic (SNS) [ 7]. Deși acești 3 factori principali sunt strâns corelați și acționează împreună pentru a afecta natriureza de presiune renală și pentru a crește TA la persoanele obeze, în această revizuire ne vom concentra pe rolul activității SNS crescute.
Obezitatea este asociată cu activarea tisulară a sistemului nervos simpatic
Creșterea în greutate în exces, mai ales atunci când este însoțită de o adipozitate viscerală crescută, este asociată cu o activitate SNS crescută, care s-a dovedit că participă la dezvoltarea hipertensiunii arteriale la oamenii obezi, precum și la modelele animale de obezitate indusă de dietă [10, 11]. Creșterea activității SNS în obezitatea indusă de dietă pare să se dezvolte încă la o săptămână după expunerea la diete bogate în grăsimi [12] și chiar creșterea modestă în greutate la subiecții nonobezi este asociată cu o activitate SNS crescută [10 **]. Blocarea farmacologică cronică a receptorilor adrenergici determină, de asemenea, reduceri mai mari ale TA la obezi comparativ cu subiecții hipertensivi slabi [13]. Cu toate acestea, creșterea activității SNS în obezitate este modestă și apare doar în anumite organe și țesuturi în loc de activare simpatică generalizată a întregului corp. De exemplu, la subiecții obezi, activitatea SNS în mușchii scheletici și în rinichi este crescută, în timp ce activitatea simpatică cardiacă este minim crescută sau chiar redusă, datorită inhibării baroreflexului [14]. Mai mult decât atât, creșterea activității SNS renale care duce la retenția de sodiu și alterarea presiunii natriurezei este mecanismul principal pentru TA crescută cu exces de greutate, mai degrabă decât vasoconstricție periferică cauzată de activarea masivă pe scară largă a SNS [6].
Pe lângă faptul că este specifică țesutului, activitatea SNS crescută în obezitate pare să varieze și în funcție de etnie și distribuția grăsimii corporale, obezitatea viscerală provocând o activare SNS mai mare decât obezitatea subcutanată [6]. Motivele acestei asocieri mai puternice între obezitatea viscerală și activarea SNS în comparație cu obezitatea abdominală sau a corpului inferior nu au fost studiate pe scară largă, iar în majoritatea studiilor la om a fost evaluată activitatea SNS musculară mai degrabă decât activitatea SNS renală. Astfel, au fost necesare studii suplimentare pentru a examina influența distribuției grăsimii corporale și reglarea diferențiată a activității SNS și asocierea strânsă cu TA crescută în obezitate.
S-au propus mai mulți factori care contribuie la creșterea activității SNS în obezitate, incluzând afectarea sensibilității baroreflexului, angiotensinei II, hiperinsulinemiei, apneei de somn, hipogrelinemiei și hipoadiponectemiei. Rolul acestor factori în activarea SNS indusă de obezitate și hipertensiune arterială a fost revizuit anterior [15] și în această scurtă revizuire ne concentrăm în principal pe alți doi factori care par a fi actori cheie în legarea creșterii în greutate în exces cu activitatea SNS crescută: hiperleptinemie și 2) activarea neuronilor pro-opiomelanocortină cerebrală (POMC) și a receptorilor melanocortinei-4 (MC4R).
Leptina reglează homeostazia greutății corporale și crește activitatea SNS și TA
Obezitatea poate fi asociată cu rezistența „selectivă” la leptină
Reprezentarea schematică a efectelor cardiovasculare și metabolice ale axei leptină-MC4R în obezitate. SNS indică sistemul nervos simpatic; Na indică sodiu; POMC indică proopiomelanocortină; MC4R indică receptorul melanocortinei 4; SNC indică sistemul nervos central.
Activarea specifică a locului a LR și/sau activarea diferențială a evenimentelor de semnalizare intracelulară poate contribui la rezistența selectivă la leptină în obezitate (Figura 1)
LR-urile au o distribuție largă în tot creierul și majoritatea studiilor anterioare care vizează identificarea locurilor specifice responsabile de efectele leptinei asupra reglării apetitului, utilizând abordări genetice, au reușit aproape invariabil să recapituleze obezitatea observată la animalele cu ștergerea LR-ului întregului creier . Vong și colegii [22 *], cu toate acestea, au arătat recent că ștergerea LR-urilor în neuronii gabaergici recapitulează cea mai mare parte a fenotipului obez observat în deficitul de leptină, inclusiv obezitate severă cu debut precoce, hiperfagie, hiperglicemie și hiperinsulinemie; dar, din moment ce neuronii gabaergici sunt numeroși și distribuiți pe scară largă, este încă neclar ce tipuri neuronale sau situri cerebrale sunt cele mai importante în medierea efectelor leptinei asupra apetitului și a homeostaziei greutății corporale. În plus, nu se cunoaște dacă obezitatea observată la șoareci cu LR șterse în neuronii gabaergici este însoțită de creșteri ale TA.
Sistemul CNS Melanocortin mediază efectele leptinei asupra activității SNS și TA
MC4R nu este important doar pentru consumul de alimente și reglarea greutății corporale, ci poate fi o componentă cheie care leagă obezitatea și hiperleptinemia de activitatea SNS crescută și de hipertensiune. Șoarecii cu deficiență de MC4R obezi sunt normotensivi în comparație cu martorii slabi de tip sălbatic și sunt rezistenți la efectele presoare ale administrării cronice de leptină [28], iar activarea MC4R utilizând agoniști sintetici crește activitatea RSNA și TA [11]. Importanța sistemului melanocortinei creierului, în special a MC4R, pentru a contribui la creșterea indusă de obezitate a RSNA și BP este susținută și de studii la oameni cu mutații MC4R. Acești subiecți au redus excreția de norepinefrină 24 de ore, au redus TA diastolică și sistolică și au o prevalență mai mică a hipertensiunii decât persoanele obeze cu funcție normală de MC4R [29 **]. De asemenea, activarea farmacologică a MC4R la om ridică semnificativ TA, similar cu răspunsurile observate la rozătoare [29 **, 11]. Prin urmare, la om, precum și la rozătoare, stimularea cronică a MC4R crește TA și prezența unei căi funcționale POMC-MC4R pare a fi necesară pentru ca obezitatea și hiperleptinemia să crească activitatea SNS și TA.
Pe lângă medierea efectelor leptinei, activarea MC4R poate exercita un rol mai fundamental în modularea activității SNS ca răspuns la alți stimuli. De exemplu, antagonismul farmacologic al MC4R a redus semnificativ TA la șobolanii hipertensivi spontani (SHR) (un model experimental de hipertensiune cu activitate SNS crescută) în aceeași măsură realizată prin blocarea receptorilor adrenergici [30]. Efectele diferitelor alte peptide care induc activarea SNS și cresc BP sunt, de asemenea, prevenite de antagonismul MC4R [31, 32]. În plus, blocada MC4R a provocat o reducere mai mare a TA la obezii comparativ cu șobolanii slabi Zucker, demonstrând un rol pentru MC4R în reglarea activității SNS și TA chiar și la modelele care nu au acțiuni normale de leptină [33 *].
Factori ai obezității care pot exacerba acțiunile presoare ale axei Leptin-MC4R
În ciuda dovezilor clare că leptina și MC4R sunt importante pentru creșterea în greutate în exces pentru a crește RSNA și TA, creșterea TA observată în timpul administrării cronice de leptină sau agoniști MC4R este modestă. Un factor care poate compensa o parte din efectele hipertensive ale activării leptinei-MC4R este pierderea în greutate care apare adesea când se administrează leptină sau agoniști MC4R. O altă explicație potențială pentru efectele hipertensive modeste ale leptinei și agoniștilor MC4R la animalele slabe este că obezitatea poate fi asociată cu alți factori care sporesc acțiunile presoare cronice ale axei leptină-MC4R. Disfuncția endotelială, care se dezvoltă adesea în obezitate și poate duce la reducerea disponibilității oxidului nitric, mărește semnificativ impactul activării leptinei sau MC4R asupra TA. De exemplu, administrarea inhibitorului de oxid nitric sintază, L-NAME a amplificat semnificativ efectele hipertensive cronice ale leptinei, precum și ale unui agonist MC4R la șobolani [34, 35].
Într-un studiu recent, Hilzendeger și colab. a sugerat că leptina poate interacționa și cu RAAS creierului pentru a regla activitatea SNS și TA [36]. Obezitatea este, de asemenea, asociată cu niveluri reduse de factori despre care se crede că acționează în SNC pentru a reduce SNS și a reduce efectele presor ale activării leptinei și MC4R, inclusiv grelina și adiponectina [37]. Cu toate acestea, rolul hipogrelinemiei, hipoadiponectemiei și al creșterii nivelului de angiotensină II în obezitate, printre alți factori, contribuind la îmbunătățirea răspunsurilor cardiovasculare la activarea leptinei sau a MC4R, este, din cunoștințele noastre, nu a fost examinat și rămâne neclar.
CONCLUZII
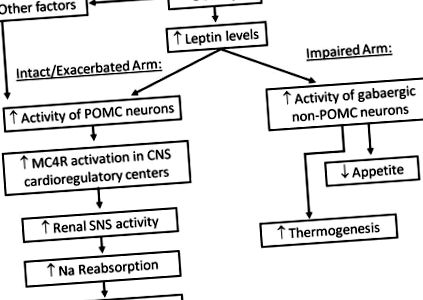
Obezitatea este o cauză majoră a hipertensiunii și a bolilor cardiovasculare la nivel mondial. Creșterea în greutate în exces este asociată cu activarea SNS care contribuie la retenția renală de sodiu și la alterarea presiunii natriurezei. Creșterea nivelului de leptină circulantă și activarea sistemului melanocortinei creierului, în special a MC4R, sunt factori cheie în legarea obezității, creșterea RSNA și creșterea TA ( Figura 2 ). Studii recente sugerează că axa leptină-MC4R exercită un control diferențial al apetitului, funcțiilor metabolice și cardiovasculare. Descoperirea acțiunilor specifice activării LR și MC4R a site-ului și a contribuțiilor diferitelor căi de semnalizare intracelulară activate de LR în controlul apetitului, funcțiilor metabolice și activitatea SNS este esențială pentru dezvoltarea unor medicamente anti-obezitate mai bune, cu o latură cardiovasculară și renală minimă. efecte.
Reprezentarea schematică a interacțiunii dintre obezitate, leptină și sistemul melanocortinei creierului. LR indică receptorul leptinei; MC4R indică receptorul melanocortinei 4; POMC indică proteina proopiomelanocortină; α-MSH indică hormonul stimulator al α-melanocitelor; AMPc indică adenozin monofosfat ciclic; TA indică tensiunea arterială; HR indică ritmul cardiac; PVN indică nucleul paraventricular al hipotalamusului; LH indică hipotalamus lateral; ARC indică nucleul arcuit al hipotalamusului; (±) indică stimulare sau atenuare. Notă: deși această reprezentare schematică evidențiază importanța neuronilor POMC localizați în ARC și proiectarea către neuronii care conțin MC4R în zona PVN și hipotalamică laterală, MC4R sunt exprimate în multe alte nuclee importante din hipotalamus și alte regiuni ale creierului, precum și în trunchiul cerebral unde s-au găsit și neuroni POMC. Cu toate acestea, rolul neuronilor POMC din trunchiul cerebral, precum și al neuronilor care conțin MC4R în această regiune în reglarea apetitului și a funcției cardiovasculare, sunt încă neclare.
PUNCTE CHEIE
Creșterea în greutate în exces este o cauză majoră de prevenire a hipertensiunii umane esențiale;
Supraactivitatea simpatică renală contribuie la retenția de sodiu și la creșterea TA la obezitate;
Hiperleptinemia și activarea sistemului melanocortin cerebral (MC4R) joacă un rol cheie în legarea obezității, activarea simpatică și TA crescută în obezitate;
CONFIRMARE
Cercetarea autorilor a fost susținută de un grant acordat de Institutul Național al Inimii, Plămânilor și Sângelui (P01 HL 51971) și de către Asociația Americană a Inimii Granturi pentru Dezvoltarea Cercetătorilor acordate lui Alexandre A. da Silva și Jussara M. do Carmo.
- Oxitocina poate juca un rol central în obezitate și sindromul metabolic HCPLive
- Factori de risc pentru obezitatea cancerului endometrial, hipertensiune și diabet
- Rolul histidinei dietetice în prevenirea obezității și a sindromului metabolic Inima deschisă
- Rolul volumetriei CT după intervenția chirurgicală de plicație gastrică în obezitatea morbidă Experiența inițială în
- Obezitatea Rolul cheie al unei proteine cerebrale a fost dezvăluit - Studiu la șoareci - Știri Neuroștiință