Subiecte
Abstract
Expunerea la unele medicamente antiretrovirale, în special la terapia combinată antiretrovirală (CART) bazată pe inhibitori ai transferului de catenă integrază (INsTI), a fost asociată cu creșterea în greutate a persoanelor care trăiesc cu HIV (PLWH) depășind ceea ce ar fi un fenomen de „revenire la sănătate”. Fără a aduce atingere faptului că creșterea în greutate și obezitatea sunt multifactoriale, legătura epidemiologică comună în PLWH este cartușul bazat pe INsTI. Aici, postulăm că interferența cu sistemul melanocortinei (MCS) care funcționează de către INsTI joacă un rol esențial în creșterea în greutate excesivă și obezitatea în PLWH, similar cu tulburările cauzate de mutațiile receptorului melanocortinei (MCR) în populația generală și de terapia antipsihotică în psihiatrie pacienți.
Regimurile antiretrovirale pe bază de INsTI sunt cele mai utilizate în țările cu venituri mari [1]. DTG va fi sau a fost deja încorporat în liniile directoare naționale de tratament din aproape 60 de țări cu venituri mici și medii, iar PEPFAR a recomandat introducerea TDF/3TC/DTG în țările sale de interes, care în 2021 vor fi luate de către
15 milioane PLWH [2]. În ultimul timp, utilizarea INsTI a fost asociată cu creșterea în greutate și obezitatea clinică. OMS definește obezitatea ca acumulare anormală sau excesivă de grăsime care prezintă un risc pentru sănătate și reprezintă în prezent o epidemie asociată cu scăderea speranței de viață [3]. Utilizarea pe scară largă a regimurilor bazate pe INsTI poate alimenta o epidemie de creștere în greutate și obezitate în PLWH, ducând la intersecția obezității și a poverilor HIV.
Integrează creșterea în greutate asociată cu inhibitorul transferului de catenă
Inițierea CART este de obicei asociată cu creșterea în greutate atribuită unui eveniment de „revenire la sănătate”. Începerea CART înainte de era INsTI a dus la creșterea greutății variind de la 1,8 la 2,7 kg într-un an și de 4,8 kg în 144 de săptămâni [4]. În general, creșterea în greutate asociată cu o mortalitate mai mică la pacienții cu greutate subponderală sau cu greutate normală, fără beneficii pentru pacienții supraponderali și obezi din cauza ratei crescute de diabet și boli cardiovasculare [5]. Studiile clinice pivot INSTI nu au raportat modificări ale greutății, dar substudiile de grăsime ale ACTG 5247 și NEAT 01 au indicat o creștere mai mare în greutate, mai ales în țesutul adipos visceral, în brațele RAL [6]. În două recențe deschise, ECA din Africa, regimurile bazate pe DTG asociate cu creșterea în greutate semnificativ mai mare și obezitatea clinică incidentă comparativ cu regimul bazat pe efavirenz [7, 8]. O analiză recentă combinată a opt RCT sponsorizate de Gilead a confirmat asocierea INsTI cu creștere în greutate mai mare decât PI sau NNRTI [9]. Trecerea de la regimul bazat pe PI la regimul bazat pe DTG a fost asociată cu o creștere în greutate semnificativ mai mare după 48 de săptămâni [9].
Dovezile din studiile observaționale și de cohortă s-au acumulat începând cu 2017, indicând expunerea la INsTI ca trăsătură comună [10]. În ultimul CROI (Seattle, martie 2019), o sesiune de discuții tematice a raportat dovezi ale creșterii în greutate excesive în PLWH, atât începând, cât și trecând la CART bazat pe INsTI [10]. A fost propusă o ierarhie de creștere în greutate legată de INsTI cu DTG și bictegravir (BIC) asociate cu cea mai mare creștere [9, 10]. Factorii asociați cu creșterea în greutate au fost coloana vertebrală NRTI, în principal atunci când au fost incluși TAF, sex (creștere mai mare la femei), etnie (creștere mai mare la negri) și numărul inițial de CD4 și încărcătura virală [9, 10]. Mai mult, expunerea la TAF la pacienții naivi și la trecerea de la TDF sau la abacavir la pacienții care trec de la NRTI sau TDF vechi asociate cu creșterea în greutate [9, 10].
Funcția sistemului melanocortinei: rol în creșterea în greutate și obezitate
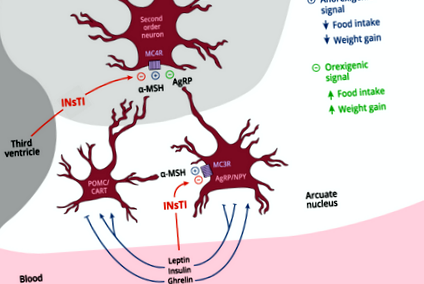
Sistemul POMC/MC4R este cel mai puternic mecanism de control fiziologic al comportamentului consumului de alimente și al echilibrului energetic metabolic la mamifere. Se știe că modificările funcționării acestui sistem cauzează obezitate. ARC din hipotalamus conține neuroni POMC/CART, care exprimă gena POMC și produc α-MSH, care vizează local MC4R și MC3R și provoacă un răspuns anorexigenic robust prin acțiuni inhibitoare asupra neuronilor NPY, de asemenea în ARC, care sunt orexigenici., și prin acțiuni asupra neuronilor de ordinul doi (Fig. 1). Inhibarea naturală a MC4R prin AgRP crește aportul de alimente și favorizează depunerea grăsimilor. În schimb, stimularea MC4R de către α-MSH reduce consumul de alimente și promovează cheltuielile de energie periferice, favorizând împreună un bilanț energetic negativ general [11]. Semnalele externe, leptina și insulina suprimă consumul de alimente și activează sinteza α-MSH pentru a viza MC4R, în timp ce postul duce la inhibarea semnalizării α-MSH/MC4R, provocând senzația de foame (Fig. 1).
Alpha-MSH, eliberat de neuronii hipotalamici POMC/CART, vizează receptorii MC4R către neuronii de ordinul doi, provocând astfel un răspuns anorexigenic. α-MSH acționează și asupra receptorilor MC3R la neuronii hipotalamici AgRP/NPY. Acest lucru duce la inhibarea eliberării neuropeptidelor orexigenice NPY și AgRP, acesta din urmă capabil să provoace orexigeneză prin interferența semnalizării MC4R la neuronii de ordinul doi. Insulina și leptina inhibă neuronii AgRP/NPY și activează neuronii POMC/CART, în timp ce grelina are efecte reciproce. INsTI poate interveni potențial asupra acțiunii α-MSH prin MC4R și MC3R și, prin urmare, poate provoca orexigeneză anormală și creștere în greutate. Inhibitor al transferului catenelor INsTI Integrase, POMC/CART Proopiomelanocortină/transcriptă reglementată de cocaină și amfetamină, AgRP/NPY Agouti-related protein/neuropeptide Y, α-MSH alfa-melanocyte stimulant hormone, MC3R melanocortin-3 receptor, MC4R melano.
Mutațiile MC4R provoacă obezitate monogenă, iar copiii heterozigoți sau homozigoti pentru pierderea funcției alelelor mutante ale genei MC4R dezvoltă obezitate cu debut precoce [12]. Analiza distinctă a studiului de asociere pe scară largă a genomului a dezvăluit variantele genei polimorfe MC4R asociate cu creșterea în greutate [12]. Activatorii farmacologici ai MC4R sunt utilizați pentru tratarea pacienților obezi cu defecte genetice MC4R, iar medicamentele recent obținute pentru obezitate (bupropion și naltrexonă) activează sistemul POMC [13]. În schimb, antagoniștii MC4R sau agoniștii inversi pentru tratarea anorexiei determină creșterea consumului de alimente la modelele animale [13].
De asemenea, poate fi dobândită o defecțiune a MCS. Agenții antipsihotici au fost asociați cu creșterea în greutate [14]. Olanzapina a crescut aportul alimentar și greutatea corporală la șobolanii femele, împreună cu o creștere a NPY și AgRP (orexigenă) și o scădere a nivelurilor de ARNm POMC (anorexigenic) în ARC [14]. Grelina, un hormon orexigenic secretat din stomac, puternic reglat în sus la șobolani femele tratați cu olanzapină, ducând la hiperfagie și creștere în greutate [14].
Studii rare au explorat funcția MCS în PLWH. Nivelurile plasmatice α-MSH sunt crescute în PLWH, în special în infecțiile avansate [15]. NPY are imunoreactivitate mai mare în LCR și plasmă a PLWH în raport cu martorii neinfectați [15]. În special, in vitro, DTG a provocat inhibarea legării α-MSH la MC4R cu 64%. În mod remarcabil, INsTI ating concentrații terapeutice ale LCR, iar regiunea ARC lipsește bariera hematoencefalică [10].
Ipoteză
Deoarece TARC-ul actual include adesea combinația INsTI cu două INRT și întrucât creșterea excesivă în greutate a fost descrisă predominant la pacienții expuși la INsTI, facem ipoteza că INsTI joacă un rol crucial în patogeneza supraponderalității sau a obezității clinice la PLWH expuse la aceste medicamente. . Propunem că interferența de către INsTI a funcției MCS, care duce la răspuns orexigen, este mecanismul responsabil (Fig. 1), provocând tulburări similare cu cele observate cu mutații MC4R sau terapie antipsihotică [12, 14].
Cel puțin patru mecanisme potențiale ar putea produce o astfel de inducere a răspunsului orexigen de către INsTI. Primul ar fi blocarea MC4R (Fig. 1). DTG, la Cconcentrația maximă, inhibă legarea α-MSH radiomarcat de MC4R cu 64% [10]. Acest mecanism ar inactiva brațul anorexigen al sistemului melanocortin, instigând un răspuns orexigenic. Predicția legării INsTI la MC4R (suprapunere structurală) derivă din prezența inelului substituit cu halogen în agoniști selectivi MC4R, caracteristică împărtășită de DTG și bictegravir (Gelpi JL, date proprii).
Al doilea mecanism ar fi reglarea ascendentă a secreției NPY, receptorii NPY sau ambii conducând la hiperactivarea brațului orexigen al sistemului (Fig. 1). Nivelurile plasmatice și CSF ale NPY în PLWH au fost crescute în ceea ce privește cele ale controalelor neinfectate [15].
Al treilea mecanism ar putea fi inhibarea legării α-MSH la MC3R a neuronilor NPY/AgRP, evitând reprimarea NPY cauzată de α-MSH și inducând astfel un comportament de hrănire [16].
Un al patrulea mecanism potențial ar putea fi prin semnalizarea periferică către neuronii POMC/CART și NPY de către grelină sau leptină sau receptorii săi. Cu toate acestea, nu există nicio dovadă a diferențelor în nivelurile plasmatice ale acestor semnale în absența tulburărilor metabolice sau a grăsimilor în PLWH tratate cu CART [17].
NRTI poate contribui la acest proces prin mecanisme dezvăluite suplimentar [9, 10]. Cu toate acestea, utilizarea INsTI pare a fi un factor esențial, deoarece alte regimuri CART nu au fost în mod constant asociate cu creșterea în greutate în exces. Excesul de greutate și obezitatea la PLWH este, la fel ca în populația generală, un proces multifactorial, în care INsTI și poate NRTI joacă un rol dăunător.
Testarea ipotezei
Diferite tipuri de studii ar fi complementare pentru a testa această ipoteză. În primul rând, studiile clinice prospective ar trebui să definească și să valideze un prag semnificativ din punct de vedere clinic pentru ceea ce reprezintă o creștere semnificativă în greutate în PLWH tratat cu CART. Acest prag trebuie apoi aplicat studiilor RCT și observaționale. Pentru terapiile de gestionare a greutății, FDA din SUA consideră că o pierdere în greutate de 5% este semnificativă din punct de vedere clinic [18]. În schimb, dacă un tratament crește greutatea cu 5% sau mai mult, și acesta poate fi semnificativ clinic. Contribuția medicamentelor antiretrovirale, în special INsTI, la creșterea excesivă în greutate, ECA dublu-orb ar trebui clarificată prin comparații cap la cap între medicamentul asociat creșterii în greutate și altul cu efecte neutre cunoscute. Contribuția potențială a INRT poate fi văzută în proiectarea factorială. Comutarea RCT poate afișa nu numai responsabilitatea unui medicament, ci și reversibilitatea adipozității câștigate. Aceste studii trebuie să includă substudii de compoziție corporală pentru a defini dacă depunerea de grăsime este generalizată sau preferă un anumit depozit.
Substudiile despre funcția MCS în RCT, privind biomarkerii cu plasmă și CSF, ar fi iluminante. Contribuția geneticii trebuie explorată, obținând informații din polimorfismele MCR asociate cu obezitatea [12]. La nivel periferic, trebuie determinate efectele INsTI asupra diferitelor depozite adipoase. Farmacodinamica tisulară specifică fiecărui INsTI va fi foarte probabil diferită și, prin urmare, poate provoca efecte diferite, dacă există, asupra diferitelor tipuri de celule din depozit. Procedurile invazive, cum ar fi biopsiile de țesut adipos, ar fi esențiale în acest scop [19].
În al doilea rând, studiile in vitro care utilizează celule cerebrale care exprimă MC4R și MC3R vor evalua într-o manieră autonomă celulară interferența potențială a INsTI și a altor antiretrovirale asupra acțiunilor mediate de α-MSH. Studiile in vitro asupra adipocitelor umane ar fi complementare probelor ex vivo și ar explora orice efecte periferice potențiale ale INsTI și ale altor antiretrovirale asupra funcțiilor de diferențiere, metabolice și secretoare ale adipocitelor umane într-un mediu bine controlat [20].
În al treilea rând, studiile pe animale vor profita de posibilitatea unor cercetări mai invazive privind studiile la om. Cercetările ar trebui să determine efectele șoarecilor tratați cu INsTI diferite. Pot fi utilizate modele distincte de șoarece, de la modele de adipozitate sporită prin expunerea la diete obezogene la șoareci transgenici care exprimă o parte a genomului HIV care poartă semne ale mediului asociat cu HIV in vivo [21]. Aportul de alimente, greutatea corporală, achiziția adipozității și modelul de cheltuială a energiei în modelele animale ca răspuns la INsTI se pot face folosind un sistem cuprinzător de monitorizare cuști. Modelele animale ar fi iluminante datorită accesului nerestricționat la sânge, depozitelor de grăsime, creierului și hipotalamusului pentru a elucida starea funcțională a SMC.
Referințe
Panou privind liniile directoare antiretrovirale pentru adulți și adolescenți. Liniile directoare pentru utilizarea agenților antiretrovirali la adulți și adolescenți cu HIV. Departamentul de sănătate și servicii umane. http://www.aidsinfo.nih.gov/ContentFiles/AdultandAdolescentGL.pdf. Accesat la 8 mai 2019.
Vitoria M, Hill A, Ford N, Doherty M, Clayden P, Venter F și colab. Trecerea la dolutegravir și la alte antiretrovirale noi în țările cu venituri mici și cu venituri medii: care sunt problemele? SIDA. 2018; 32: 1551–61.
Blüher T. Obezitatea: epidemiologie globală și patogenie. Nat Rev Endocrinol. 2019; 15: 288-98.
Erlandson KM, Taejaroenkul S, Smeaton L, Gupta A, Singini IL, Lama JR, și colab. O comparație randomizată a modificărilor antropomorfe cu regimuri antiretrovirale preferate și alternative bazate pe efavirenz în diverse setări multinaționale. Deschideți Forumul Infect Dis. 2015; 2: ofv095.
Achra AC, Mocroft A, Reiss P, Sabin C, Ryom L, de Wit S și colab. Creșterea în greutate pe termen scurt după inițierea terapiei antiretrovirale și riscul ulterior de boli cardiovasculare și diabet: studiul D: A: D. HIV Med. 2016; 17: 255-68.
Bernardino I, Mocroft A, Wallet C, de Wit S, Katlama C, Reiss P, și colab. Compoziția corpului și adipokinele se modifică după tratamentul inițial cu darunavir-ritonavir plus raltegravir sau fumarat de tenofovir disoproxil-emtricitabină: un sub-studiu al studiului randomizat NEAT001/ANRS 143. Plus unu. 2019; 14: e0209911.
Grupul de studiu NAMSAL ANRS 12313, Kouanfack C, Mpoudi-Etame M, Omgba Bassega P, Eymard-Duvernay S, Leroy S și colab. Regim pe bază de efutirenz pe bază de dolutegravir sau cu doze mici pentru tratamentul HIV-1. N Engl J Med. 2019; 381: 816–26.
Venter WDF, Moorhouse M, Sokhela S, Fairlie L, Mashabane N, Masenya M și colab. Dolutegravir plus două promedicamente diferite de tenofovir pentru tratamentul HIV. N Engl J Med. 2019; 381: 803-15.
Sax PE, Erlandson KM, Lake JE, McComsey GA, Orkin C, Esser S și colab. Creșterea în greutate după inițierea terapiei antiretrovirale: factori de risc în studiile clinice comparative randomizate. Clin Infect Dis. 2019 pii: ciz999. https://doi.org/10.1093/cid/ciz999.
Hill A, Waters L, Pozniak A. Sunt noi tratamente antiretrovirale care cresc riscurile obezității clinice? J Virus Erad. 2019; 5: 41-3.
Voss-Andreae A, Murphy JG, Ellacott KT, Stuart RC, Nillni EA, Cone RD și colab. Rolul circuitului central al melanocortinei în termogeneza adaptativă a țesutului adipos maro. Endocrinologie. 2007; 148: 1550–60.
Loos RJ, Lindgren CM, Li S, Wheeler E, Zhao JH, Prokopenko I și colab. Variantele obișnuite lângă MC4R sunt asociate cu masa grasă, greutatea și riscul de obezitate. Nat Genet. 2008; 40: 768-75.
Fleming KA, Ericson MD, Freeman KT, Adank DN, Lunzer MM, Wilber SL. și colab. Studiile de relații structură-activitate ale unei schele macrociclice AGRP-mimetic c [Pro-Arg-Phe-Phe-Asn-Ala-Phe-DPro] produc antagoniști puternici și selectivi ai receptorilor Melanocortin-4 și agoniști inversi ai receptorului Melanocortin-5 care cresc aportul alimentar la șoareci. ACS Chem Neurosci. 2018; 9: 1141-51.
Dent R, Blackmore A, Peterson J, Habib R, Kay GP, Gervais A și colab. Modificări ale greutății corporale și medicamente psihotrope: o sinteză sistematică a literaturii. Plus unu. 2012; 7: e36889.
Malessa R, Heimbach M, Brockmeyer NH, Hengge U, Rascher W, Michel MC. Creșterea imunoreactivității de tip neuropeptidic Y în lichidul cefalorahidian și în plasma pacienților infectați cu virusul imunodeficienței umane: relație cu encefalopatia HIV. J Neurol Sci. 1996; 136: 154-8.
Girardet C, Marks DL, Butler AA. Receptorii melanocortinei-3 exprimați pe neuroni peptidici asociați cu agouti inhibă comportamentul de hrănire la șoareci femele. Obezitatea. 2018; 26: 1849–55.
McFarlane SI, Mielke MM, Uglialoro A, Keating SM, Holman S, Minkoff H, și colab. Grelină, amilină, peptidă inhibitoare gastrică și cogniție la femeile de vârstă mijlocie infectate cu HIV și neinfectate: studiul interinstanțial HIV al femeilor. J Neurol Neurofiziol. 2017; 8: 413.
Food and Drug Administration (SUA). Îndrumări pentru industrie. Dezvoltarea de produse pentru controlul greutății. 2007. www.fda.gov/downloads/Drugs/Guidances/ucm071612.pdf. Accesat în aprilie 2019.
Domingo P, Gutierrez M del M, Gallego-Escuredo JM, Torres F, Mateo MG, Villarroya J, și colab. Un studiu de 48 de săptămâni asupra modificărilor moleculare ale grăsimilor la pacienții naivi cu HIV care au început tenofovir/emtricitabină cu lopinavir/ritonavir sau efavirenz. J Acquir Syndr imunodefic. 2014; 66: 457-65.
Moure R, Domingo P, Gallego-Escuredo JM, Villarroya J, Gutierrez M del M, Mateo MG, și colab. Impactul elvitegravirului asupra adipocitelor umane: modificări ale diferențierii, exprimării genelor și eliberării adipokinelor și citokinelor. Antivir Res. 2016; 132: 59-65.
Villarroya J, Diaz-Delfin J, Hyink D, Domingo P, Giralt M, Klotman PE și colab. Expresia transgenului HIV de tip 1 la șoareci modifică nivelul țesutului adipos și adipokine: spre un model de rozătoare al lipodistrofiei de tip HIV-1. Antivir Ther. 2010; 15: 1021-8.
Finanțarea
Această lucrare a fost parțial finanțată de Fondul de investiții sanitare (FIS PI13/0796, PI14/0700, PI14/0063, PI016/0503, PI17/0420 și PI17/0498), Ministerio Sanidad, Politica Social e Igualdad (EC11-293) și program de sprijin în calitate de grupuri de cercetare AGAUR (2014 SGR 250, 2017 SGR 948).
Informatia autorului
Afilieri
Departamentul de Boli Infecțioase, Spitalul Santa Creu i Sant Pau, Institutul de Recerca del Hospital de la Santa Creu i Sant Pau, Barcelona, Spania
Departamentul de Biochimie și Biomedicină Moleculară și Institutul de Biomedicină (IBUB), Universitatea din Barcelona, CIBER Fiziopatologia obezității și nutriției, Barcelona, Spania
Francesc Villarroya, Marta Giralt și Joan Carles Domingo
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Contribuții
Toți autorii se implică în proiectarea ipotezei. Toți autorii au coordonat și au supravegheat dezvoltarea și testarea ipotezei. Toți autorii au participat la interpretarea datelor. Lucrarea a fost elaborată de toți autorii. Toți autorii au furnizat contribuții la raport și au aprobat versiunea finală a lucrării.
autorul corespunzator
Declarații de etică
Conflict de interese
Autorii declară că nu au niciun conflict de interese.
Informatii suplimentare
Nota editorului Springer Nature rămâne neutru în ceea ce privește revendicările jurisdicționale din hărțile publicate și afilierile instituționale.
- Prezentare generală Prevenirea creșterii în greutate în exces Ghid NICE
- Obezitatea și sănătatea creierului Excesul de greutate poate accelera îmbătrânirea creierului; Sfaturi pentru a preveni obezitatea
- Un nou studiu arată că consumul de alimente organice poate preveni efectiv creșterea în greutate a Institutului pentru persoane responsabile
- Consumul de ulei de măsline și creșterea în greutate - ScienceDirect
- Motive medicale și legate de sănătate pentru forma inexplicabilă de creștere în greutate