Școala de biologie, Colegiul de medicină, biologie și mediu, Australian National University, Canberra, Australian Capital Territory, Australia
Tel: + 61‐2‐6125‐2540. Fax: + 61-2-21212-0313.
School of Biology, College of Medicine, Biology and Environment, Australian National University Căutați mai multe lucrări ale acestui autor
Școala de biologie, Colegiul de medicină, biologie și mediu, Australian National University, Canberra, Australian Capital Territory, Australia
Tel: + 61‐2‐6125‐2540. Fax: + 61-2-21212-0313.
School of Biology, College of Medicine, Biology and Environment, Australian National University Căutați mai multe lucrări ale acestui autor
Abstract
ASPECTELE FIZIOLOGICE ȘI CLINICE ALE HARTNUP
Tulburarea Hartnup (OMIM 234500) este o tulburare autosomală recesivă care apare la o frecvență de aproximativ 1: 30.000 la populațiile europene (1, 2). Tulburarea a fost descrisă pentru prima dată în 1956 de Baron și colab. (3) și titlul publicației descrie principalele caracteristici clinice ale tulburării într-un mod cât mai concis: „Pelagra ereditară - cum ar fi erupție cutanată cu ataxie cerebelară temporară, aminoacidurie renală constantă și alte caracteristici biochimice bizare.” Tulburarea Hartnup și-a primit numele din primul caz descris Eddie Hartnup (Eddie H. în publicația originală).
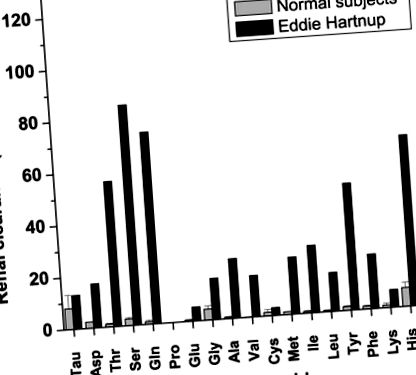
Aminoaciduria renală este semnul distinctiv al tulburării, datorită variabilității altor simptome, iar majoritatea pacienților, dacă nu toți, au fost diagnosticați prin analiza urinei. Un exemplu tipic este analiza urinei a lui Eddie Hartnup însuși, așa cum a raportat Cusworth și Dent (10) (Fig. 1). Aminoaciduria este limitată la aminoacizi neutri, deși se găsesc deseori și cantități ușor crescute de glutamat. Sunt deosebit de relevante cantitățile crescute de triptofan (care nu sunt prezentate în Fig. 1), indicând o lipsă de reabsorbție a triptofanului. Aminoaciduria și simptomele clinice sunt cauzate de un defect al transportorului principal renal și intestinal pentru aminoacizi neutri, care a fost denumit B 0 (denotând un transportor pentru aminoacizi neutri (0) cu specificitate largă; majuscula este utilizată pentru a indica Na + - dependență) (11, 12) sau marginea periei neutre (NBB) (13).
Clearance-ul renal al aminoacizilor la subiecții de referință și la Eddie Hartnup raportat de Cusworth și Dent (10) (modificat cu permisiunea). Un clearance renal de 120 indică o substanță care nu este reabsorbită și nici excretată de tubulii renali.
Ataxia ar putea fi, de asemenea, legată de metabolismul triptofanului și de conversia acestuia în serotonină (5-hidroxitriptamină). Serotonina joacă un rol important ca neurotransmițător în modularea furiei, agresivității, temperaturii corpului, dispoziției, somnului, sexualității, apetitului și metabolismului. Deși nivelurile scăzute de B 0 AT1 se găsesc în creier, principalul său loc de expresie este marginea periei celulelor epiteliale renale și intestinale. Cu toate acestea, nivelurile de serotonină din creier corespund nivelurilor de triptofan din sânge, deoarece Km de triptofan hidroxilază, etapa care limitează rata de biosinteză a serotoninei, este mai mare decât concentrațiile de triptofan în creier sau circulație (14). Drept urmare, triptofanul are proprietăți antidepresive, iar metabolitul său 5-hidroxitriptofan provoacă regresia diferitelor forme de ataxie cerebelară (16). Se știe puțin dacă nivelurile plasmatice modificate ale altor aminoacizi precursori ai neurotransmițătorului, cum ar fi tirozina sau histidina, pot contribui la simptome neurologice. S-a observat că simptomele clinice sunt mai susceptibile să apară la persoanele cu niveluri scăzute de aminoacizi plasmatici (6).
Alternativ, s-a propus că ar putea fi implicați produse toxice de degradare bacteriană ale triptofanului (17). Produsele de degradare bacteriană ale triptofanului, cum ar fi compușii indolici (indoxil sulfat, acid indol acetic, indolilacetil glutamină) și alți aminoacizi au fost identificați în urina persoanelor cu tulburare Hartnup, demonstrând că sunt absorbiți în intestin și distribuiți pe tot corpul. Apariția acestor produși de degradare bacteriană a fost într-adevăr prima dovadă că transportul aminoacizilor este afectat în intestin (18). Implicarea compușilor indolici la apariția ataxiei, totuși, pare puțin probabilă având în vedere cazurile asimptotice de tulburare Hartnup, în care produșii de degradare ai triptofanului ar fi încă produși.
ESTE TULBURAREA HARTNUP GENETIC COMPLEXĂ SAU SIMPLĂ
IDENTIFICAREA GENEI/PROTEINELOR
MUTATII
Identificarea B 0 AT1 (SLC6A19) ca genă pentru tulburarea Hartnup a inițiat încercări de secvențiere în mai multe familii cu tulburare Hartnup. Acestea au dezvăluit mutații în SLC6A19, care au fost cosegregate cu boala și cu funcția de transport inactivată (4, 5). În timp ce inițial au existat speculații cu privire la genele suplimentare ale tulburării Hartnup, reevaluarea familiilor identificate până acum și secvențierea noilor familii au relevat mutații în SLC6A19 în toate cazurile (38). Până în prezent au fost identificate 21 de mutații diferite în mai mult de 20 de familii (Tabelul 1 și Fig. 2). Probele cazului original Hartnup au condus la identificarea unei mutații de îmbinare în secvența intermediară 8 (4).
Prezentare generală a mutațiilor asociate tulburării Hartnup într-un model topologic al SLC6A19 uman. Aranjamentul helicilor reflectă modelul de consens al familiei SLC6 bazat pe structura transportatorului de leucină LeuT din Aquifex aeolicus (40). Datorită acestui aranjament, coloana vertebrală este întreruptă grafic între helix 5 și 6. Substratul și reziduurile implicate în legarea substratului sunt prezentate în verde. Ioniul Na + este prezentat în roșu, iar reziduurile implicate în legarea Na + sunt decorate cu un inel roșu. Mutanții asociați cu tulburarea Hartnup sunt etichetați și prezentați în portocaliu cu un inel albastru. Reziduurile despre care se crede că formează cele două porți ale transportorului sunt conectate printr-o linie întreruptă și colorate în albastru (reziduuri bazice) sau galben (acid).
| Missense | |||
| 169C> T | R57C | n.r. | (4) |
| 196G> A | G66R | 37) | |
| 205G> A | A69T | n.r. | (48) |
| 277G> A | G93R | 37) | |
| 517G> A | D173N | 0,004-0,007 | (5) |
| 532C> T | R178X | 37) | |
| 719G> A | R240Q | 5) | |
| 725T> C | L242P | n.r. | (5) |
| 794C> T | P265L | n.r. | (48) |
| 850G> A | G284R | 37) | |
| 982C> T | R328C | 37) | |
| 1213G> A | E405K | 37) | |
| 1501G> A | E501K | n.r. | (5) |
| 1550A> G | D517G | 37) | |
| 1735C> T | P579L | n.r. | (48) |
| Prostii | |||
| 682‐683AC> TA | T228X | n.r. | (4) |
| 718C> T | R240X | 0,001 | (5) |
| Ștergeri | |||
| 340delC | L114fsX114 | n.r. | (4) |
| c884_885delTG | V295fsX351 | n.r. | (4) |
| Site de îmbinare | |||
| IVS8 + 2G | Împletire aberantă | 5) | |
| IVS11 + 1A | Împletire aberantă | n.r. | (5) |
Similitudinea secvenței cu LeuT a permis generarea de modele de omologie, care au fost esențiale în explicarea pierderii funcției în unele mutații (42). G284, de exemplu, este situat în helixul 6 al transportorului (Fig. 2 și 3). Împreună cu helix 1, căptușește calea de translocație a substratului și s-a sugerat să se deplaseze în timpul ciclului de transport într-un mod de basculare (40). În centrul membranei ambele spirale sunt parțial desfăcute, permițând resturilor coloanei vertebrale să intre în contact cu ionul Na + cotransportat. Datorită flexibilității oferite de lipsa unui lanț lateral, reziduul G284 permite desfacerea elicei în această zonă. Mutația lui R57, situată în helix 1, perturbă poarta extracelulară propusă a transportorului (Fig. 2). Această poartă este esențială pentru mecanismul de transport care închide porii prin interacțiunea cu D486 (Fig. 4). Mutația lui R57 la un reziduu neutru elimină această interacțiune. Un model complet diferit de acțiune a fost sugerat pentru mutația R240Q de către modelul de omologie. Reziduul este situat la vârful proteinei care iese în exterior (37). Ca rezultat, pare puțin probabil să afecteze transportorul în sine, ci mai degrabă a indicat un loc de interacțiune cu proteinele accesorii.
Localizarea mutației asociate tulburării Hartnup G284. Un model de omologie pentru B 0 AT1 (SLC6A19) a fost creat pe baza structurii LeuT din Aquifex aeolicus. Helix 1 este afișat în galben și helix 6 este afișat în albastru. Desene animate indică partea nehelicoidă a ambelor spirale aproape de locul de legare a substratului. Alte helici sunt descrise în roșu. Doi ioni Na + sunt descriși în analogie cu structura bacteriană. Dovezile experimentale sugerează că Na este cotransportat în B 0 AT1. Prezența și funcția Na este speculativă. G284 este situat în centrul helixului 6, unde structura elicoidală este întreruptă. Cifra a fost generată folosind Pymol (DeLano Scientific).
Localizarea mutației asociate tulburării Hartnup R57. Un model de omologie pentru B 0 AT1 (SLC6A19) a fost creat pe baza structurii LeuT din Aquifex aeolicus. Helix 1 este afișat în galben și helix 6 este afișat în albastru. Alte helici sunt descrise în roșu. Sunt indicate poziția substratului leucina și Na ipotetică. Reziduul R57 este în contact strâns cu D486 și formează o legătură ionică, care închide porul de translocație către spațiul extracelular. Cifra a fost generată folosind Pymol (DeLano Scientific).
PROTEINE ASOCIATE
Prezentare generală a proteinelor care interacționează SLC6A19. Interacțiunile dintre proteine și proteine sunt reprezentate de săgeți complete. Reglarea transcripțională este indicată de săgeți întrerupte. Răspunsurile fiziologice sunt prezentate între paranteze.
Interacțiunea B 0 AT1 cu colectrina explică, de asemenea, aminoaciduria în cazurile de MODY3, care este cauzată de mutații ale factorului de transcripție HNF1α (factorul hepatic nuclear 1 alfa) (52). HNF1α este unul dintre factorii majori de transcripție care controlează expresia colectinei în rinichi. Inactivarea HNF1α va provoca o lipsă de expresie a colectrinei, care la rândul său va determina exprimarea redusă a B 0 AT1 și a transportorului de prolină IMINO (Fig. 5). Inactivarea HNF1α la șoareci duce la disfuncție hepatică, fenilcetonurie și sindrom renal Fanconi. Astfel, aminoaciduria observată în sindromul Fanconi ar putea fi legată de pierderea colectinei sau de reglarea descendentă a expresiei HNF1α. În acord cu această noțiune, sa demonstrat că HNF1α controlează expresia transportorului apical de glucoză SGLT1 (53) și, eventual, a transportorului de aminoacizi cationic rbAT/b 0, + AT (54). Aminoaciduria observată în diabet sau sarcină rămâne inexplicabilă, dar poate implica și niveluri reduse de colectină.
Așa cum s-a subliniat mai sus, transportul peptidelor este probabil să compenseze epuizarea aminoacizilor în tulburarea Hartnup. Până în prezent s-au identificat polimorfisme cu nucleotide unice (SNP) în mare parte sinonime în transportorul de peptide PepT1 (55). A fost detectată o singură mutație (F28Y) care a redus activitatea de transport. Nu s-a investigat dacă SNP-urile din regiunile promotor sau intronic pot modifica expresia transportorului și, prin urmare, ar putea modula fenotipul tulburării Hartnup. Nici nu s-a investigat dacă cazurile recente de tulburare clasică Hartnup ar putea avea mutația F28Y în PepT1, agravând astfel simptomele.
PATRIARHUL O NOUĂ FAMILIE
Așa cum s-a subliniat mai sus, B 0 AT1 este un membru al familiei SLC6 de transportatori de neurotransmițători. Când a fost descoperită această familie, clonarea omologică a dezvăluit o subfamilie de transportori înrudiți a căror funcție nu a putut fi identificată. Acești transportori au fost numiți XT1 (alias NTT4) (56, 57), XT2 (alias ROSIT) (31, 32), XT3 (58), NTT5 (59) și v7-3 (60). Această ramură a familiei SLC6 a fost, prin urmare, numită ramură a transportatorului orfan. Descoperirea B 0 AT1 l-a plasat în ramura de transport orfan sugerând că „orfanii” ar putea fi de fapt transportori de aminoacizi (61) (Tabelul 2). Acest lucru a fost confirmat ulterior pentru XT3, arătându-l a fi sistemul de transport apical IMINO (66, 67), un transportor specific pentru prolină, hidroxiprolină, betaină și MeAIB. Următorul v7-3 a fost identificat ca B 0 AT2 un transportor cu proprietăți similare cu B 0 AT1, dar cu o specificitate a substratului mai îngustă, preferând aminoacizi cu lanț ramificat și metionină (62, 63). Mai recent, NTT4 s-a dovedit a fi un transportor neutru de aminoacizi (64, 65), care este fie Na +, fie H + - dependent și a fost numit în mod adecvat B 0 AT3. XT2 pare să prefere glicina și alanina (manuscris în pregătire). Transportorii orfani formează astfel o familie numeroasă de transportori de aminoacizi neutri dependenți de Na +.
| SLC6A15 | B 0 AT2 | V7‐3, NTT7‐3, SBAT1 | Leu, Ile, Val, Met, Pro (62, 63) |
| SLC6A16 | NTT5 | Necunoscut | |
| SLC6A17 | B 0 AT3 | NTT4, RXT1 | Ala, Pro, Gly, Leu (64) |
| Leu, Met, Pro, Cys, Ala, Gln, Ser, His, Gly (65) | |||
| SLC6A18 | XT2, | XTRP2, ROSIT | Ala, Gly> alte AA neutre |
| SLC6A19 | B 0 AT1 | Similar cu XT2 | Toate neutre (34, 35) |
| SLC6A20 | IMINO | SIT1, XT3 | Pro, OH - Pro (66, 67) |
CONCLUZIE
Deși inițial descrisă ca o tulburare autosomală recesivă simplă, identificarea moleculară a genei subiacente SLC6A19 relevă interacțiuni complexe între transportor și proteinele asociate ale acesteia, colectrina și ACE2. Interacțiunile SLC6A19 (Fig. 5) îl leagă posibil de tulburări complexe precum diabetul, disfuncția reglării tensiunii arteriale și scleroza glomerulară.
1 Acronimul B 0 AT1 se referă la o activitate de transport dependentă de Na + pentru aminoacizi neutri (0) cu specificitate largă (B). La genomii de mamifere este denumit familia purtătorului de solut 6 membru 19 (SLC6A19).
- Tioredoxina și acidul lipoic catalizează denitrozarea greutății moleculare mici și a proteinelor
- Beneficiile aminoacizilor din Super Amino 23 - Nutriție nouă
- Cele mai bune 17 recenzii pentru suplimente de aminoacizi 2020
- Rolul genelor implicate în lipoliză în programul de slăbire la persoanele supraponderale și obeze
- Rolul terapiei cu progesteron în pierderea în greutate Creșterea în greutate și PRT