Hao Zhou
1 Departamentul de Cardiologie, Spitalul General PLA din China, Școala Medicală din PLA din China, Beijing 100853, China
Sam Toan
2 Departamentul de Inginerie Chimică, Universitatea din Minnesota-Duluth, Duluth, Minnesota, MN 55812, SUA
Abstract
1. Introducere
Infarctul miocardic acut (IMA) este cauzat de blocarea uneia sau mai multor artere coronare care alimentează inima [1,2]. Încetarea bruscă a fluxului sanguin proaspăt va avea ca rezultat extins hipoxia sau anoxia tisulară și, în cele din urmă, moartea celulară prin apoptoză sau necroză [3,4]. S-a acceptat pe scară largă că reintroducerea fluxului de sânge prin strategii de reperfuzie este necesară și fructuoasă pentru salvarea miocardului deteriorat. Paradoxal, reperfuzia provoacă, de asemenea, moartea cardiomiocitelor sau a celulelor endoteliale prin inducerea stresului oxidativ, a supraîncărcării de calciu și a răspunsului la inflamația țesuturilor [5,6]. De remarcat, realitatea clinică a leziunii cu ischemie-reperfuzie (I/R) devine evidentă odată cu apariția reperfuziei trombolitice și intervenționale [7,8].
Mitocondriile au fost văzute istoric ca fiind bateria celulei prin consumul de oxigen și producerea de ATP cu ajutorul ciclului acidului citric [29,30]. O serie de răspunsuri la stres celular se află sub controlul mitocondriilor, pe lângă rolul lor necesar în bioenergetică [29,31]. Spre deosebire de cardiomiocite sau mușchiul scheletic, producția de energie dependentă de mitocondrie este relativ scăzută în endoteliul vascular, care utilizează în primul rând glicoliza pentru a produce ATP [32,33]. Se acceptă acum că mitocondriile din celulele endoteliale joacă în principal un rol important în semnalizarea răspunsurilor celulare la indicii de mediu [34,35]. Mai important, conținutul mitocondrial din celulele endoteliale este relativ scăzut (2-6% din volumul citoplasmei) comparativ cu alte tipuri de celule, cum ar fi cardiomiocitele (
32%) [36]. Conținutul redus de mitocondrie din celulele endoteliale validează în continuare o funcție necanonică jucată de mitocondrii în reglarea răspunsurilor de semnalizare, mai degrabă decât în metabolismul glucozei [37]. Ca răspuns la stres, speciile reactive de oxigen (ROS) sunt produse de mitocondrii și utilizate ca un al doilea mesager pentru a transduce semnalul extracelular [38,39]. Fuziunea mitocondrială [40] și fisiunea [41,42], împreună cu mitofagia (îndepărtarea mitocondriilor defecte), sunt implicate și în reglarea homeostaziei celulare prin afectarea controlului calității mitocondriale [43,44]. Aici, rezumăm și discutăm principalele aspecte de reglementare ale stresului oxidativ mitocondrial și ale dinamicii mitocondriale în leziunile I/R microvasculare cardiace (Figura 1).
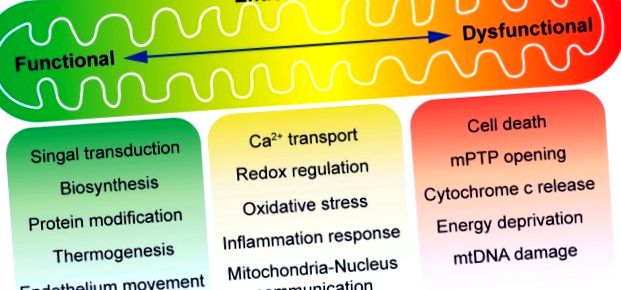
O prezentare generală a funcției mitocondriale în homeostazia endoteliului. Mitocondriile sunt cunoscute ca puterea celulei. În condiții normale, producția de energie dependentă de mitocondrie este relativ scăzută în endoteliul vascular, care utilizează în primul rând glicoliza pentru a produce ATP. Acum este acceptat faptul că mitocondriile din celulele endoteliale joacă în principal un rol proeminent în semnalizarea răspunsurilor celulare la indicii de mediu. Metabolismul intermediar în mitocondrii produce metaboliți pentru biosinteză, modificare a proteinelor și termogeneză. În plus, mobilizarea endotelială se află sub controlul mitocondriilor. Fosforilarea oxidativă este cuplată cu generarea de specii reactive de oxigen (ROS), care pot servi fie ca semnale moleculare, fie pot provoca leziuni celulare și moarte celulară. Metabolismul mitocondrial este stimulat de calciu, dar în condiții patologice, supraîncărcarea cu calciu poate declanșa deschiderea porului de tranziție a permeabilității mitocondriale (mPTP). Eliberarea conținutului mitocondrial, cum ar fi citocromul c, induce apoptoza sau pierderea potențialului membranei (o consecință a deschiderii prelungite a mPTP), cauzează lipsa ATP și necroza.
2. Stresul oxidativ mitocondrial
NADPH oxidaza (NOX) este o altă sursă de producție mtROS în celulele endoteliale. NOX sunt complexe enzimatice legate de membrană și subunitățile NOX gp91 phox, p22 phox, p67 phox și p47 phox au fost identificate pentru prima dată în HUVEC cultivate de Jones și colegii săi [63]. Aceste izoforme NOX exprimate în vasculatură diferă prin localizarea lor subcelulară, însă toate funcționează prin transfer de electroni de la NOX citosolic la oxigenul mitocondrial, producând astfel superoxid sau peroxid de hidrogen [64,65]. Deși numeroase dovezi în diferite linii de celule endoteliale au indicat ETC mitocondrial ca sursă principală a ROS legate de I/R, există posibilitatea de a vorbi încrucișat între izoformele NOX și mitocondriile [66]. De remarcat, NOX4 este localizat de-a lungul membranei mitocondriale interioare, iar interacțiunea potențială dintre aceste două surse de ROS poate fi determinanți semnificativi ai mtROS total în endoteliu [67,68].
În matricea mitocondrială, superoxidul dismutază (SOD) 2 reduce O2 - în H2O2, un ROS mai puțin toxic [83]. Apoi, glutation peroxidaza (GPX) catalizează reducerea H2O2 în H2O prin oxidarea glutationului redus (GSH) în forma sa oxidată (GSSG) [84,85]. Catalaza din matricea mitocondrială poate converti, de asemenea, H2O2 în apă și oxigen molecular [86,87]. Biosinteza glutationului este catalizată de glutation reductază utilizând oxidarea fosfatului de nicotinamidă adenină dinucleotidic (NADPH) în NADP și este crucială în activitățile antioxidante din mitocondrii [88,89]. În spațiul intermembranar, SOD1 care conține cupru și zinc reduce O2 - în H2O2, iar GPX reduce H2O2 în H2O [90,91].
O altă sursă importantă de ROS în inima perfuzată sunt cele două izoforme ale monoaminooxidazelor (MAO), MAO-A și MAO-B, care se află pe membrana mitocondrială externă [92]. S-a demonstrat că activitatea MAO-A este îmbunătățită prin leziuni I/R și este responsabilă pentru precipitarea peroxidului de hidrogen și progresia către hipertrofia ventriculului stâng și remodelarea cardiacă [93]. Un flux crescut de fier mitocondrial stimulează formarea de grupări radicale hidroxil mai puternice și mai dăunătoare din peroxidul de hidrogen [94,95]. Deși eliberarea continuă a ROS din mitocondrii în condiții normale pare să joace un rol necesar în menținerea funcției celulare bazale, nivelurile tranzitorii de ROS pot promova sinteza selectivă a proteinelor, precondiționarea și modificările tonusului vascular [96,97]. Cu toate acestea, chiar și producția de ROS mitocondrială extrem de ridicată poate duce la disfuncție celulară.
De remarcat, stresul oxidativ este asociat cu expresia modificată a proteinelor mitocondriale și nucleare. De exemplu, s-a demonstrat că stresul oxidativ mărește activitatea factorului de transcripție COUP-TFII, care induce expresia enzimelor mitocondriale codificate nuclear, favorizând fragmentarea mitocondrială [110]. În mod similar, ROS reglează în jos activitatea complexelor ETC și scade consumul de oxigen la pacienții cu sindrom metabolic, ceea ce duce la hipertrofie ventriculară stângă și insuficiență cardiacă [111]. În cele din urmă, ROS provoacă modificări structurale ale proteinelor mitocondriale, cum ar fi un dezechilibru între tirozin kinaza mitocondrială Src și fosfataza SPH2, care scade fosforilarea tirozinei în regiunea activă a multor enzime mitocondriale [112]. În leziunile I/R microvasculare cardiace, s-a constatat că inhibarea generației ROS inversează transcripția și expresia supravieținei [113], o proteină anti-apoptotică.
Nu în ultimul rând, deteriorarea mtROS este responsabilă pentru declanșarea morții/pierderii celulare în timpul I/R cardiac. Se raportează că poate apărea dinamica bifazică a mtROS, care include creșterea treptată a mtROS urmată de blițul mtROS. De remarcat, creșterea și acumularea mtROS de bază ar putea fi un semnal de activare pentru blițul mtROS, care a fost definit ca un fenomen bine cunoscut și important al eliberării ROS induse de ROS, descrisă mai întâi de Zorov și colab. în cardiomiocite [114]. Cu toate acestea, acest punct nu a fost validat în leziunile I/R microvasculare cardiace. În plus, mecanismul molecular care stă la baza creșterii și acumulării mtROS inițiale rămâne necunoscut.
3. Fisiunea mitocondrială
Rolul fisiunii și fuziunii mitocondriale în leziunea ischemiei/reperfuziei (I/R) cardiace microvasculare. Creșterea fisiunii mitocondriale este urmată de afectarea mitocondrială, inhibarea proliferării, apoptoza și inflamația vasculară. În schimb, fuziunea mitocondrială crește rezistența microcirculației cardiace împotriva leziunilor I/R.
4. Fuziune mitocondrială
5. Mitofagie
Prezentare generală a stresului oxidativ mitocondrial și a dinamicii mitocondriale în leziunile I/R microvasculare cardiace. Rețeaua mitocondrială este în permanență remodelată de activitatea antagonică a proteinelor care mediază fisiunea, cum ar fi factorul de fisiune mitocondrială (Mff), proteina fisiunii mitocondriale 1 (Fis1) și proteina asemănătoare cu dinamina 1 (Drp1) și proteinele care promovează fuziunea, precum ca mitofusină 1 (Mfn), Mfn2 și proteină optică de atrofie 1 (Opa1). Unul dintre rolurile esențiale ale fisiunii este de a separa mitocondriile disfuncționale, permițând astfel preluarea lor de către mașinile autofagice și degradarea consecventă a lizozomilor. Parkin, parkin RBR E3 ubiquitin protein ligase; PINK1, proteina kinază putativă 1 indusă de PTEN; Fundc1, Fun14 care conține domeniul proteinei 1.
Mitofagia este degradarea selectivă a mitocondriilor deteriorate de către autofagie. În acest proces, mitocondriile sunt sechestrate în autofagozomi și livrate lizozomilor pentru degradare hidrolitică [165]. Fiziologic, mitofagia joacă roluri esențiale în dezvoltare, inclusiv îndepărtarea completă a mitocondriilor deteriorate pentru a menține homeostazia rețelei mitocondriale [166]. Mitofagia anormală exacerbează leziunile mitocondriale și moartea celulară prin inducerea epuizării ATP și necroza mitofagiei dependente sau moartea celulelor mitofagice [167,168]. La fel ca autofagia, mitofagia împărtășește mașina moleculară centrală cu autofagia, care este inițiată prin nucleația unei membrane de izolare, iar apoi membrana de izolare se prelungește și se închide pentru a forma un autofagozom [169]. Originea membranelor autofagozomului rămâne încă controversată, în timp ce formarea autofagozomului este reglementată de două sisteme de conjugare asemănătoare ubiquitinei [170,171,172], Atg12-Atg5 și Atg8-PE. Cu toate acestea, spre deosebire de mitofagie, autofagia este considerată ca un proces de degradare în masă neselectiv, în care autofagozomii înghit conținuturi aleatorii în citosol [173,174]. Inducția și reglarea mitofagiei sunt reglementate de căi dependente de receptor sau de căi independente.
Cea mai recunoscută cale mitofagică în celulele mamiferelor este mediată de PINK1 și Parkin, o cale independentă de receptor [175]. PINK1, o serină/treonin kinază, este importată constitutiv în membrana interioară prin secvența țintă mitocondrială. În condiții normale, PINK1 este scindat în primul rând de membrana interioară protează asemănătoare romboidului asociat cu presenilina PARL și în cele din urmă degradată proteolitic [176]. La deteriorarea mitocondrială, cum ar fi depolarizarea potențială a membranei mitocondriale, degradarea PINK1 este suprimată și, astfel, întreaga lungime a PINK1 se acumulează pe membrana exterioară mitocondrială [177]. Ulterior, PINK1 îl recrutează pe Parkin din citosol în mitocondrii [178]. După localizarea pe mitocondrii, Parkin ubiquitinează proteinele membranei mitocondriale, cum ar fi mitofusinele [179]. p62 este, de asemenea, recrutat de Parkin la mitocondriile ubiquitinate pentru a promova livrarea mitocondriilor ubiquitinate la autofagozom prin legarea la LC3. De remarcat, Parkin poate interacționa direct cu proteine care reglează autofagia, cum ar fi Ambra1, pentru a facilita mitofagia [180].
6. Concluzie și perspective de viitor
Mulțumiri
Mulțumim lui Jun Ren de la Universitatea din Wyoming și lui Yundai Chen din Spitalul General PLA pentru discuțiile lor utile.
- Gustări nocturne, stres și migrenă
- Medicamente cardiace pediatrice Lasix - specialiști în cardiologie pediatrică
- Rolurile vor fi inversate în noul climat economic
- Tăcerea vițeilor; Înțărcarea fără Bawl economisește stresul și banii; El pășune
- Răspunsul general la stres depinde de SigB în Bacillus subtilis și bacteriile gram-pozitive înrudite