Obezitatea și insuficiența cardiacă (IC) sunt două probleme de sănătate publică. Mai mult, obezitatea poate contribui la IC (1). Fiecare contribuie la creșterea mortalității. În schimb, scăderea în greutate la pacienții obezi fără IC îmbunătățește funcția diastolică și scade necesarul de oxigen și masa ventricularului stâng (VS) (2,3). În două studii de amploare, pierderea în greutate indusă de operație a redus moartea cardiacă și a îmbunătățit supraviețuirea la oameni (4,5), dar nu se știe câți au suferit de IC. Așadar, medicii ar trebui să recomande pierderea în greutate, corect?
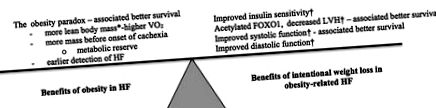
Problema este - există un paradox. Aceasta este „frecarea”. „Paradoxul obezității” se bazează pe datele rezultatelor care arată că pacienții care sunt obezi și au IC trăiesc mai mult decât pacienții care nu sunt obezi (Fig. 1). Există mai multe motive posibile ale paradoxului (recenzate recent de Lavie și colab. [6]). Pacienții cu IC de obezitate pot fi diagnosticați mai devreme; nu suferă de cașexie; pot avea, de asemenea, un avantaj, deoarece pornesc de la o greutate corporală mai mare înainte de a începe cașexia bolii cronice (IC); și/sau pot exista și alte beneficii ale țesutului muscular adipos și slab. Indiferent de mecanism, paradoxul ne lasă o enigmă: să recomandăm sau nu pierderea în greutate pacienților cu IC obezită.
Un rezumat al efectelor benefice concurențiale ale obezității și ale pierderii intenționale de greutate. * Modelul murin în studiul realizat de Sankaralingam și colab. (7) nu a arătat o schimbare a masei corporale slabe cu pierderea intenționată în greutate. Majoritatea studiilor la om arată o masă corporală slabă mai mare la obezitate și o scădere odată cu pierderea în greutate. † Modificări observate în studiu de Sankaralingam și colab. (7).
Studiul realizat de Sankaralingam și colab. (7) în acest număr al diabetului ne oferă mai multe informații atât despre efectele obezității induse de dietă, cât și despre pierderea în greutate asupra inimii care se defectează. În acest studiu, obezitatea și IC au fost induse într-un model murin prin hrănire bogată în grăsimi și constricție aortică abdominală. Acestea au dus la creșterea hipertrofiei ventriculare stângi (LVH), disfuncție diastolică și rezistență la insulină miocardică. Nu a fost clar dacă inima poate deveni rezistentă la insulină la un animal modificat nongenetic. Un studiu pe diabetul de tip 1 uman a sugerat că numai mușchiul scheletic - nu inima - ar putea deveni rezistent la insulină (8). Cu toate acestea, pe baza datelor din studiul realizat de Sankaralingam și colab., Inima poate deveni rezistentă la insulină (7). Autorii demonstrează acest lucru prin măsurarea modificărilor oxidării glucozei miocardice și prin demonstrarea modificărilor adecvate ale căilor de semnalizare a insulinei, cum ar fi expresia crescută a SOCS3. În mod interesant, studiul continuă să arate că nici piruvatul dehidrogenază kinază 4, nici piruvatul dehidrogenază fosforilată nu s-au schimbat odată cu creșterea obezității. Astfel, autorii sugerează că scăderea legată de obezitate a oxidării glucozei miocardice a rezultat din creșterea oxidării acizilor grași miocardici prin ciclul Randle.
Scăderea în greutate indusă de o dietă cu conținut scăzut de grăsimi și hipocalorice (7) a inversat multe dintre aceste modificări ale HF legate de obezitate. LVH a regresat după pierderea în greutate și a fost însoțită de acetilarea crescută a FOXO1 (un mediator cheie al hipertrofiei) și creșterea expresiei atroginei-1 (7). Funcția diastolică s-a îmbunătățit și sensibilitatea la insulină a crescut (7), aceasta din urmă însoțită de activarea STAT3, scăderea expresiei SOCS3 și creșterea expresiei GLUT4.
Mulțumiri
Finanțarea. Cercetarea L.R.P. este susținut de finanțare de la Institutele Naționale de Sănătate (P20 HL113444-01 și R01 HL107406-01A1).
Dualitatea interesului. Nu au fost raportate potențiale conflicte de interese relevante pentru acest articol.
- Pierderea intenționată a greutății va îmbunătăți funcția inimii în insuficiența cardiacă Dr.
- Pierderea în greutate 3 băuturi delicioase de detoxifiere pentru a vă ajuta să slăbiți și să ardeți grăsimea abdominală Sfaturi și știri despre sănătate
- Pierderea în greutate Poate această tehnică ciudată de fitness să vă ajute să pierdeți grăsimea abdominală Fit; Bine
- De ce tăierea drastică a caloriilor nu te va ajuta să slăbești; Neuronii pot bloca eforturile de dietă
- A-ți păcăli creierul te poate ajuta să slăbești mai repede - Times of India