Abstract
În fiecare an, aproximativ 600.000 de cazuri noi de lepră sunt diagnosticate în întreaga lume. Spectrul bolii variază foarte mult de la forme limitate de tuberculoizi la forme lepromatoase extinse. O măsură a riscului de a dezvolta forme de lepromă este oferită de gradul de reactivitate a pielii la lepromină (reacția Mitsuda). Pentru a aborda un control oligogen postulat al patogenezei leprelor, am studiat în prezentul studiu legătura susceptibilității leprelor, a subtipurilor clinice de lepră și a extinderii reacției Mitsuda la șase regiuni cromozomiale care poartă loci cunoscuți sau suspectați de sensibilitate la lepră. Singurul rezultat semnificativ obținut a fost legarea subtipului clinic de lepră cu regiunea HLA/TNF pe cromozomul uman 6p21 (Pcorectat = 0,00126). În plus, am stabilit că în cadrul aceleiași familii diferite haplotipuri HLA/TNF se separă în pacienți cu subtipuri de lepră diferite, demonstrând în mod direct importanța acestei regiuni a genomului pentru controlul prezentării clinice a leprei.
Introducere
Lepra este o boală infecțioasă cronică în principal a pielii și a nervilor cauzată de agentul patogen intracelular cu creștere lentă Mycobacterium leprae. 1 Boala afectează în prezent aproximativ 1,4 milioane de persoane, majoritatea pacienților găsiți în India și Brazilia. 2 În clasificarea clasică Ridley - Jopling, 3 cazuri de tuberculoid (TT) și lepromatoasă (LL) ocupă capetele opuse ale unui spectru continuu de manifestări ale bolii. Cazurile TT arată implicarea a puține leziuni cutanate bine definite, cu bacili rari în piele și nervi și prezența unui anti puternic-M. leprae imunitatea mediată de celule. Cazurile LL prezintă leziuni extinse ale pielii, prezența a numeroși bacili în piele și nervi și anergie la M. leprae antigen. Un test clinic pentru a măsura calitatea anti-M. leprae răspunsurile imune sunt așa-numita reacție „Mitsuda” la căldură injectată intradermic M. leprae bacili (lepromin). Un răspuns pozitiv indică un risc scăzut de dezvoltare a leprei lepromatoase, în timp ce lipsa de reacție a leprominei se găsește la persoanele cu risc crescut de a dezvolta forma lepromatoasă de lepră 4 .
Obiectivul prezentului nostru studiu a fost de a descifra în continuare sistemul genetic implicat în controlul patogeniei leprei. În special, am fost interesați de identificarea genelor de susceptibilitate care ar acționa paralel cu NRAMP1 genă la populația vietnameză care demonstrează în mod direct caracterul oligogen al susceptibilității la lepră. Am abordat problema testând șase regiuni cromozomiale, cunoscute sau sugerate să poarte loci de susceptibilitate la lepră, pentru legătura cu trei fenotipuri de lepră diferite (adică lepră) în sine, subtip lepros și întinderea reactivității Mitsuda) într-un grup de 20 de familii de lepră multiplex. Mai exact, am testat pentru o posibilă contribuție la susceptibilitatea leprosului a regiunii cromozomiale 10p13 sugerată să poarte o genă de susceptibilitate la lepră printr-o scanare recentă, 13 regiunea cromozomului 17 adăpostind VDR gena, 14 the HLA/TNF regiune pe cromozomul 6, 18, precum și receptorul factorului de necroză tumorală 1 și receptorul 2 (TNFR1 și TNFR2) regiunile de pe cromozomul 12 și respectiv cromozomul 1 și regiunea clusterului de citokine de pe cromozomul 5q.
Rezultate
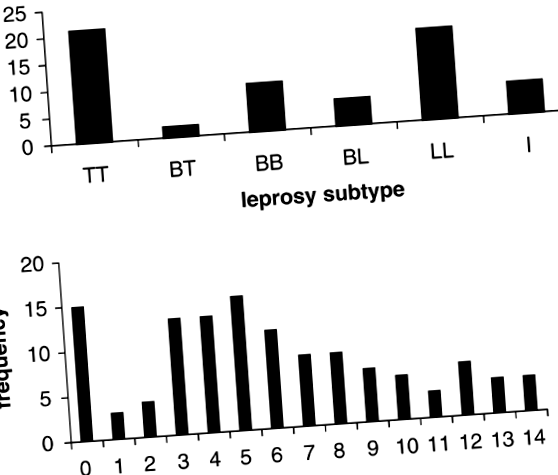
Cele 20 de familii nucleare incluse în studiu au cuprins 118 frați (59 cu lepra și 59 sănătoși) cu fenotipuri disponibile și date moleculare. Distribuția numărului de familii în funcție de subtipurile clinice ale copiilor afectați este afișată în Tabelul 1. Marea majoritate a pacienților prezentați ca cazuri de tuberculoid (TT: 35%) sau lepromatoase (LL: 28%) reprezentând cele două capete opuse în spectrul subtipurilor clinice de lepră (Figura 1a). Amploarea reacției Mitsuda a fost cunoscută pentru toți frații și a fost utilizată pentru a testa loci suplimentari implicați posibil în controlul genetic al reacției leprominului. Distribuția reacției Mitsuda codificată ca fenotip cantitativ este prezentată în Figura 1b. Distribuția corespunzătoare atunci când se utilizează o definiție categorică ordonată în patru clase a fost 22, 41, 38 și 17 pentru prima clasă (⩾ 10 mm), respectiv.
Distribuția fenotipurilor clinice între descendenții celor 20 de familii studiate. (A) distribuția subtipurilor de lepră între 59 de descendenți afectați de lepră (TT = tuberculoid, BT = tuberculoid limită, BB = limită, BL = lepromatos limită, LL = lepromatos, I = nedeterminat). (b) Distribuția reacțiilor Mitsuda observate între 118 descendenți (59 de cazuri de lepră; 59 de frați sănătoși).
Exemplu de segregare a HLA/TNF haplotipuri în rândul a două familii de lepră. TNFp desemnează TNF (-308) G/A promotor polimorfism; TNFa și TNFb sunt doi markeri microsateliți localizați în vecinătatea TNF genă. Denumirile familiale sunt date în partea stângă sus a fiecărui pedigree și starea bolii subiectului (goală, neafectată; TT, tuberculoid; LL, lepromatoasă; BB, borderline) este dată în fiecare simbol genealogic. Denumirile de alele date sunt atribuite în mod arbitrar numere de alele care se separă în familii.
Discuţie
Trei fenotipuri care reflectă diferite aspecte ale patogenezei leprei au fost alese pentru analiza genetică: lepra în sine, tipul de lepră și amploarea reactivității pielii Mitsuda numită și reactivitatea leprominei. Ultimul fenotip este de interes, deoarece reactivitatea leprominului a fost legată de riscul de a dezvolta forma LL a bolii și de a prezenta reacții de inversare de tip I. 20 Reacțiile de hipersensibilitate de inversare de tip I sunt, la rândul lor, o cauză majoră a afectării funcției nervoase a leprei. 1 Legătura acestor trei fenotipuri de susceptibilitate cu șase regiuni cromozomiale a fost testată în 20 de familii de lepră multiplex. În aceleași familii, am detectat anterior un efect genetic al NRAMP1 regiunea cromozomială pe regiunea cromozomială 2q35 pe susceptibilitatea la lepră 9 și amploarea testului Mitsuda. 4
Niciuna dintre regiunile candidate nu a prezentat dovezi semnificative pentru legătura cu reacția imună, măsurată prin testul cutanat cu lepromin. Mai ales neașteptată a fost lipsa legăturii cu HLA/TNF regiune deoarece se crede pe scară largă că HLA alelele sunt elemente majore de control genetic ale imunității anti-micobacteriene. În schimb, am detectat anterior un impact puternic al NRAMP1 regiune cromozomială pe același răspuns imun. 4 Exemplul controlului genetic al reactivității leprominului arată în mod clar că mecanismele genetice majore de declanșare a răspunsurilor imune anti-micobacteriene pot fi localizate în afara HLA/TNF complex așa cum a sugerat anterior alte studii. 21
Prezentul studiu a detectat segregarea non-aleatorie a HLA/TNF haplotipuri la pacienți cu diferite forme de lepră. Datorită legăturii strânse dintre TNF cu HLA genele de clasa I și clasa II nu este posibil să se ajungă la o anumită genă ca cauză a distorsiunii de segregare observate. Cel mai cunoscut polimorfism care afectează activitatea biologică a TNF este TNF−308 G/A SNP. Prin urmare, legătura nesemnificativă rezultă cu subtipurile de lepră obținute pentru TNF −308 promotor și TNFR polimorfismele argumentează împotriva unui rol major al TNF alele în procesele patogenetice care duc în cele din urmă la diferite prezentări clinice de lepră. Din aceste considerente, concluzionăm că segregarea părtinitoare a HLA/TNF regiunea în descendenți cu diferite forme clinice de lepră în cadrul aceleiași familii este cauzată în principal de HLA genele regiunii, altele decât TNF, cel mai probabil HLA variante genice de clasa II.
Subiecte și metode
Familii
Familiile nucleare studiate corespund eșantionului identificat din evidențele Spitalului de Dermatologie din orașul Ho Chi Minh și utilizat anterior pentru a efectua o analiză de legătură cu NRAMP1 genă. 4.9 Acest eșantion familial include 20 de familii nucleare (118 copii, 59 cu lepră) cu cel puțin doi frați afectați de lepră. Raportul dintre vietnamezi (16 familii) și chinezi (patru familii) reflectă aproximativ proporția ambelor grupuri etnice din registru. Aprobarea studiului a fost obținută de la autoritățile sanitare din orașul Ho Chi Minh, Vietnam și de către comisia de revizuire instituțională de la Institutul de cercetare al Centrului de sănătate al Universității McGill (MUHC), Montreal, Canada.
Definiția fenotipului
Diagnosticul leprei a fost făcut de cel puțin doi leprologi independenți și cu experiență după examinarea fizică a fiecărui pacient (în special numărul și aspectul leziunilor cutanate, prezența sau absența anesteziei și s-au înregistrat o evaluare a nervilor periferici) și examinarea histopatologică leziuni cutanate afectate. Deoarece cohorta pacientului conținea cazuri multibacilare, confirmarea microbiologică a diagnosticului clinic și histopatologic prin bacili acid-rapid a fost posibilă la aproximativ jumătate dintre pacienți. Subtipul clinic a fost definit în conformitate cu sistemul de cinci grupe Ridley și Jopling. 3
Toate reacțiile Mitsuda au fost efectuate de leprologi vietnamezi cu experiență și au fost citite la 28-30 de zile după injectarea intradermică a 0,1 ml de lepromin în suprafața volară a antebrațului. Reacția Mitsuda a fost măsurată la 118 copii (inclusiv indivizi sănătoși) aparținând a 20 de familii nucleare cu dimensiuni de fraternitate variind de la 2 la 12. Cu toate acestea, din cauza constrângerilor de calcul, numărul maxim de frați pe familie a fost limitat la nouă. Prin urmare, pentru cele două familii cu 10 și 12 frați, am eliminat cel mai mic și, respectiv, cei trei tineri frați neafectați. Pentru analize suplimentare, reacția întârziată a leprominei a fost considerată mai întâi ca o trăsătură cantitativă, variind de la 0 la 14 mm. De asemenea, am codificat reacția Mitsuda ca o trăsătură categorică de patru clase: ⩾ 10 mm. Punctele de tăiere de 3 și 5 mm sunt definite în urma recomandărilor celui de-al șaselea Congres Internațional de lepră desfășurat la Madrid (1953), iar ultimul (adică 10 mm), după cum a sugerat ulterior languillon. 30 O reacție Mitsuda ⩾ 10 mm este clar pozitivă.
Genotipare
Dintre cei 16 markeri utilizați în studiu, 13 au fost markeri de repetare microsateliți și trei au fost polimorfisme cu nucleotide unice (SNP).
SNP: Două SNP situate la poziția nucleotidică 1056 în capătul 3 ′ și poziția nucleotidică 117 în exonul 2 al VDR gena (numărul de acces XM_007046; markerii VDR-1056 și respectiv VDR-117) au fost evaluați prin PCR-RFLP. Regiunea SNP VDR-1056 C/T a fost amplificată folosind primerii descriși de Roy și colab. 14 Produsul de amplificare rezultat a fost digerat cu 1,5 unități de TaqEnzima de restricție I timp de 6 ore la 65 ° C și compoziția alelică la locusul VDR-1056 a fost obținută prin dimensionarea fragmentelor pe un gel de agaroză 2,5%. SNP VDR-117 T/C a fost genotipat folosind primerii și condițiile descrise de Scott și colab. 33 În cele din urmă, TNF-(-308) SN/G/A a fost genotipat prin intermediul unei analize de 5 ′ nuclează 34,35 folosind primerul înainte, 5 ′ IndexTerm CCAAAAGAAATGGAGGCAAT3 ′, primerul invers, 5 ′ IndexTerm GCCACTGACTGATTTGTGTGT3 ′ și 5 ’IndexCCAATTGAT-TAM 5 'IndexTerm TET-CCG TCCTCATGCCCCTCAAA-TAMRA3' ca oligonucleotide specifice alelei. Apelarea genotipurilor s-a bazat pe raportul FAM/TET așa cum se citește într-un spectrometru de fluorescență Perkin-Elmer LS-5B cu lățimi de fantă de 5 nm.
metode statistice
Analiza legăturii a fost efectuată utilizând abordarea MLB care poate gestiona binar (adică afectată vs. neafectate), categorice (subtipuri de lepră și Mitsuda categorică) și cantitative (Mitsuda cantitativă) fenotipuri. 4. În plus față de posibilitatea de a analiza mai multe tipuri de fenotip, această metodă oferă trei proprietăți interesante care au fost solicitate aici: (i) este o metodă de analiză a legăturii fără model genetic, adică nu trebuie să specificăm modelul genetic care, în contextul leprei, rămâne necunoscut; (ii) nu este nevoie să descompună frățile în perechile sale constitutive, un proces despre care se știe că umflă rata de eroare de tip I (de exemplu, vezi Holmans 36) și 18 din cele 20 de familii ale noastre conțin mai mult de doi frați; (iii) în contextul fenotipurilor cantitative, MLB nu este sensibil la distribuția fenotipică (în special nu presupune normalitate multivariată), așa cum arată studiile de simulare mari 37 .
Pentru a analiza lepra binară în sine fenotip (afectat/neafectat), am folosit abordarea MLB pentru trăsături binare. 38.39 Testul de legătură MLB este un test al raportului de probabilitate care poate fi exprimat ca o statistică standard unilaterală normală denotată ca ZMLB.
Analiza trăsăturilor cantitative și categorice a fost efectuată utilizând extensiile corespunzătoare ale metodei MLB. 40,41 Aceste extensii se bazează pe introducerea unei variabile binare latente individuale care captează informațiile de legătură dintre trăsătura cantitativă observată și marker. În contextul fenotipurilor Mitsuda (codificate ca cantitative sau categorice), o valoare de 0 (respectiv 1) pentru această variabilă binară poate fi înțeleasă ca un rezultat Mitsuda negativ (absolut pozitiv) (respectiv pozitiv). Metoda trebuie să precizeze probabilitatea valorii variabilei latente (adică având o reacție negativă sau pozitivă) în funcție de fenotipul observat. Pentru analiza Mitsuda cantitativă am utilizat o distribuție normală cumulativă standard, așa cum a propus Alcais și Abel. 40 Pentru analiza categoriei Mitsuda am stabilit probabilitatea de a avea o valoare 0 la 1, 0,75, 0,25 și 0 pentru fenotipurile care aparțin primei clase (⩾ 10 mm), respectiv, așa cum s-a sugerat deja într-un studiu anterior. 4
Pentru subtipul de lepră am folosit aceeași abordare ca și pentru fenotipul Mitsuda categoric. În acest caz, valoarea 0 poate fi înțeleasă ca un caz de tuberculoid „absolut”, iar simetric valoarea 1 corespunde unui caz lepromatos „absolut”. Am stabilit probabilitatea de a avea o valoare 0 la 1, 0,75, 0,5, 0,5, 0,25 și 0 pentru TT, tuberculoid limită (BT) limită limită (BB), nedeterminată (I), lepromatoasă limită (BL) și, respectiv, LL, pentru indivizii BB sau I, probabilitatea de a fi TT este egală cu probabilitatea de a fi LL, adică 0,5). Din nou, testul pentru legătură este un test al raportului de probabilitate exprimat ca o deviație normală standard unilaterală, notată ZMLBQ și ZMLBC pentru fenotipuri cantitative și respectiv categorice.
Analiza legăturii multipunct a fost realizată utilizând o extensie a metodelor anterioare care a fost implementată într-un program extins GENEHUNTER 42 disponibil la cerere. În cele din urmă, pentru a explica mai multe comparații, am corectat cele observate P-valorile prin corecția Bonferroni. De când au fost investigate șase regiuni independente (HLA/TNF regiune, regiune cromozomială 5q, TNFR regiuni, regiunea cromozomului 10p și VDR regiune), valoarea p corectată (denumită pc) a fost de șase ori cea observată P-valoare (de ex. o observată P-valoarea 0,01 corespunde a Pc de 0,06).
- Rolul nucilor de caju și al altor nuci în gestionarea diabetului O REVizuire CLINICĂ PharmaTutor
- Pierdere rapidă în greutate 3 zile dovadă clinică 2020 Vânzare la cald Molly Tarlov Pierdere în greutate MUDMAN
- Cașexia, sarcopenia și inactivitatea pierderii mușchilor scheletici The American Journal of Clinical
- Modelul rus legat de Mick Jagger dă înapoi la pretențiile că perechea este un obiect - Mirror Online
- Studiați mestecarea excesivă a gumei fără zahăr legată de pierderea severă în greutate, diareea Fox News