Michael Brown
1 1 Departamentul de Medicină, Universitatea din Liverpool, PO Box 147, Liverpool, L69 3GA
Chen Bing
1 1 Departamentul de Medicină, Universitatea din Liverpool, PO Box 147, Liverpool, L69 3GA
Peter King
1 1 Departamentul de Medicină, Universitatea din Liverpool, PO Box 147, Liverpool, L69 3GA
Lucy Pickavance
1 1 Departamentul de Medicină, Universitatea din Liverpool, PO Box 147, Liverpool, L69 3GA
David Heal
2 2 Knoll Pharmaceuticals Research and Development, Nottingham, NG1 1GF
John Wilding
1 1 Departamentul de Medicină, Universitatea din Liverpool, PO Box 147, Liverpool, L69 3GA
Abstract
Am studiat efectele noului inhibitor al recaptării noradrenalinei și serotoninei (5-HT) sibutramina asupra hrănirii și greutății corporale într-un model de obezitate dietetică și dacă interacționează cu neuronii neuropeptidici hipotalamici Y (NPY).
Șobolanilor masculi Wistar hrăniți și obezi din dietă (DIO) li s-a administrat sibutramină (3 mg kg -1 zi -1 p.o.) sau apă deionizată timp de 21 de zile.
Sibutramina a scăzut aportul de alimente pe toată durata tratamentului la ambii șobolani dietetici-obezi (P Cuvinte cheie: Obezitate, sibutramină, HOMA, leptină, neuropeptidă Y.
Introducere
Sibutramina (BTS 54 524; clorhidrat de N-N, N-dimetilamină monohidrat) este un medicament anti-obezitate nou 5-HT și inhibitor al recaptării noradrenalinei (SNRI) (Stock, 1997), care a fost recent autorizat pentru tratamentul obezității în mai multe țări . Se crede că mecanismele pierderii în greutate induse de sibutramină includ îmbunătățirea sațietății (Halford și colab., 1998) și o creștere a termogenezei (Connoley și colab., 1999; Hansen și colab., 1998; McNeely și Goa, 1998). Sibutramina reduce semnificativ comportamentul de hrănire și este eficientă în inducerea pierderii în greutate la rozătoarele slabe și obeze genetic (Stricker-Kongrad și colab., 1995). Mai mult, îmbunătățește toleranța la glucoză și scade nivelul insulinei plasmatice la aceste animale, ceea ce înseamnă că sibutramina poate îmbunătăți sensibilitatea la insulină (Day și Bailey, 1998).
Pre-tratamentul cu antagoniști de 5-HT sau noradrenalină poate inversa parțial sau complet efectul hipofagic al sibutraminei, indicând faptul că ambii neurotransmițători sunt implicați în acțiunile sale farmacologice. În plus, fluoxetina și nisoxetina, care sunt inhibitori selectivi ai recaptării 5-HT și respectiv a noradrenalinei, nu au niciun efect asupra consumului de alimente atunci când sunt administrați singuri, dar inhibă profund aportul de alimente atunci când sunt administrați în combinație (echivalent cu acțiunea sibutraminei), demonstrând o sinergie interacțiunea celor două monoamine în controlul comportamentului ingestiv (Jackson și colab., 1997a). Utilizarea antagoniștilor selectivi ai monoaminei a confirmat că efectele acute de inducere a sațietății sibutraminei implică adrenoceptori α1 și β1, precum și receptori 5HTc și posibil 5HT2A (Jackson și colab., 1997b). Deoarece nici sibutramina și nici cei doi metaboliți ai săi nu prezintă afinitate pentru receptorii α1, β1 sau 5HT, medicamentul pare să îmbunătățească funcția monoaminergică prin inhibarea absorbției noradrenalinei și 5HT (Heal și colab., 1998).
5-HT acționează asupra hipotalamusului pentru a provoca anorexie, pierderea în greutate (Blundell și colab., 1995) și creșterea termogenezei (Le Feuvre și colab., 1991). Un număr mare de peptide și alți neurotransmițători găsiți în hipotalamus au efecte asupra echilibrului energetic, inclusiv neuropeptida Y (NPY), galanina, hormonul stimulator al melanocitelor (prin receptorul melanocortinei-4) și recent transcriptul legat de cocaină și amfetamină (CART) și colab., 2000). Există dovezi care sugerează că acțiunile anti-obezitate ale serotoninei pot fi mediate prin inhibarea neuronilor hipotalamici care exprimă puternica peptidă stimulatoare a apetitului NPY (Dryden și colab., 1996; Rogers și colab., 1991) și, prin urmare, acest studiu este concentrat pe posibila implicare a NPY în medierea efectelor sibutraminei asupra echilibrului energetic.
Spre deosebire de modelele de șobolani, majoritatea obezității umane este poligenică și se datorează dificultății în reglarea aportului în fața unei disponibilități crescute de alimente foarte gustabile și a scăderii activității fizice (Andersson, 1996). Șobolanii hrăniți cu o dietă foarte plăcută dezvoltă obezitate moderată, care la fel ca majoritatea obezității umane este asociată (cel puțin la animalele mai tinere), cu aport crescut de alimente, termogeneză crescută și rezistență la insulină (Stock & Rothwell, 1986). Prin urmare, am ales acest model pentru studiile noastre, care au fost concepute pentru a răspunde la următoarele întrebări, dacă sibutramina este eficientă în reducerea greutății corporale în DIO și, în al doilea rând, dacă sibutramina a îmbunătățit rezistența la insulină în acest model și, în cele din urmă, dacă efectele sibutraminei au fost mediate în parte prin modularea neuronilor NPY hipotalamici.
Metode
Animale
Nouăzeci și șase de șobolani Wistar masculi (150 - 200 g; A. Tuck și Sons, Cambridge, Marea Britanie), au fost alocați aleatoriu în două grupuri conținând fiecare 48 de șobolani și adăpostiți individual în cuști cu fund de sârmă într-o cameră menținută la 22 ° C, la iluminarea fazei inversate 12 h întuneric: ciclu de lumină (luminile aprinse la 0300 h). Patruzeci și opt de șobolani au fost hrăniți cu o dietă foarte plăcută timp de 12 săptămâni, care a constat din 33% chow (CRM, Biosure, Cambridge, Marea Britanie) 33% lapte Nestlé (Nestlé, Marea Britanie), 7% zaharoză (Tate & Lyle, Marea Britanie) și 27 % apă din robinet în greutate. Această dietă produce o creștere fiabilă în greutate față de controale, oferind 68% din energie sub formă de carbohidrați, 16% sub formă de proteine și 13% sub formă de grăsimi (Wilding și colab., 1992b). Restul de 48 de animale au avut acces gratuit la chow peletat standard (CRM, Biosure, Cambridge, Marea Britanie), care furnizează 76,8% din energie sub formă de carbohidrați, 19,2% ca proteină și 4,3% ca grăsime.
Proceduri de tratament
După cele 12 săptămâni de manipulare dietetică, 16 animale din fiecare grup au primit fie sibutramină, hrănite în pereche pentru a se potrivi cu aportul de animale tratate cu sibutramină, fie tratate numai cu vehicul. Sibutramina HCI a fost sintetizată la Knoll Pharmaceuticals (Nottingham, Marea Britanie) și a fost dizolvată în apă deionizată, volum de doză 1 ml kg -1 și a fost administrată la 1200 ore zilnic în doză de 3 mg kg -1 zi -1 -1 p.o. prin gavaj pentru o perioadă de 21 de zile. Această doză s-a dovedit anterior a fi eficientă în reducerea consumului de alimente la șobolan și reduce consumul de alimente cu 50% pe o perioadă de 2 ore (Jackson și colab., 1997a). Controalele slabe și obeze din dietă au primit în mod similar un volum egal de apă deionizată. Greutatea corporală și aportul de alimente au fost măsurate imediat înainte de administrarea medicamentului în fiecare zi pe parcursul perioadei de tratament.
La sfârșitul studiului, șobolanii au fost uciși prin inhalarea dioxidului de carbon și exsanguinați imediat prin puncție cardiacă. Plasma a fost depozitată la -40 ° C pentru măsurarea ulterioară a concentrațiilor de leptină, insulină și glucoză. Țesutul adipos alb epididimal și perirenal împreună cu mușchiul gastrocnemius au fost disecați și cântăriți, pentru a permite calcularea raportului grăsime/slab. Toate procedurile la animale au fost efectuate în conformitate cu Regatul Unit. Regulamentele Home Office, sub autoritatea licenței de proiect relevante.
Microdisecție hipotalamică
Pentru măsurarea ARNm-ului NPY, (n = 8 animale pe grup), un bloc de țesut hipotalamic mediobasal a fost disecat dintr-o felie de creier frontal tăiată între chiasma optică mijlocie și corpurile mamilare. Blocul s-a extins lateral către nucleul perihipotalamic și superior către comisura anterioară; ARC este singurul site care conține niveluri semnificative de ARNm NPY în aceste limite. Țesutul a fost imediat înghețat rapid în azot lichid și depozitat la -80 ° C până la extracția ulterioară a ARN-ului.
Pentru măsurarea nivelurilor regionale de NPY hipotalamice, (n = 8 animale pe grup), creierul a fost îndepărtat rapid și un bloc, inclusiv hipotalamusul, a fost îndepărtat prin tăieturi verticale cu 1 mm anterior chiasmei optice și imediat posterioare corpurilor mamilare. Ulterior, opt felii frontale de 350-500 μm au fost apoi tăiate din blocul tisular, folosind un microtom vibrant, așa cum s-a descris anterior (Bing și colab., 1999). Următoarele șase zone selectate au fost microdisecate, prin perforare cu un ac contondent cu calibru 18: PVN, MPO, VMH, DMN, LHA și ARC (inclusiv eminența mediană). Țesutul din fiecare zonă din fiecare șobolan a fost grupat și fiert timp de 10 minute în 400 pl de acid clorhidric 0,1 M, iar probele au fost sonicate timp de 30 s pentru a dispersa țesutul și a extrage NPY. Extractele au fost congelate la -40 ° C până la testarea concentrațiilor de NPY și proteine.
Analize
Concentrațiile hipotalamice regionale de NPY au fost măsurate folosind o radioimunologie internă (RIA) care a utilizat 125 I NPY porcin (pNPY; Amersham, Buckinghamshire, Marea Britanie) și pNPY ca standard (Bachem Inc, Essex, Marea Britanie). Antiserul NPY crescut în laboratorul nostru la un iepure împotriva NPY porcin, a fost utilizat într-o diluție finală de 1: 90.000. Sensibilitatea testului a fost de 2 fmol pe tub, cu un coeficient de variație intra-test (CV) M fosfat de sodiu (pH 7,0) și 7% SDS. Hibridizarea a fost la 42 ° C peste noapte în soluția de pre-hibridizare cu o oligonucleotidă 42-mer (R&D Systems, Oxon, Marea Britanie) care a fost marcată la capăt (3 'și 5') cu digoxigenină la o concentrație de 25 ng ml -1 . Spălările post-hibridizare au fost efectuate așa cum s-a descris anterior (Trayhurn și Duncan, 1994). Membrana a fost incubată cu un anticorp împotriva digoxigeninei (fragment Fab; Boehringer), care a fost conjugat cu fosfatază alcalină, timp de 30 de minute la temperatura camerei. Membrana a fost apoi pulverizată cu substrat de chimioluminescență 0,25 m M stea CDP (Tropix, MA, S.U.A.). Semnalele au fost obținute prin expunerea membranei la film cu raze X timp de 30 de minute la temperatura camerei, iar banda de 0,9 kb corespunzătoare ARNm NPY a fost cuantificată utilizând densitometrie de scanare a imaginii (AIS System, Imaging Technology, Brock University, St Catherines, Ontario, Canada).
Pentru a verifica încărcarea și transferul de ARN în timpul ștergerii, peta a fost decupată și re-sondată pentru 18S rARN cu o oligonucleotidă antisens marcată cu digoxigenină 31-mer la o concentrație de 10 pg/ml, așa cum s-a descris anterior (Trayhurn și colab., 1995). Cantitatea de ARNm NPY a fost exprimată ca raportul ARNm NPY/18S rARN.
Analize statistice
Datele sunt exprimate ca medie ± însemnând. Analitele de sânge, nivelurile de ARNm NPY au fost comparate între grupuri utilizând analiza unică a varianței (ANOVA). Pentru aportul de alimente, greutatea corporală și concentrațiile NPY în regiunile hipotalamice individuale, a fost efectuat ANOVA bidirecțional cuplat cu un test t modificat post-hoc Bonferonni pentru a determina dacă au existat diferențe semnificative între grupuri. Diferențele de grup în nivelurile NPY din nucleele individuale au fost apoi examinate în continuare prin testul t nepereche al lui Student. O valoare P de 0,05 sau mai puțin la nivelul celor două cozi a fost considerată semnificativă.
Rezultate
Efectul dietei foarte gustabile asupra greutății corporale
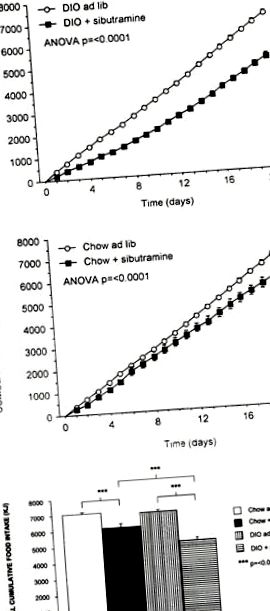
Aport cumulat de alimente la șobolani DIO (a) și chow (b) tratați oral cu sibutramină (3 mg kg -1 zi -1 p.o.) sau vehicul timp de 21 de zile. Sunt prezentate controalele DIO (n = 16), DIO tratate cu sibutramină (n = 16), controalele chow (n = 16) și chow tratate cu sibutramina (n = 16) (înseamnă ± însemnând). Aportul total cumulat de alimente pentru ambele grupuri experimentale este prezentat în (c) (n = 16) (înseamnă ± însemnând).
Greutatea corporală finală a șobolanilor DIO și hrăniți chow tratați oral cu sibutramină (3 mg kg -1 zi -1 p.o.) sau vehicul timp de 21 de zile (n = 16 per grup; înseamnă ± s.e.
Raportul grăsime/slab al DIO și șobolanii hrăniți/hrăniți tratați pe cale orală cu sibutramină (3 mg kg -1 zi -1 p.o.) sau vehicul timp de 21 de zile (n = 16 pe grup; înseamnă ± însemnând).
Concentrațiile plasmatice de leptină și analiza HOMA
Nivelurile de leptină plasmatică au fost de 3 ori mai mari (P Figura 4). Sibutramina a provocat o scădere de 63% a nivelului de leptină la persoanele obeze din dietă (P Figura 4).
Nivelurile de leptină plasmatică de DIO și șobolani hrăniți cu chow tratați oral cu sibutramină (3 mg kg -1 zi -1 p.o.) sau vehicul timp de 21 de zile (n = 12 per grup; înseamnă ± medie).
Indicele HOMA al șobolanilor DIO și hrăniți cu chow tratați oral cu sibutramină (3 mg kg -1 zi -1 p.o.) sau vehicul timp de 21 de zile (n = 12 per grup; înseamnă ± însemnând).
Nivelurile de ARNm hipotalamic NPY și NPY
Nivelurile de ARNm hipotalamic NPY au fost neschimbate la șobolanii obezi din dietă comparativ cu șobolanii hrăniți cu chow (P = ns) (Tabelul 1). Nu au existat modificări semnificative ale nivelurilor de ARNm NPY asociate cu tratamentul cu sibutramină sau hrănirea în pereche a animalelor (Tabelul 1).
tabelul 1
Modificări ale ARNm hipotalamic NPY total și concentrații de peptidă NPY în nuclei hipotalamici individuali după manipularea dietei și tratamentul cu sibutramină
Concentrațiile de NPY în cele șase regiuni hipotalamice la șobolanii martor obezi din dietă și hrăniți cu chow tratați cu sibutramină (n = 8) sau deionizați (n = 8) sau hrăniți în perechi (n = 8) timp de 21 de zile sunt prezentate în Tabelul 1 . ANOVA cu două căi a dezvăluit că nu au existat efecte semnificative atribuite grupului. Nici tratamentul cu sibutramină sau hrănirea în perechi nu au avut vreun efect semnificativ asupra concentrațiilor de NPY din nucleii hipotalamici individuali (Tabelul 1).
Discuţie
Rezultatele noastre arată că sibutramina atenuează semnificativ aportul de alimente și creșterea în greutate corporală la șobolanii Wistar cu obezitate alimentară. În plus, această pierdere în greutate este însoțită de epuizarea depozitelor de grăsime corporală. Tratamentul cu sibutramină ameliorează, de asemenea, rezistența la insulină observată în acest model de obezitate. Cu toate acestea, spre deosebire de agenții de eliberare a serotoninei studiați anterior (Dryden și colab., 1996; Rogers și colab., 1991), sibutramina nu pare să medieze aceste efecte prin modificarea NPY hipotalamică.
Am folosit o doză orală de sibutramină (3 mg kg -1 zi -1 p.o.), care a determinat o reducere atât a aportului alimentar, cât și a creșterii în greutate corporală la șobolanii obezi din dietă. Aceste date sunt de acord cu un studiu anterior (Fantino și colab., 1995). În acord cu studiile la oameni obezi, modificările compoziționale ale corpului induse de sibutramină au fost reflectate mai degrabă de epuizarea țesutului adipos, mai degrabă decât de masa de țesut slab (Griffiths și colab., 1995). Acest efect s-a reflectat printr-o scădere concomitentă a nivelurilor plasmatice de leptină, care a fost proporțională atât cu grupele obese alimentate cu chow, cât și cu cele obeze din dietă cu masa redusă de grăsime, în concordanță cu corelația leptinei cu masa grasă corporală la rozătoare și la oameni (Considine și colab., 1996; Maffei și colab., 1995; Solin și colab., 1997).
În concordanță cu asocierea cunoscută dintre obezitate, rezistență la insulină și diabet, pierderea în greutate în grupul obez din dietă cu sibutramină a fost asociată cu o scădere a indicelui HOMA, indicând o ameliorare a rezistenței la insulină. Rezistența la insulină a fost îmbunătățită într-o măsură mai mare cu tratamentul cu sibutramină, comparativ cu grupul obez alimentat în perechi, sugerând că sibutramina ar putea avea un efect independent pentru a îmbunătăți sensibilitatea la insulină, dincolo de acele efecte care se datorează pierderii în greutate. Acest lucru ar putea fi legat de pierderea selectivă a țesutului adipos observat la tratamentul cu sibutramină, deoarece adipozitatea este un factor determinant important al sensibilității la insulină (Jung, 1997) sau un efect direct, așa cum sa raportat recent (Day și Bailey, 1998).
Dovezi recente sugerează că șobolanii predispuși la DIO au niveluri mai mari de ARNm NPY arcuit decât șobolanii rezistenți la dietă înainte de expunerea la o dietă bogată în energie, cu toate acestea nivelurile crescute de NPY sunt reduse după 12 săptămâni de consum ridicat de energie (Levin, 1999). Acest lucru poate explica rezultatele observate în acest studiu, în cazul în care șobolanii DIO nu au prezentat nicio modificare a NPY hipotalamic după 15 săptămâni de dietă. Acest lucru ar sugera că sibutramina acționează independent de sistemul NPYergic. Interesant este faptul că nivelurile de NPY și ARNm nu au fost afectate de hrănirea în perechi. Cu toate acestea, în ultimele 4 zile ale studiului, aportul de alimente între grupurile tratate cu sibutramină și grupurile ad libitum netratate nu a fost semnificativ diferit. Aceasta înseamnă că grupurile hrănite în perechi au primit cantități similare de alimente cu grupurile ad libitum netratate și nu au fost în condiții care ar invoca reglarea în sus a NPY hipotalamic observat în mod normal la rozătoarele cu restricție alimentară (Abizaid et al., 1997; Brady et al., 1990; Dryden și colab., 1996; Lewis și colab., 1993).
Controlul hipotalamic al poftei de mâncare este complex, iar diferite componente au funcții specifice în reglarea sațietății, a foamei, a alegerii alimentelor și a consumului de energie, cu un grad semnificativ de redundanță, de exemplu șoarecele NPY knockout câștigă în mod normal greutatea corporală (Williams și colab., 2000 ). Prin urmare, este posibil ca sibutramina să modifice consumul de alimente și/sau cheltuielile de energie prin influențarea unuia sau mai multor alte sisteme de neurotransmițători hipotalamici peptidergici și nepeptidergici care sunt implicați în controlul echilibrului energetic, dar nu au fost evaluați în studiile descrise aici. Cu toate acestea, vor fi necesare studii suplimentare pentru a răspunde la aceste întrebări.
În concluzie, am arătat că sibutramina induce hipofagie și încetinește creșterea în greutate la DIO și șobolani Wistar hrăniți cu chow. Aceste modificări au fost însoțite de pierderea preferențială a depozitelor de grăsime corporală și îmbunătățirea sensibilității la insulină. Mai mult, datele prezentate aici ar sugera că sibutramina acționează independent de sistemul NPYergic.
- Mieloperoxidaza O țintă terapeutică pentru prevenirea rezistenței la insulină și a sechelelor metabolice
- Diferențe de obezitate și rezistență la insulină între copiii pubertari și prepubertari ESPE2019 58th
- Obezitatea indusă de zahăr și rezistența la insulină sunt decuplate de supraviețuirea scurtată la Drosophila -
- Rezistența la insulină indusă de obezitate și hiperglicemia factori etiologici și mecanisme moleculare -
- Q; Un Departamentul de Rezistență al Corpului Uman al Universității din Fizică din Illinois, la Urbana-Champaign