O pagină Microbian Biorealm despre gen Stafilococ epidermid
Cuprins
- 1 Clasificare
- 1.1 Taxă de comandă superioară
- 1.2 Specii
- 2 Descriere și semnificație
- 3 Structura genomului
- 4 Structura celulară și metabolism
- 5 Ecologie
- 6 Patologie
- 7 Aplicarea la biotehnologie
- 8 Cercetări actuale
- 9 Referințe
Clasificare
Taxă de comandă superioară
Bacterii; Firmicute; Bacillales; Stafilococ (1)
Specii
Specii de gen: Stafilococ epidermid
Alte nume: Micrococcus epidermidis, Albococcus epidermidis, Staphylococcus epidermidis albus (2)
Descriere și semnificație
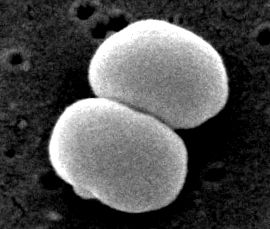
Stafilococ epidermid este un stafilococ gram-pozitiv și coagulaz-negativ (4). De obicei trăiește pe pielea și mucoasa umană și cele mai frecvente infecții pe catetere și implanturi (5). S. epidermidis este unul dintre cele mai comune cinci organisme care cauzează infecții noscomiale datorită creșterii utilizării biomaterialelor în mediul clinic (8). Agentul patogen nosocomial cauzează infecții pe valvele protetice, șunturi de lichid cefalorahidian, proteze articulare proteze vasculare, valve, precum și în plăgi postoperatorii și tractul urinar. Este, de asemenea, cel mai frecvent organism găsit în sângele pacienților cu transplant de măduvă osoasă și pe cateterele venoase centrale pentru pacienții cu nutriție parenterală totală (4).
S. epidermidis tulpina de la nare sănătoase pentru adulți arată că există multe tipuri de organism la fiecare individ (9). Un obisnuit S. epidermidis tulpina RP62a (ATCC 35984) a fost izolată în Memphis, Tennessee în perioada 1979-1980 într-o largă răspândire a sepsisului cateterului intravascular. RP62a este o tulpină care produce nămol, crește colectiv și formează biofilm. Tratamentul S. epidermidis infecțiile cauzate de biofilm cu antibiotice sunt adesea ineficiente și duc la necesitatea îndepărtării implanturilor (5). O altă tulpină este S. epidermidis ATCC 12228 care nu produce biofilm (7).
Capacitatea de a produce nămol permite agentului patogen să rămână pe biomateriale. Diferite tulpini de S. epidermidis se pot distinge prin faptul că produc sau nu slime. În laboratoarele clinice, S. epidermidis infecțiile sunt studiate prin utilizarea de antibiotice, biotipare, profiluri plasmidice și producția de nămol; întrucât în cercetare se utilizează fagotiparea, serotiparea, analiza enzimatică restricționată și hibridizarea ADN-ADN (4).
Stafilococ epidermid este adesea comparat cu Staphylococcus aureus. Aceste bacterii sunt cei doi agenți patogeni principali din gen datorită unui milion de infecții grave cauzate în spitale pe an. S. epidermidis este specia dominantă care trăiește mai ales pe piele în timp ce S. aureus trăiește mai ales pe suprafețele mucoasei. Deoarece aceste specii sunt rezistente la multe antibiotice și antimicrobiene, singurul tratament rămas pentru majoritatea acestor stafilococi este glicopeptidul antibiotic vancomicină; cu toate acestea, o tulpină rezistentă la vancomicină de S.aureus a fost gasit recent (7).
O problemă controversată pe S. epidermidis argumentează dacă toate tulpinile pot provoca sau nu în mod egal boală și dacă un genotip specific determină o boală specifică (6).
Structura genomului
S-a folosit metoda pistolului aleator pentru a secvența complet
Genomul de 2,6 Mb S. epidermidis RP62a la Institutul pentru Cercetări Genomice (TIGR) (7). Lungimea cromozomului RP62A este de 2.616.530bp, conține 32,10% din conținutul de G + C, 6 operoni ARNr și plasmidă cu 28,080bp și 32% din conținutul de G + C (11). Două plasmide vSe1 și vSe2 au fost identificate în tulpinile RP62a și ATCC 12228 și au gene de proteină a integrazei. Plasmida vSe1 are gene pentru rezistența la cadmiu, în timp ce o a doua sortază specifică tulpină și două proteine de atașare a suprafeței LPXTG sunt codificate de vSe2 din ATCC 12228 (7).
S. epidermidis Genomul RP62A a fost comparat cu genomul ATCC 12228 pentru a analiza și descoperi evoluția virulenței și a rezistenței acestora. Părțile nesincronice ale insulelor genomului sunt locul în care se află diferențele de rezistență și patogenitate. Stafilococii și bacteriile gram-pozitive cu conținut scăzut de GC au ajutat la schimbarea virulenței și a rezistenței acestora. Operonul cap, care este factorul de virulență de sus în Bacillus anthracis se găsește și în S. epidermidis (7).
Când întregul genom al S. aureus și S. epidermidis este analizat, a arătat că sunt sintetice în ansamblu, dar cu diferențe în insulele genomului, profagul integrat, elementele IS, transpozonii compuși și plasmidele integrate (boală și virulență). TIGR a găsit o nouă insulă genomică vSaγ care este conținută în toate S. aureus și S. epidermidis genomi (7).
Structura celulară și metabolism
În comparație cu alte bacterii, cum ar fi micrococul, S. epidermidisPeretele celular este mult mai puternic. Adăugarea lizostafinei se poate diferenția S. epidermidis din micrococ. Micrococul este mai probabil să se lizeze în timp ce peretele celular al S. epidermidis conține proprietăți chimice ale peptidoglicanului care îl împiedică liza. Există endopeptidaze care taie legăturile glic-glicină în penta sau hexpeptidă trecere a peptidoglicanului S. epidermidis. Tulpinile care conțin serină în punțile interpeptidice sunt mai rezistente la liză (4).
Peretele celular al stafilococilor conține acizi teichoici care sunt conectați la peptidoglican prin legături covalente. Acizii teichoici sunt compuși fie din glicerol, fie din ribitol, care sunt conectați prin legături fosfodiesterice. Sunt polimeri solubili în apă constituiți din 30-50% din componentele uscate ale celulei. S. aureus și S. epidermidis se poate distinge prin faptul că are ribitol sau glicerol. S. epidermidis are glicerol acid teichoic reziduuri glucozil în timp ce S. aureus are acid N-acetilglucozamin ribitol teichoic (4).
S. epidermidis este capabil să crească utilizând glucoză anaerob, dar nu poate crea coagulază sau fermenta manitol. Cele mai multe tulpini de S. epidermidis faceți acetoină, fosfatază și reduceți nitrații. Cu oxigenul, toate tulpinile pot produce acid atunci când sunt expuse la glucoză, fructoză, maltoză, zaharoză și glicerol și 70% -90% cu galactoză, manoză și lactoză. Acidul nu poate fi format din manitol, trehaloză, ramnoză, xiloză sau arabinoză (4).
Ecologie
Mediul natural al S. epidermidis este corpul uman și de obicei provine din boli. Deoarece bacteriile trăiesc de obicei pe piele și nare ale tuturor ființelor umane și sunt un agent patogen nosocomial, este important să putem identifica tulpinile specifice. S. epidermidis este cel mai frecvent stafilococ pe pielea umană. în plus, S. epidermidis acoperă de asemenea 90% -100% stafilococi din nare când S. aureus nu este prezent. Când S. aureus este prezent S. epidermidis cantitatea scade drastic (4). Formarea biofilmului permite S. epidermidis să se atașeze și să crească pe dispozitive biomedicale și să fie eliberat în sânge pentru a infecta noi zone (8).
Patologie
Creșterea utilizării cateterelor intravasculare a determinat o creștere similară a S. epidermidis infecții. Creșterea cauzează o problemă de atunci S. epidermidis este rezistent la meticilină și la toate penicilinele, penemurile, carbapanemele și cefalosporinele care sunt antibiotice utilizate în mod obișnuit (3). S. epidermidis s-a constatat, de asemenea, că este mai rezistent la antibiotice decât alte specii (4).
Deși nu există factori specifici de virulență ai S. epidermidis, capacitatea de a forma biofilm este unul dintre factorii de virulență (5,6). Biofilmul permite celulelor bacteriene să adere la o zonă inertă sau de locuit (5). Când s-a format un biofilm, devine mai dificil de tratat, deoarece celulele din interiorul biofilmului sunt protejate de antibiotice și de sistemul imunitar (5). Biofilmul eliberează, de asemenea, un răspuns imun al gazdei la antigeni care previne îndepărtarea biofilmului și poate duce, de asemenea, la deteriorarea țesuturilor (9). Bacteriile pot fi eliberate în sânge din biofilme și pot declanșa noi infecții prin atașarea la dispozitivele medicale, astfel încât dispozitivele vor fi îndepărtate (8).
Unele strategii preventive pentru infecții sunt de a oferi terapie cu antibiotice proilatice pentru a acoperi inserțiile chirurgicale de la dispozitive intravasculare temporare. Există, de asemenea, rapoarte care avertizează să nu se utilizeze profilaxia cu antibiotice, în special vancomicina pentru dializă. Pentru infecțiile cu cateter trebuie utilizate tehnici aseptice pentru a preveni contaminarea. Noile tehnici se concentrează pe barierele electrice fizice pentru colonizare și utilizarea biomaterialelor cu agenți antimicrobieni deja înăuntru. Cu toate acestea, aceste noi metode nu au fost încercate în cadrul clinic (9).
Aplicarea la biotehnologie
S. epidermidis conține o genă lipazică care poate crește activitatea lipazei și poate îmbunătăți specificitatea substratului cu ajutorul mutagenezei direcționate la nivelul locului. Genele de tip sălbatic și mutante (M415A și V6491) sunt capabile să producă esteri aromatici diferiți într-o soluție apoasă. Componentele aromatizante sunt adesea realizate de esteri. Acestea sunt utilizate în produsele cu aromă de fructe, produse de patiserie, vinuri și produse lactate. Cu toate acestea, acestea au fost eliminate din sistemele alimentare majore, deoarece sunt scumpe. Prin utilizarea materiilor prime naturale, cum ar fi acizii grași și alcoolii, esterii aromatizanți pot fi mai ieftini. Lipazele de S. epidermidis sunt capabili să producă esteri fără utilizarea de solvenți organici, ceea ce reprezintă un avantaj. Când nu se utilizează solvenți organici, toxicitatea și inflamabilitatea pot fi prevenite. În plus față de simplificarea purificării produsului, acesta poate forma, de asemenea, diferite tipuri de esteri, cum ar fi esteri cu lanț mediu, esteri de geranil și esteri nesaturați și poate fi proiectat pentru a forma esteri cu lanț scurt și alți acizi grași (10).
Cercetări curente
În Tunisia, există o creștere a infecțiilor tulpinii rezistente la meticilină Stafilococi epidermidi. 32 S. epidermidis tulpinile au fost izolate din probe de apă pentru dializă și ace scoase dintr-un centru de dializă din Kairouan (Centrul Tunisiei). Un set de stafilococ ATB a fost utilizat pentru a determina rezistența la antibiotice a tulpinilor pentru 18 antibiotice diferite. Rezultatele au arătat că cele mai multe tulpini au fost rezistente la penicilină (93,8%), tetracilină (68,7%) și kanamicină (53,2%). Testul PCR a fost, de asemenea, utilizat pentru a identifica genele icaA/icaD (aderență intercelulară), mecA (rezistență la oxacilină), ermA/ermB/ermC (rezistență la eritromicină metilază) și msrA și mef (gena de eflux macrolidic). Rezultatele au arătat 71,9% icaA/icaD, 78,1% mecA, 12,5% ermA, 31,3% ermB, 53,1% ermC, 68,8% msrA și 0% mef. Rezultatele susceptibilității de la stafilococul ATB și genele identificate din PCR nu s-au potrivit și arată că PCR este prea rapidă în investigația stafilococilor în comparație cu metodele tradiționale. Cu toate acestea, poate ajuta la înțelegerea infecțiilor nosocomiale examinând tiparele de transmitere și determinând susceptibilitățile la antibiotice (3).
Stafilococi negativi coagulazici care sunt rezistenți la tratamente multiple precum Stafilococ epidermid poate fi cauza infecției în timpul transplanturilor de măduvă osoasă. Două antibiotice noi, daptomicina și tigeciclina sunt eficiente împotriva bacteriilor gram-pozitive și a stafilococilor care sunt rezistente la meticilină. Un studiu actual compară eficacitatea daptomicinei și tigeciclinei cu vancomicina și fosfomicina față de stafilococi negativi coagulazici de la pacienții infectați cu măduvă osoasă. Concentrațiile minime inhibitorii (MIC) din testele de sensibilitate in vitro au fost utilizate în comparație pentru a determina eficacitatea antibioticelor. Rezultatele arată că toți stafilococii au fost susceptibili de noile antibiotice și vancomicină. Vancomicina este încă utilizată în timpul transplanturilor de măduvă osoasă (12).
- Staphylococcus epidermidis Un nou jucător potențial în fiziopatologia acneei FullText -
- Seleniul atenuează mastita Staphylococcus aureus la șoareci prin inhibarea activării
- Factori de risc preoperatori pentru transportul nazal al controlului infecției cu Staphylococcus aureus; Spital
- Igiena personală și infecția cu Staphylococcus aureus rezistentă la meticilină - Volumul 12, număr
- Rimonabant, motilitate gastrointestinală și obezitate Bentham Science