Paul A. Dawson
1 Mater Research Institute, Nivelul 4, Institutul de Cercetări Translaționale, Universitatea din Queensland, 37 Kent St, TRI, Woolloongabba, QLD 4102, Australia; E-mailuri: ua.gro.retam.irmm@ttoillea (A.E.); [email protected] (F.G.B.)
Aoife Elliott
1 Mater Research Institute, Nivelul 4, Institutul de Cercetări Translaționale, Universitatea din Queensland, 37 Kent St, TRI, Woolloongabba, QLD 4102, Australia; E-mailuri: ua.gro.retam.irmm@ttoillea (A.E.); [email protected] (F.G.B.)
2 Mater Children's Hospital, Mater Health Services, South Brisbane, QLD 4101, Australia
Francis G. Bowling
1 Mater Research Institute, Nivelul 4, Institutul de Cercetări Translaționale, Universitatea din Queensland, 37 Kent St, TRI, Woolloongabba, QLD 4102, Australia; E-mailuri: ua.gro.retam.irmm@ttoillea (A.E.); [email protected] (F.G.B.)
2 Mater Children's Hospital, Mater Health Services, South Brisbane, QLD 4101, Australia
Abstract
1. Introducere
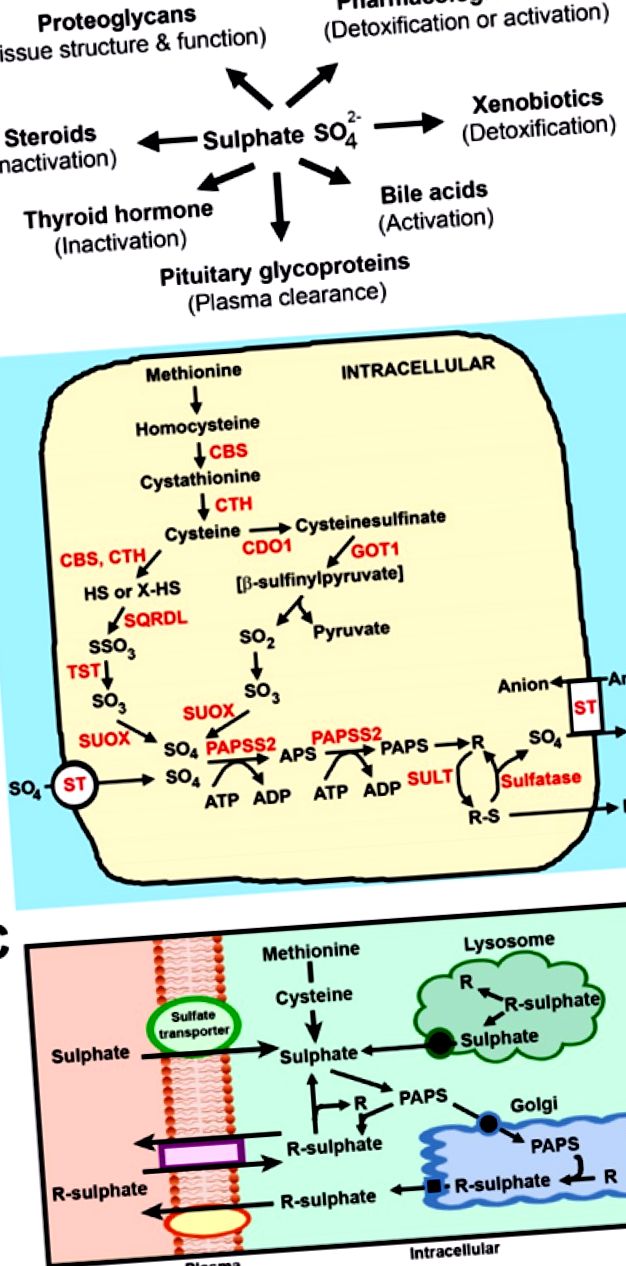
Rolurile biologice ale sulfatului și căile homeostaziei sulfatului. (A) Sulfonația contribuie la numeroase funcții celulare și metabolice în fiziologia umană; (B) Căi de generare și sulfonare a sulfatului intracelular. Metionina este convertită în cisteină prin calea transsulfurării care implică cistationina β-sintază (CBS) și cistationina γ-liaza (CTH). Cisteina este convertită în sulfat prin două căi: o cale minoră care implică CBS, CTH, sulfură chinonă reductază (SQRDL), tiosulfat sulfurtransferază (TST) și sulfit oxidază (SUOX); și o cale majoră care implică cisteina dioxigenază (CDO), transaminaza glutamic-oxaloacetică 1 (GOT1) și SUOX. ST, transportoare de sulfat; PAPSS2, PAPS sintetaza; SULT, sulfotransferaze; R reprezintă acele substraturi prezentate în (A); (C) Flux de sulfat intracelular și molecule sulfonate. La adulți și copii, sulfatul se obține din: (i) surse extracelulare prin intermediul transportatorilor de sulfat; (ii) catabolismul metioninei și cisteinei; (iii) hidroliza proteoglicanilor din lizozom; și (iv) îndepărtarea mediată de sulfatază a sulfatului de pe substraturi din citosol.
2. Sulfatul se obține din dietă
Sulfonația se bazează pe o cantitate suficientă de sulfat, care se obține din dietă sub formă de sulfat anorganic liber (SO4 2−) sau generat din compuși sulfonați și aminoacizii care conțin sulf, metionină și cisteină [5,12]. O dietă bine echilibrată contribuie cu aproximativ o treime din necesarul mediu estimat de sulfat corporal (0,2-1,5 g SO4 2-/zi) [13,14,15,16]. Anumite alimente, inclusiv legumele brassica și pâinea comercială conțin un conținut ridicat de sulfat (> 0,9 mg/g), în timp ce nivelurile scăzute de sulfat (500 mg/L în apă din fântâni și diguri alimentate cu izvor [13,14,15]. depășirea a 500 mg/L de apă potabilă poate avea ca rezultat un gust neplăcut, deși unii indivizi sunt mai sensibili la concentrații mai mici [16] Inhalarea de sulfat în aer se estimează că contribuie la urme (0,01-0,04 mg SO4 2-/zi) în plus, anumite suplimente prenatale multivitamine-multiminerale conțin sulfat, în principal sub formă de sulfat cupric anhidru, sulfat de zinc și sulfat de mangan, cu aproximativ 25-40 mg SO4 2−/comprimat.
Valoarea nutrițională a sulfatului în susținerea creșterii rozătoarelor de laborator a fost raportată pentru prima dată în urmă cu aproape un secol [28]. Studii mai recente pe animale au arătat că restricționarea sulfatului atât în alimente, cât și în apă poate duce la deficit de sulfat și la creșterea redusă, care poate fi inversată prin suplimentarea cu sulfat [29,30,31,32]. În plus, aportul ridicat de sulfat din dietă și administrarea sărurilor de sulfat (MgSO4, Na2SO4 și ZnSO4) pot duce la creșterea sulfatemiei circulante și la creșterea capacității de sulfonare [33,34,35,36,37,38,39]. Cu toate acestea, în prezent nu există un aport alimentar recomandat pentru sulfat anorganic la om, în principal deoarece sulfatul poate fi generat din aminoacizii care conțin sulf.
3. Generarea de sulfat din metabolismul intracelular
Proteina este alcătuită din aproximativ 4% din aminoacizii metionină și cisteină care conțin sulf [40]. Având în vedere că aportul zilnic recomandat de proteine pentru copiii cu vârsta cuprinsă între 19 și 50 de ani în timpul sarcinii este de 0,8-1,0 g/kg [41], atunci cantitatea estimată de sulfat generată din proteine este de aproximativ 1,7 g/zi. Atât adulții, cât și copiii au capacitatea de a metaboliza metionina și cisteina în sulfat [1]. Metionina este convertită în cisteină prin calea transsulfurării, iar cisteina este oxidată în continuare în sulfat prin 2 căi: o cale minoră de generare a sulfatului prin cistationina γ-liază (CTH) și cistationina β-sintaza (CBS); și o cale principală prin cisteină dioxigenază (CDO) (Figura 1 B) [42]. Studiile anterioare au raportat absența CTH și CDO în ficatul fetal uman și rozător, indicând faptul că fătul în curs de dezvoltare are o capacitate limitată de a genera sulfat din aminoacizii care conțin sulf [43,44]. Acest lucru ridică problema surselor care furnizează cererile fetale ridicate de sulfat în timpul sarcinii?
La adulți și copii, nivelurile de sulfat circulante sunt influențate de absorbția în intestinul subțire, reabsorbția la rinichi și absorbția în celule din tot corpul (Figura 2 A) [1]. Sulfatul circulant este o sursă majoră de sulfat pentru furnizarea sulfonării intracelulare a substraturilor din citoplasmă (steroizi, hormoni, xenobiotice și proteine) sau aparate golgi (proteoglicani) [45,46]. Cu toate acestea, fluxul global de sulfat intracelular este menținut pe patru căi (Figura 1 C): (i) Sulfatul extracelular din circulație este transportat prin membrana plasmatică a celulelor prin intermediul transportatorilor de sulfat; (ii) Metionina și cisteina sunt catabolizate în sulfat; (iii) Sulfatul este îndepărtat din proteoglicanii prin intermediul enzimelor sulfatazice din lizozom și apoi transportat în citoplasmă; și (iv) sulfatazele citosolice îndepărtează sulfatul din moleculele sulfonate. Ultimele trei surse au contribuții neglijabile sau scăzute la fondul de sulfat intracelular fetal, care se bazează, așadar, pe surse de sulfat extracelular [1]. În plus, fătul în curs de dezvoltare are capacități de reabsorbție renală imatură și capacități de absorbție intestinală, evidențiind cerințele obligatorii pentru furnizarea de sulfat de la mamă la făt prin placentă pe tot parcursul gestației.
Fluxuri de sulfat între țesuturi. (A) Contribuția intestinului subțire, a rinichilor și a celulelor la homeostazia sulfatată (B) Contribuții materne, fetale și postnatale la sulfatarea condroitinei. Întreruperea căilor care mențin o cantitate suficientă de sulfat pentru condrocite (etapele 1–3) sau sulfonarea intracelulară a condroitinei (etapele 4–5) duce la condrodisplazii.
4. Sulfatul este furnizat de la mamă la făt
În timpul sarcinii la om și la rozătoare, nivelurile de sulfat circulant materne cresc de peste două ori pentru a satisface nevoile gestaționale ale fătului în creștere [47,48] și acest lucru este remarcabil deoarece majoritatea concentrațiilor de ioni plasmatici scad ușor în timpul sarcinii datorită hemodiluției [49] și vorbește despre rolul său crucial în dezvoltarea fetală. Nivelurile crescute de sulfat din sânge matern provin din reabsorbția crescută a sulfatului în rinichii mamei (Figura 2 B) [47,48], care este mediată de expresia renală crescută a genei SLC13A1 (alias NaS1, transportor de sulfat de sodiu 1) [50]. Întreruperea SLC13A1 la oameni și șoareci determină irosirea sulfatului în urină [51,52], iar acest lucru reduce considerabil nivelul de sulfat din sânge (hiposulfatemia). La șoareci, pierderea genei Slc13a1 duce la anomalii comportamentale (memorie redusă și funcție olfactivă și anxietate crescută), niveluri reduse de serotonină cerebrală, întârziere a creșterii, afectarea sulfonării mucinei gastro-intestinale și toxicitate hepatică indusă de acetaminofen [33,51,52, 53,54,55,56,57,58]. În plus, femelele însărcinate Slc13a1 nule prezintă hiposulfatemie pe tot parcursul gestației, ceea ce duce la deficit de sulfat fetal și avort spontan la mijlocul gestației [48].
S-a descoperit recent că o genă SLC13A4 înrudită (alias NaS2, transportor de sulfat de sodiu 2) este cel mai abundent transportor de sulfat în placenta umană și de șoarece [50,59]. SLC13A4 este localizat la stratul sinciotrofoblast al placentei, locul schimbului de nutrienți materno-fetal, unde se propune furnizarea de sulfat de la mamă la făt [59]. Pierderea SLC13A4 placentară la șoareci duce la anomalii severe ale dezvoltării fetale și la moartea fetală gestațională târzie, evidențiind necesitatea obligatorie de sulfat pentru o creștere și o dezvoltare fetală sănătoasă [60].
În ultimul deceniu, interesul pentru rolurile și reglarea sulfatului în timpul sarcinii sa extins ca urmare a caracterizării restricției de creștere și a decesului fetal la modelele animale cu capacitate redusă de sulfonare [11]. De exemplu, șoarecii lipsiți de Sult1e1 estrogen sulfotransferază prezintă pierderi fetale la mijlocul gestației [61]. Sult1e1 este exprimat în placentă, unde este esențial pentru generarea formelor sulfonate de estron sulfat, estradiol-3-sulfat și estriol sulfat. Pierderea fetală și creșterea fetală afectată au fost, de asemenea, legate de alte câteva sulfotransferaze și sulfataze care mențin raportul biologic necesar dintre proteinele sulfonate și neconjugate și proteoglicanii [11]. În ciuda dovezilor din studiile pe animale care arată importanța fiziologică pentru sulfat în timpul sarcinii, nu există măsurători de rutină ale sulfatului în mediile clinice.
La om, sulfatul anorganic liber (SO4 2−) este al patrulea anion cel mai abundent în circulație (aproximativ 300 μmol/L) [62]. Studiile timpurii au raportat o creștere dublă a nivelului de sulfat plasmatic la femeile gravide [35,63,64,65]. Studii mai recente au folosit o metodă validată de cromatografie ionică pentru a stabili intervalele de referință pentru nivelurile de sulfat plasmatic matern în timpul gestației timpurii (10-20 săptămâni) și târziu (30-37 săptămâni), precum și nivelurile de sulfat plasmatic din cordonul ombilical de la sarcinile sănătoase pe termen lung [47] . Aceste date vor permite acum investigații clinice asupra rezultatelor nivelurilor scăzute de sulfat plasmatic la mamă și copil și, cel mai probabil, vor extinde cunoștințele noastre actuale asupra consecințelor deficitului de sulfat, în special a dezvoltării scheletice, care este sensibilă la deficitul de sulfat.
5. Capacitatea redusă de sulfonare perturba creșterea și dezvoltarea scheletului
La mamifere, proteoglicanii sulfonați sunt o componentă esențială a matricilor extracelulare din tot corpul, în special în țesuturile conjunctive [66,67]. Conținutul de sulfat al proteoglicanilor influențează funcția de semnalizare a celulelor și integritatea structurală a țesuturilor [5]. Glicoproteinele foarte sulfonate, inclusiv condroitina proteoglican (CSPG), joacă roluri importante în scheletul în curs de dezvoltare, cu legături cu modularea căii de semnalizare Indian Hedgehog [68]. Important, sulfonarea CSPG-urilor în condrocite este esențială pentru creșterea și dezvoltarea scheletului normal, iar mai multe tulburări scheletice au fost atribuite unor defecte genetice care duc la scăderea capacității de sulfonare [11].
Condrocitele se bazează pe o cantitate abundentă de sulfat extracelular, pentru a satisface cerințele intracelulare de sulfonare CSPG (Figura 2 B). Sulfatul este transportat în condrocite prin intermediul transportorului de sulfat SLC26A2 (etapa 3 din Figura 2 B) [69]. Peste 30 de mutații ale genei umane SLC26A2 au fost legate de condrodisplazii [70], defectul metabolic subiacent fiind sulfonarea redusă a condroitinei în condrocite [71]. Șoarecii mutanți Slc26a2 prezintă, de asemenea, condrodisplazii care imită fenotipurile biochimice și morfologice găsite la om [71,72,73]. Tratamentul șoarecilor mutanți Slc26a2 cu N-acetil cisteină, a prezentat o sulfonare proteoglicanică crescută și fenotipuri scheletice îmbunătățite [31], sugerând că compușii care conțin tiol pot susține nivelurile de sulfat intracelular necesare pentru sulfonarea CSPG-urilor.
Pierderea PAPS (3'-fosfoadenozină 5'-fosfosulfat) sintetază a fost, de asemenea, legată de insuficiența sulfonării CSPG și displazii scheletice [74]. PAPS este donatorul universal de sulfonat pentru toate reacțiile de sulfonare și formarea sa se bazează pe o cantitate suficientă de sulfat intracelular (etapa 4 din Figura 2 B) [75]. Genomele de mamifere conțin două gene sintetază PAPS, PAPSS1 și PAPSS2 [76,77,78]. PAPSS2 a fost legat de fiziopatologia umană, cu fenotipuri scheletice similare găsite la șoarecii mutanți Papss2 [76,78]. În plus, întreruperea genei transportoare PAPS de pește zebră (PAPST1, aka pinscher) duce la defecte ale cartilajului [79]. Fenotipurile scheletice se găsesc și la pacienții cu mutații ale genei condroitinei 6-O-sulfotransferazei (etapa 5 din Figura 2 B) [80], arătând că sulfonarea condroitinei este importantă pentru menținerea unei dezvoltări scheletice sănătoase. Aceste descoperiri evidențiază importanța căilor care duc la sulfatarea condroitinei pentru dezvoltarea sănătoasă, creșterea și întreținerea scheletului.
În prezent, nu există nici un remediu pentru cele mai severe forme de displazie scheletică, atelosteogeneza de tip II și acondrogeneză de tip IB, care duc la subdezvoltare scheletică și la moarte în utero sau în perioada neonatală [70]. Formele ușoare (epifizare multiplă) și moderate (displazie diastrofică) ale bolii sunt tratate cu ortopedie și controlul durerii, dar acești pacienți se confruntă cu o viață cu handicap. Alte gene, inclusiv PAPSS2, au implicare în creșterea și dezvoltarea anormală a scheletului la om [76], iar spectrul clinic asociat cu PAPSS2 și SLC26A2 s-a extins în continuare pentru a include osteoartrita genunchiului [81], sugerând că tulburările de sulfatare sunt probabil mai frecvente decât estimat la 2% din toate displaziile scheletice care se bazează pe nașteri vii [82]. Acest lucru este relevant și pentru studiile recente care au legat gena transportorului renal de sulfat Slc13a1, care este important pentru menținerea nivelului de sulfat circulant, cu displazii scheletice la animale [83,84]. Aceste descoperiri sunt susceptibile de a fi relevante pentru creșterea și dezvoltarea scheletului uman. Colectiv, lipsa tratamentelor curative pentru tulburările de sulfonare a scheletului duce la o povară semnificativă pentru familii și comunitate [85].
6. Concluzie
Sulfatul este un nutrient obligatoriu pentru o creștere și dezvoltare sănătoase. Deși este esențială pentru numeroase procese celulare și metabolice în dezvoltarea fătului, importanța sa este în mare măsură subapreciată în mediile clinice. Modelele animale au arătat rezultatele fiziologice devastatoare ale capacității reduse de sulfonare asupra creșterii și dezvoltării fetale, care este relevantă pentru legătura stabilită cu condrodisplazii umane. O cantitate suficientă de sulfat, fie din dietă, fie din aminoacizi care conțin sulf, trebuie furnizată de la mamă la făt, în special în timpul gestației târzii, atunci când cererile fetale de sulfat sunt mari. Dezvoltarea unei metode validate de cuantificare a sulfatului, împreună cu date recente pentru intervalele de referință ale sulfatului plasmatic matern, justifică acum investigații suplimentare asupra consecințelor deficitului de sulfat de nutrienți la mamă și copil.
Mulțumiri
Această lucrare a fost susținută de Institutul de Cercetări Medicale Mater, Fundația Mater și o Fundație de cercetare a Fundației Mater către PAD.
Contribuțiile autorului
PAD a conceput subiectul, a participat la proiectare și coordonare și a elaborat manuscrisul. AE și FGB au participat la proiectarea articolului și au contribuit la elaborarea manuscrisului. Toți autorii au citit și au aprobat manuscrisul final.
Conflicte de interes
Autorii nu declară niciun conflict de interese.
- Metoda de extragere face ca retragerea să împiedice sarcina
- Nu există un nivel sigur de consum de cafea pentru femeile însărcinate, spune studiul Pregnancy The Guardian
- Băuturi nealcoolice pentru sarcină - BabyCentre UK
- Durerea pelviană în timpul sarcinii (SPD) - BabyCentre UK
- Stelazină - Efecte secundare, utilizări, dozare, supradozaj, sarcină, alcool RxWiki