La fel ca multe alte animale, oile călătoresc în turme. Tendința este ca fiecare oaie să rămână cu turma. Cu toate acestea, o oaie poate rătăci uneori, în funcție de cât de puternică este atracția pentru o anumită alimentare sau apă. Alteori, o oaie se poate speria și fugi. Dacă o oaie alege să rămână cu turma sau să meargă pe propria cale depinde de echilibrul dintre atracția spre turmă și atracția spre influența exterioară.
Există o tensiune continuă între electroni și protoni într-un atom. Reactivitatea atomului depinde în parte de cât de ușor pot fi eliminați electronii din atom. Putem măsura această cantitate și o putem folosi pentru a face predicții despre comportamentele atomilor.
Energie de ionizare
Energie de ionizare este energia necesară pentru a îndepărta un electron dintr-un atom specific. Se măsoară în \ (\ text \), care este o unitate de energie, la fel ca caloriile. Energiile de ionizare asociate cu unele elemente sunt descrise în tabelul de mai jos. Pentru orice atom dat, electronii cu valență exterioară vor avea energii de ionizare mai scăzute decât electronii miezului interior. Pe măsură ce se adaugă mai mulți electroni într-un nucleu, electronii externi sunt protejați de nucleu de către electronii din carcasă interioară. Aceasta se numește ecranarea electronilor.
Dacă trasăm primele energii de ionizare vs. numărul atomic pentru principalele elemente ale grupului, am avea următoarea tendință:
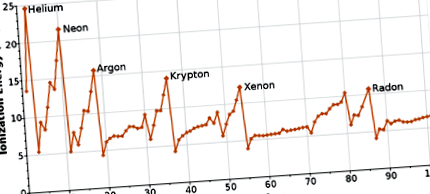
Trecând de la stânga la dreapta peste tabelul periodic, energia de ionizare pentru un atom crește. Putem explica acest lucru luând în considerare sarcina nucleară a atomului. Cu cât mai mulți protoni din nucleu, cu atât este mai puternică atracția nucleului către electroni. Această atracție mai puternică face mai dificilă îndepărtarea electronilor.
În cadrul unui grup, energia de ionizare scade pe măsură ce dimensiunea atomului crește. Pe grafic, vedem că energia de ionizare crește pe măsură ce urcăm grupul către atomi mai mici. În această situație, primul electron eliminat este mai departe de nucleu, pe măsură ce numărul atomic (numărul de protoni) crește. Dacă este mai departe de atracția pozitivă, este mai ușor să se scoată acel electron.
Figura \ (\ PageIndex \): tendințe periodice.
rezumat
- Energia de ionizare se referă la cantitatea de energie necesară pentru a elimina un electron dintr-un atom.
- Energia de ionizare scade pe măsură ce coborâm într-un grup.
- Energia de ionizare crește de la stânga la dreapta de-a lungul tabelului periodic.
Colaboratori și atribuții
Fundația CK-12 de Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson și Jean Dupon.
- Utilizarea corectă a soldurilor - LibreTexte chimice
- Noi tendințe nutriționale
- O nouă țintă de droguri la oameni activează grăsimile brune pentru a arde excesul de energie
- Nu coace 100 de calorii Unt de arahide Bile de energie Dieteticianul conștient
- Noi tendințe în reducerea și reducerea sânilor Mastopexy folosind singur liposucția
