Toxina holerei (CT) este mai mult de 80% omologă cu LT, iar vaccinarea cu vaccinuri pe bază de subunitate CT-B (CT-B) determină un răspuns imun protector împotriva tulpinilor ETEC producătoare de LT.
Termeni asociați:
- Celule epiteliale
- Adenilil ciclază
- Receptor Eicosanoid
- Enzime
- Monofosfat ciclic de adenozină
- Antigen
- Proteină
- ADN
- Membrana celulara
Descărcați în format PDF
Despre această pagină
Volumul 2
64.2.1.2.1.1 Receptor CT
Toxinele bacteriene și receptorii lor de carbohidrați la interfața gazdă - agent patogen
Clifford A. Lingwood, Radia Mahfoud, în Glicobiologie microbiană, 2010
1.1. Toxina holerei și dizenteria
Exploatarea căilor endocitice pentru a preveni infecția cu toxine bacteriene
Toxine care leagă lipidele
Toxina AB, toxina Shiga, se localizează, de asemenea, în plute lipidice prin legarea la glicozifingolipid, Gb3. La fel ca CT, toxina Shiga poate pătrunde, de asemenea, în celule prin căi multiple, inclusiv utilizarea atât a mecanismelor dependente de clatrin, cât și a mecanismelor independente pentru a suferi un transport retrograd [33]. Este demn de remarcat faptul că toxina Shiga este, de asemenea, capabilă să-și inducă propria internalizare prin crearea de tubuli invaginatori în membrană, care ulterior se îndepărtează de membrana plasmatică printr-un proces dependent de actină și colesterol [31,32]. Calea independentă de clatrin exploatată de toxina Shiga a fost recent descrisă în detaliu [54]. Endofilina-A2 formează o schelă pe invaginațiile toxinei Shiga și, împreună cu actina și dinamina, este implicată în scindarea acestor tubuli din membrana plasmatică [54] .
În general, toxinele bacteriene sunt destul de oportuniste în modul în care intră în celule și găsirea unuia sau a unui amestec de inhibitori adecvați pentru a preveni absorbția acestor toxine s-ar putea dovedi provocatoare.
Biodetecție optică utilizând receptori și enzime (încorporate în porfirină)
9.7 Legarea toxinei holerei
Toxina holerei (CT) este o enterotoxină AB 5 produsă de Vibrio cholerae și este responsabilă pentru manifestările bolii. Mai multe publicații indică faptul că toxina se leagă de glicoproteină și că lanțul B se leagă de GM1 ganglazid pentazaharidă pe suprafața celulei (Chigorno și colab., 1982; Critchley și colab., 1979; Critchley și colab., 1981; Critchley și colab., 1982; Cuatrecasas, 1973b; Cuatrecasas, 1973a; Eidels și colab., 1983; Fishman și colab., 1978; Kuziemko și colab., 1996; Masserini și colab., 1992; Singh și colab., 2000; Van Heyningen, 1983 ). Song și Swanson (Song și colab., 1998; Song și Swanson, 1999) au conceput un mecanism de detectare pentru CT bazat pe transferul de energie de fluorescență al fluoroforului legat de GM1 cu detecție până la 0,5 nM. Kuziemko și colab. (1996) au arătat afinitatea de legare și specificitățile mai multor gangliozide pentru CT. Acestea sunt practic interacțiuni zahăr - proteine. Aspectul cheie al acestor inhibitori este că situsul de legare la galactoză al receptorului de legare a CT GM1 este similar cu cel găsit în fetuină, GMP și lactoferină. Acestea pot fi utilizate ca receptori.
Merritt și colab. (1994) au publicat structura cristalină a B-pentamerului legat de gangliozida GM1 găsită pe suprafața celulelor epiteliale intestinale umane. Afinitățile CT pentru alte gangliozide sunt date de Kuziemko și colab. (1996). Legarea CT la receptorii de membrană gangliozidică a fost demonstrată încă din 1973 de Cuatrecasas (Cuatrecasas, 1973b; Cuatrecasas, 1973a).
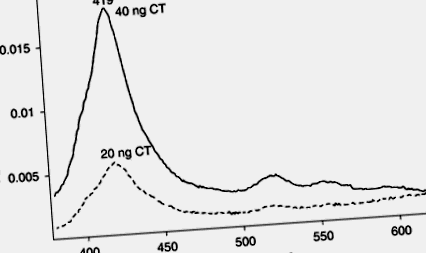
Suntem capabili să imobilizăm GM1 pe suprafața amino-terminată a lamelor Probe-On (tm). De asemenea, suntem capabili să încorporăm tetra-aminofenilporfirina porfirină în gangliozidă prin intermediul –NH- la baza cozilor de acizi grași utilizând formarea de glutaraldehidă/bază Schiff. Când subunitatea CT B se leagă, se observă o schimbare spectrală a porfirinei, așa cum se arată în Fig. 9.8. După cum se vede în Fig. 9.9, limita de detecție este sub 20 ng CT. De asemenea, am reușit să detectăm CT la niveluri de 10 ng folosind tetra-aminofenilporfirină legată de galactozamină (datele nu sunt prezentate).
9.8. Spectre de diferență ale tetra-aminofenilporfirinei încorporate în GM1 imobilizat în prezență minus absența toxinei holerei (CT).
9.9. Modificarea absorbanței de 419 nm în funcție de concentrația toxinei holerei.
Metode alternative de administrare a vaccinului
Bruce G. Weniger, Mark J. Papania, în Vaccines (Ediția a șasea), 2013
Toxine
Toxina holerei (CT) și toxina labilă la căldură E. coli sunt adjuvanți puternici, dar în formele native pot fi prea toxice pentru anumite utilizări la om (a se vedea „Exotoxine bacteriene”, mai devreme). Adjuvantul 1053, 1057–1062 LT într-un vaccin comercial elvețian antigripal pentru eliberarea IN a fost suspectat ca motiv al creșterii de mai multe ori a riscului de paralizie Bell după vaccinare, ceea ce a dus la retragerea vaccinului pe piață în 2001. 46, 47 Deși patogeneza efectului vaccinului asupra celui de-al șaptelea nerv cranian este incertă, ramurile nervului se apropie de nas. Alte efecte neurologice adverse ale CT și LT au fost ipotezate, pe baza acumulării lor în bulbii olfactivi ai șoarecilor BALB/c după administrare nazală, uneori cu inflamație concomitentă. 1063 Ca rezultat, cercetările adjuvante recente s-au concentrat pe subunități, versiuni detoxificate și alte variante de CT și LT. 1064–1081 Câteva dintre acestea, cum ar fi CTA1-DD, nu se acumulează în bulbul olfactiv al șoarecilor BALB/c. 1082
Vibrio cholerae
Toxina holerei
Odată ajuns în citosol, CtxA1 localizează proteina țintă, adenilil ciclaza reglată de proteina G localizată pe membrana basolaterală. Ribosilații CtxA1 mono-ADP Gsα, o subunitate a proteinei țintă, inițierea acțiunii constitutive și o creștere consecventă a AMPc intracelular [130]. Acest lucru determină secreția anionică în celulele criptă, în principal de clorură prin canalele CFTR apicale și inhibarea absorbției neutre a clorurii de sodiu în celulele villus, rezultând o secreție globală masivă de lichid în intestinul subțire [131]. În tranzit prin intestine, volumul de lichid depășește cu mult capacitatea normală de reabsorbție a colonului, iar la ieșirea din corp fluidul conține cantități mari de sodiu, clorură, bicarbonat și potasiu cu puține celule [132] .
Urme de transport Axonal
Subunitatea toxinei holerei
Toxina holerei (CT) este o toxină proteică bacteriană produsă de Vibrio cholerae, care se leagă de membranele celulare cu afinitate ridicată. CT este compus dintr-o subunitate activă (A), care induce toxicitate prin activarea continuă a proteinelor G stimulatoare (Gs), crescând astfel nivelurile ciclice de adenină monofosfat și o subunitate de legare homopentameră (B). Subunitatea B (CTB) se leagă de monosialogangliozidul GM1 care este grupat în microdomenii membranare de pe membrana plasmatică a diferitelor tipuri de celule, inclusiv neuroni. Odată legat la terminalul nervos, CT devine internalizată în vezicule endocitice și apoi suferă transport retrograd (cu o rată de 102 mm ziua -1). CTB recombinant menține legarea specifică a CT de lungime completă și este complet atoxic, constituind astfel o sondă de transport ideală. CTB a fost folosit pentru prima dată ca un trasor retrograd, dar recent s-a constatat că este, de asemenea, un marker de transport anterograd foarte sensibil, care oferă o definiție fină a proceselor neuronale și a terminalelor nervoase. Aplicarea subunității CTB se face fie prin ionoforeză, fie prin injecție de presiune în regiunea de interes. Marcarea celulară poate fi apoi detectată fie cu un anticorp secundar fluorescent, fie biotinilat sau prin utilizarea CTB conjugat fluorescent.
Exemplele de trasoare de transport anterograde și retrograde discutate mai sus sunt bine stabilite și utilizate pe scară largă. Cu toate acestea, transportul lor și, în consecință, etichetarea lor, se limitează la neuronii în care are loc absorbția lor, ceea ce limitează foarte mult capacitatea lor de a mapa circuitele neuronale. Trasatorii transinaptici ocolesc această limitare prin răspândirea de la neuronii inițiali la neuronii de ordinul doi și al treilea conectați sinaptic, oferind astfel informații despre conectivitatea neuronală.
Vaccinurile în teorie și practică
Enterotoxine bacteriene
Toxinele holerei (CT) și labile termice (LT) E. coli - enterotoxinele asociate sunt în strânsă legătură și provoacă, respectiv, holeră și diaree de călător. Enterotoxinele sunt adjuvanți utili care cresc prezentarea antigenului și diferențierea celulelor B în celule plasmatice producătoare de sIgA. Ambele au o utilitate limitată din cauza generării unui răspuns imun puternic la enterotoxine. Probleme semnificative de siguranță sunt legate de utilizarea enterotoxinelor intacte ca adjuvanți. Ambele sunt extrem de toxice și provoacă diaree, paralizie a lui Bell și alte efecte neurologice.
Un nou adjuvant de fuziune-proteină reduce toxicitatea asociată cu enterotoxinele. Proteina de fuziune constă din subunitatea α1 a toxinei holerice (CTA) fuzionată cu o moleculă de țintire a celulelor B (D) din proteina Staphylococcus aureus A. Adjuvantul CTA1-DD este netoxic atunci când este administrat intranazal sau parenteral. Acționează prin creșterea producției de IgA și IgG secretoare.
Boala gastro-intestinală asociată cu toxina
Efectele patogene ale toxinelor bacteriene
Câteva alte toxine bacteriene au un efect similar asupra adenilat ciclazei și sunt responsabile pentru creșterea nivelului de AMPc intracelular în celulele epiteliale intestinale. Acestea includ enterotoxinele termorezistente și stabile la căldură ale Escherichia coli enterotoxigenă (sau ETEC). Multe tulpini ETEC produc una din cele două familii înrudite de enterotoxine labile la căldură cunoscute sub numele de LT-I și LT-II. Aceste toxine sunt legate structural și enzimatic de toxina holerei și provoacă o diaree apoasă asemănătoare holerei [1,2]. S-a dovedit că și alți agenți patogeni enterici (de exemplu Aeromonas hydrophila, Pleisiomonas shigelloides) produc enterotoxine labile la căldură asemănătoare toxinei holerice implicate în patogeneză [4]. Toxinele E. coli (ST) stabile la căldură sunt o familie de peptide mici (18-19 aminoacizi) care rezistă la denaturare și pierderea activității chiar și atunci când sunt fierte timp de 15 minute. ST este mai frecvent decât LT la ETEC uman, inclusiv tulpini care produc atât LT, cât și ST. Secvența de aminoacizi a ST seamănă cu cea a guanilinei, un hormon peptidic intestinal normal care reglează secreția de clorură prin legarea și activarea unei anumite guanilat ciclază care transformă GTP în cGMP. În plus, ST pare să acționeze prin alte mecanisme pentru a diminua absorbția de NaCl non-electrogenă.
Sunt TRP ale creierului ținte viabile pentru vindecarea tulburărilor neurodegenerative și îmbunătățirea sănătății mintale?
Bernd Nilius, Arpad Szallasi și canalele TRP ca ținte terapeutice, 2015
Encefalomielita autoimună și scleroza multiplă
Toxina holerei -B se leagă de fragmentul pentazaharidic ramificat al gangliozidei, GM1. Această interacțiune proteină-gangliozidă este esențială în inițierea căii de transducție a semnalului care este responsabilă de diaree. În encefalomielita experimentală murină autoimună (EAE), administrarea unității de reticulare GM1 a toxinei holerei (așa-numita toxină B) este benefică. Toxina holerei-B este un partener obligatoriu pentru lectina endogenă, galectina-1. La aceste animale, atât toxina holerei-B, cât și galectina-1 au provocat o ameliorare simptomatică. În schimb, șoarecii lipsiți de GM1 demonstrează o susceptibilitate sporită la EAE. Activarea policlonală a celulelor T (Treg) reglatoare murine reglează în sus galectina-1. Mai mult, activarea celulelor T (Teff) cu efect CD4 + și CD8 + ridică GM1. De importanță pentru subiectul acestui capitol, activarea celulelor Teff reglează, de asemenea, TRPC5, care, la rândul său, mediază influxul de Ca 2 + pe reticularea GM1 fie prin galectină-1, fie prin toxina holerei-B. Knockdown de shRNA al Trpc5 în celulele Teff blochează inhibarea proliferării dependente de contact de către celulele Treg. Aceste observații sugerează un rol pentru TRPC5 în controlul negativ (suprimarea) autoimunității [165].
Scleroza multiplă (SM) este o tulburare demielinizantă cronică, fără încetare, progresivă. Deși patogeneza SM este necunoscută, se crede că producția crescută de glutamat joacă un rol în procesul neurodegenerativ determinat de inflamație. În sprijinul acestei ipoteze, LCR colectat de la pacienții cu SM potențează umflarea neuronală mediată de glutamat printr-un mecanism care pare să implice atât semnalizarea IL-1β, cât și stimularea AMPA-R crescută. Într-adevăr, IL-1β este semnificativ mai mare în LCR la pacienții cu SM activă. S-a emis ipoteza că TRPV1 este un mediator esențial pentru acțiunea sinaptică a IL-1β asupra sinapselor glutamatergice centrale [166]. În conformitate cu această ipoteză, într-un model de șoarece de EAE Trpv1, animalele nule prezintă infiltrare redusă a SNC de către celulele T autoreactive [167]. La pacienții cu SM, un SNP cu eroare în gena TRPV1 a fost corelat cu riscul de boală progresivă [167]. Luate împreună, aceste descoperiri identifică TRPV1 ca o potențială țintă terapeutică nouă la pacienții cu SM.
- Ierburi uscate - o prezentare generală Subiecte ScienceDirect
- Head Blight - o prezentare generală a subiectelor ScienceDirect
- Motilitatea gastrointestinală - o prezentare generală Subiecte ScienceDirect
- Fenofibrat - o prezentare generală a subiectelor ScienceDirect
- Hidrogen gazos comprimat - o prezentare generală Subiecte ScienceDirect