Mihail Inyushin
1 Departamentul de fiziologie, Central Caribbean University, Bayamon, PR 00960, SUA
Daria Meshalkina
2 Institutul Sechenov de Fiziologie și Biochimie Evolutivă, St. Petersburg 194064, Rusia
Lidia Zueva
1 Departamentul de fiziologie, Central Caribbean University, Bayamon, PR 00960, SUA
Astrid Zayas-Santiago
1 Departamentul de fiziologie, Central Caribbean University, Bayamon, PR 00960, SUA
Abstract
Transparența țesutului in vivo în spectrul de lumină vizibilă este benefică pentru multe aplicații de cercetare care utilizează metode optice, indiferent dacă implică imagistica optică in vivo a celulelor sau activitatea lor sau intervenția optică pentru a afecta celulele sau activitatea lor în adâncul țesuturilor, cum ar fi țesutul cerebral . Opinia clasică este că un țesut este transparent dacă nu absoarbe și nici nu împrăștie lumina și, prin urmare, absorbția și împrăștierea sunt elementele cheie care trebuie controlate pentru a atinge transparența necesară. Această revizuire se concentrează pe cele mai recente abordări genetice și chimice pentru decolorarea pigmenților tisulari pentru a reduce absorbția luminii vizibile și metodele de reducere a împrăștierii în țesuturile vii. De asemenea, discutăm posibilele molecule implicate în transparență.
1. Introducere
Multe animale au țesuturi transparente sau sunt complet transparente în viața lor de zi cu zi. Unele pot chiar să devină complet transparente după dorință, cum ar fi anumite moluște cefalopode care își schimbă adsorbția ușoară a pielii (Zylinski și Johnsen, 2011) [1], în funcție de indicii de adâncime picturale și de iluminarea direcțională (Zylinski și colab., 2016) [ 2]. Animalele cu transparență naturală au avantaje semnificative pentru cercetare, extinzând gama de posibilități pentru aplicarea diferitelor metode optice (Fetcho și O'Malley, 1995; O'Malley și colab., 2003; White și colab., 2008; Bin și Lyons, 2016; Antinucci și Hindges, 2016; Harrison și colab., 2016; Nicolson, 2017; Saleem și Kannan, 2018) [3,4,5,6,7,8,9,10]. Chiar dacă animalul nu este în general transparent, are de obicei celule transparente vii specializate, cel puțin în sistemul vizual al animalului, iar această transparență celulară poate fi analizată în mod specific (Zayas și colab., 2018) [11]. Se pun întrebări: De ce unele celule vii sunt transparente, în timp ce altele nu? Putem menține celulele vii în timp ce le facem transparente in vivo în scopuri tehnice? Putem face animalele transparente sau cel puțin parțial transparente sau să dezvoltăm țesuturi și organe animale transparente in vivo?
Opinia clasică este că un țesut este transparent dacă nu absoarbe și nici nu împrăștie lumina. Astfel, absorbția și împrăștierea sunt elementele cheie care trebuie controlate pentru a atinge transparența necesară a țesuturilor.
Cu excepția câtorva pigmenți, majoritatea moleculelor organice din celulă nu au capacitatea de a absorbi lumina vizibilă. Astfel, (1) eliminarea acestor pigmenți va reduce absorbția și va produce decolorarea. Acest lucru poate fi realizat chimic prin adăugarea de substanțe reactive care elimină pigmenți specifici sau genetic identificând mutații specifice care perturbă biosinteza pigmentului. După eliminarea pigmenților, motivul principal pentru orice opacitate rămasă a țesuturilor organice este împrăștierea luminii (Brunsting și Mullaney, 1974; Tardieu și Delaye, 1988) [12,13].
2. Metode de reducere a absorbției luminii
2.1. Decolorarea chimică a pigmenților
2.2. Abordarea genetică a îndepărtării pigmenților
3. Metode de reducere a dispersiei luminii
3.1. Reducerea chimică a dispersiei in vivo
3.2. Abordare genetică pentru reducerea împrăștierii
După cum am menționat deja, există o nepotrivire RI între citoplasmă și organitele celulare, precum și între celule și fluidul interstițial, care produce împrăștiere optică de către țesutul viu, iar un OCA livrat în citoplasmă poate reduce această nepotrivire. Cu toate acestea, în loc să livreze un OCA sintetic extern țesutului, acesta poate fi sintetizat chiar de celulă. Se pune întrebarea: Ce OCA endogene sunt utilizate în natură pentru a face țesuturile animale transparente (de exemplu, țesutul transparent din ochi) și cum putem manipula și concentra genetic această substanță în celulă? În prezent, majoritatea studiilor publicate au încercat să identifice mai întâi OCA naturală și genele de sinteză corespunzătoare, astfel încât să se poată aplica o abordare genetică și există două clase moleculare principale de OCA endogene care au fost identificate.
3.2.1. Glicozaminoglicanii și proteinele antigel la pește
3.2.2. Cristalinele
Celulele din tractul optic al vertebratelor sunt copleșitor de transparente. Proteinele solubile specifice cu greutate moleculară mică numite cristaline (datorită cristalinului) se găsesc în abundență deosebit de mare în citoplasma multor celule ale tractului optic al vertebratelor. Cantități mari de cristaline au fost descoperite în citoplasma celulelor corneene, atât în celulele epiteliale ale corneei, cât și în keratocitele stromale (Krishnan și colab., 2007; Jester, 2008) [69,70]. În mod similar, cristalinele sunt abundente în citoplasma celulelor fibroase foarte alungite în lentila vertebratelor și în celulele epiteliale ale lentilei (Delaye și Tardieu, 1983; Horwitz și colab., 1999; Andley și colab., 2009) [71,72,73] . În retină, cristalinele cu greutate moleculară de 23 kDa (corespunzătoare atât cristalinei αA-, cât și αB) au fost descrise în celulele Müller de broască (anuran) (Simirskiĭ și colab., 2003) [74] și s-a găsit cristalin αA în celulele fotoreceptoare ale șoarecilor și șobolanilor (Deretic și colab., 1994; Maeda și colab., 1999) [75,76]. Recent am descris cristalinul α și, în mod specific, cristalinul αA, în interiorul celulelor și fotoreceptorilor Muller de șobolan (Zayas-Santiago și colab., 2018) [11].
S-a demonstrat că cristalinele sunt importante pentru transparența celulelor atât în cornee, cât și în lentilă (Delaye și Tardieu, 1983; Takemoto, Boyle, 1998; Jester, 2008) [70,71,77]. Modificarea chimică sau genetică a cristalinelor duce la opacitate, în timp ce reducerea α-cristalinelor solubile duce la cataractă (Datiles și colab., 2008) [78]. În mod similar, în cornee, scăderea exprimării cristalinelor corneene în cheratocitele stromale a fost asociată cu o dispersie crescută a luminii in vitro și in vivo (Jester, 2008) [70]. În lentilă, au fost identificate mutații punctuale în genele care codifică cristalinele α-, β- și γ, care duc la dezvoltarea unei forme ereditare de cataractă umană, fie prezentă la naștere, fie dezvoltată la o vârstă fragedă (Graw, 2009 Andley și colab., 2009) [73.79].
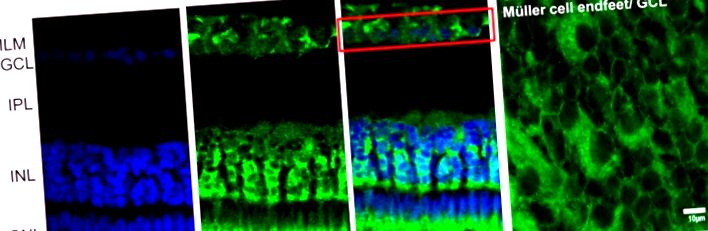
Imunolocalizarea αA-cristalinei în retina caiman. (A) αA-cristalina (CRYS, verde) este exprimată în stratul nuclear interior (INL) care înconjoară nucleii neuronilor (colorare nucleară DAPI, albastră). Cristalinul este, de asemenea, localizat în jurul nucleului celulelor ganglionare (cutie roșie) în stratul celulei ganglionare și în zona segmentului interior al fotoreceptorilor. (B) αA-cristalină observată din partea superioară a țesutului întregii retine. Cristalinul este limitat la capătul celulelor Müller din stratul celular ganglionar (săgeata albă). IPL, strat plexiform interior; ILM, membrană limitativă interioară; GCL, strat de celule ganglionare; INL, strat nuclear interior; ONL, strat nuclear exterior; IS, segmente interioare ale fotoreceptorilor. Bara de scalare în A, 20 μm și în B, 10 μm.
Implicarea αA-cristalinei în transparență poate fi dovedită și în microorganisme. Se știe că Mycobacterium poate avea fie un tip de celulă transparentă (staționară), fie opacă (în creștere), care poate fi tranziționată de la una la alta fără mutație, iar această tranziție este sensibilă la temperatură. Varianta transparentă tolerează temperaturi de creștere mai ridicate și este rezistentă la majoritatea agenților terapeutici. Deoarece este posibil ca varianta transparentă să fie agentul cauzal al bolii la om, este important să se înțeleagă mecanismul tranziției transparente-opace (Woodley, David, 1976) [89]. αA-cristalinele sunt atât proteine de șoc termic, permițând celulelor să supraviețuiască la temperaturi mai ridicate, cât și agenți care promovează transparența și este posibil ca cristalinele să fie cauza tranziției transparente la opace. Se știe că omologul α-cristalinului de 16 kDa din Mycobacterium este proteina dominantă produsă de culturile de fază staționară in vitro, dar este nedetectabilă în culturile cu creștere logaritmică (Yuan și colab., 1998; Stewart și colab., 2006) [90.91].
3.2.3. Posibilă manipulare genetică pentru a induce transparența și o perspectivă viitoare
Utilizarea glicozaminoglicanilor ca OCA manipulată genetic este dificilă, iar efectele lor nu sunt pe deplin înțelese. Pe de altă parte, αA-cristalina și gena sa de codificare sunt bine caracterizate. Deși nu există o dezvoltare activă în această direcție în prezent, sugerăm că abordarea genetică are un viitor promițător.
O dificultate constă în faptul că cristalinele au alte funcții în organism, cum ar fi să servească drept proteine de șoc termic și proteine reglatoare, iar supraexprimarea lor trebuie optimizată pentru sincronizare, intensitate și specificitatea țesutului pentru a minimiza perturbările dezvoltării și performanței organismului. Abordarea de supraexpresie are o istorie lungă de aplicare la animalele transgenice, ca supraexprimare a copiilor suplimentare ale genei țintă, menținută sub controlul unui promotor receptiv la tetraciclină sau prin exprimarea transactivatorului Cas9. Varianta cea mai adecvată din punct de vedere fiziologic este considerată a fi supraexpresia condiționată, care are loc doar în prezența inductorului și nu interferează cu dezvoltarea normală. Astfel, animalele mutate se dezvoltă normal, transparența este indusă numai înainte de experiment și gradul de transparență poate fi optimizat pentru fiecare caz.
Transactivarea expresiei genice este o capacitate a sistemului de editare genică CRISPR-Cas9 (Perez-Pinera și colab., 2013) [92]. Folosește fuziunea Cas9 inactivat („mort”) (care este capabil să formeze un complex doar cu ghidul său de ARN și să se lege de țintă, dar nu poate tăia ținta) și un domeniu de activare a transcripției, preluat de obicei de la un virus genă. Această abordare are avantajul de a exprima gena endogenă a animalului, al cărui nivel este determinat de nivelul bazal al expresiei genice și poate fi reglat prin adăugarea de domenii de activare fuzionate cu Cas9 (Cheng și colab., 2013) [93].
Un organism experimental care ar putea fi utilizat pentru această abordare este peștele zebră, care este deja transparent sub formă de larve, dar care nu are transparența necesară la adulți, datorită dispersării luminii. Prin urmare, obiectivul inducerii transparenței cristalinei la peștele zebră adult poate fi atins prin două strategii: (1) inserarea genelor cristalinei sub controlul promotorilor receptivi la tetraciclină și (2) inserarea genei Cas9 transactivator cu mai multe gene pentru ARN-uri de ghid (sgRNA). Ambele abordări au avantajele și dezavantajele lor inerente, care pot deveni obstacole în calea generării stabile a liniei celulare. Mai mult decât atât, această lucrare va permite compararea acestor abordări, ceea ce îl va face și valoros din punct de vedere metodologic.
4. Transparența in vivo a oaselor și a altor țesuturi mineralizate
5. Alte modele de transparență
6. Concluzii
Mulți anchetatori au dezvoltat metode care exploatează avantajele transparenței tisulare in vivo. Imagistica și spectroscopia in vivo convenționale, înregistrarea și stimularea activității neuronale optice, precum și optogenetica au beneficiat de o adâncime de imagistică crescută folosind diferite metode de compensare a țesuturilor optice in vivo. Există două abordări principale, chimice (farmacologice) și genetice, care reduc atât absorbția luminii, cât și dispersia. Puterea ambelor abordări a fost demonstrată, dar pentru a elimina complet efectele dăunătoare ale OCA artificiale, sugerăm că modificarea genetică pentru a obține organisme model cu țesuturi transparente reprezintă viitorul imagisticii in vivo.
Contribuțiile autorului
Autorii acestei revizuiri au participat în scris în conformitate cu domeniul lor de expertiză: L.Z. și A.Z.-S. - microscopie, D.M. - genetică, M.I. - imagistică.
Finanțarea
Această cercetare a fost finanțată de NIGMS (NIH), numărul de subvenție SC2GM111149 către MI.
Conflicte de interes
Autorii nu declară niciun conflict de interese. Finanțatorii nu au avut niciun rol în proiectarea studiului; în colectarea, analiza sau interpretarea datelor; în scrierea manuscrisului sau în decizia de a publica rezultatele.
- Ce este Aproximarea țesuturilor moi (TORe) și conexiunea WLS; Greutatea recâștigă obezitatea Ajutor
- Factorul țesuturilor ca predictor al tromboembolismului venos recurent în analizele biomarkerului malign
- Extensor de țesuturi în St.
- Dieta Yo-yo redistribuie toxine în țesuturile corpului; Olestra Plus Caloric Cut stimulează excreția toxică -
- Săruri tisulare - Nature's Miracle Micro-Nutrients și cum să le utilizați! - Sănătate bună