Departamentul de Medicină, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de Medicină, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de Medicină, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de Medicină, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de epidemiologie și biostatistică, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de epidemiologie și biostatistică, UT Health San Antonio, San Antonio, TX, SUA
Flow Cytometry Core Facility, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de sisteme celulare și anatomie, UT Health San Antonio, San Antonio, TX, SUA
Barshop Institute for Longevity and Aging Studies, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de patologie și medicină de laborator, Școala de medicină Perelman, Universitatea din Pennsylvania, Philadelphia, PA, SUA
Barshop Institute for Longevity and Aging Studies, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de fiziologie celulară și integrativă, UT Health San Antonio, San Antonio, TX, SUA
Barshop Institute for Longevity and Aging Studies, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de farmacologie, UT Health San Antonio, San Antonio, TX, SUA
Serviciul de cercetare, South Texas Veterans Health Care System, San Antonio, TX, SUA
Barshop Institute for Longevity and Aging Studies, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de fiziologie celulară și integrativă, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de Medicină, UT Health San Antonio, San Antonio, TX, SUA
Serviciul de cercetare, South Texas Veterans Health Care System, San Antonio, TX, SUA
Departamentul de Medicină, UT Health San Antonio, San Antonio, TX, SUA
Barshop Institute for Longevity and Aging Studies, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de farmacologie, UT Health San Antonio, San Antonio, TX, SUA
Serviciul de cercetare, South Texas Veterans Health Care System, San Antonio, TX, SUA
Corespondenţă
Senlin Li, Departamentul de Medicină, UT Health San Antonio, 7703 Floyd Curl Drive, San Antonio, TX 78229, SUA.
Departamentul de Medicină, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de Medicină, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de Medicină, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de Medicină, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de epidemiologie și biostatistică, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de epidemiologie și biostatistică, UT Health San Antonio, San Antonio, TX, SUA
Flow Cytometry Core Facility, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de sisteme celulare și anatomie, UT Health San Antonio, San Antonio, TX, SUA
Barshop Institute for Longevity and Aging Studies, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de patologie și medicină de laborator, Școala de medicină Perelman, Universitatea din Pennsylvania, Philadelphia, PA, SUA
Barshop Institute for Longevity and Aging Studies, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de fiziologie celulară și integrativă, UT Health San Antonio, San Antonio, TX, SUA
Barshop Institute for Longevity and Aging Studies, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de farmacologie, UT Health San Antonio, San Antonio, TX, SUA
Serviciul de cercetare, South Texas Veterans Health Care System, San Antonio, TX, SUA
Barshop Institute for Longevity and Aging Studies, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de fiziologie celulară și integrativă, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de Medicină, UT Health San Antonio, San Antonio, TX, SUA
Serviciul de cercetare, South Texas Veterans Health Care System, San Antonio, TX, SUA
Departamentul de Medicină, UT Health San Antonio, San Antonio, TX, SUA
Barshop Institute for Longevity and Aging Studies, UT Health San Antonio, San Antonio, TX, SUA
Departamentul de farmacologie, UT Health San Antonio, San Antonio, TX, SUA
Serviciul de cercetare, South Texas Veterans Health Care System, San Antonio, TX, SUA
Corespondenţă
Senlin Li, Departamentul de Medicină, UT Health San Antonio, 7703 Floyd Curl Drive, San Antonio, TX 78229, SUA.
Informații de finanțare:
Sprijinul a fost oferit de Fundația de Cercetare Medicală William și Ella Owens, o subvenție de evaluare a meritului de la Departamentul de Cercetare și Dezvoltare a Laboratorului Biomedical al Afacerilor Veteranilor (2I01BX000737), Facilitatea de citometrie a fluxului de la UT Health San Antonio (susținută de fonduri de la Universitate și NIH grant P30 CA054174), San Antonio Nathan Shock Center (NIH grant P30AG013319) și un premiu pentru științe clinice și translaționale (NIH grant TL1 TR001119). Conținutul este exclusiv responsabilitatea autorilor și nu reprezintă neapărat opiniile oficiale ale agențiilor de finanțare.
Abstract
1. INTRODUCERE
Majoritatea HSC rezidă în nișe specializate în măduva osoasă, deși unele HSC părăsesc aceste nișe și migrează în sânge,
1% –5% din totalul HSC în fiecare zi (Bhattacharya și colab., 2009). Mobilizarea HSC în sângele periferic poate fi realizată prin administrarea G-CSF (Teipel și colab., 2015), efect care este dramatic crescut atunci când G-CSF este administrat în combinație cu alți mobilizatori, cum ar fi AMD3100 (Pusic & DiPersio, 2010). Această strategie de mobilizare HSC constituie mecanismul de bază care stă la baza colectării de celule stem donatoare de sânge periferic în clinică. În mod critic, această mobilizare crescută creează, de asemenea, nișe temporar goale în măduva osoasă, deschizând o fereastră de oportunitate pentru greutatea celulelor donatoare. Aici, folosim o nouă procedură HSCT bazată pe mobilizare pentru a investiga beneficiile asociate sănătății înlocuirii HSC de la beneficiarii în vârstă cu HSC donatori tineri. În plus, profităm de proprietățile de păstrare a nișei acestui HSCT bazat pe mobilizare pentru a investiga influența semnalizării nișei în vârstă asupra unui procent redus de HSC-uri donatoare tinere.
2 REZULTATE
2.1 Chimerismul donatorilor pe termen lung a fost realizabil după condiționarea bazată pe mobilizare
Pentru a reduce efectele adverse ale agenților de condiționare citotoxici, am dezvoltat o procedură de condiționare bazată pe mobilizare, eliminând necesitatea iradierii, urmată de transplantul de HSC donatori. G-CSF și AMD3100 (agenți de mobilizare complementari) au fost folosiți pentru a mobiliza HSC la șoareci de zece săptămâni. După mobilizarea de vârf (ziua 5), șoarecii au fost transplantați cu celule de 2,0 × 10 6 - negativ, cu vârstă, celule GFP + de măduvă osoasă (Figura S1). Un total de șapte cicluri de transplant au fost efectuate pentru fiecare beneficiar, cu himerismul donatorului (GFP +) crescând cu fiecare ciclu de transplant, ajungând
90% la 1 lună după cel de-al 7-lea ciclu și stabilizarea la
77% la 4 luni după transplant (Tabelul 1).
| 1 | 26,9 ± 4,9 | 25,9 ± 7,9 |
| 2 | 36,8 ± 5,3 | 36,6 ± 4,1 |
| 3 | 48,9 ± 4,0 | 42,2 ± 4,0 |
| 4 | 61,9 ± 5,5 | 50,0 ± 1,9 |
| 5 | 69,1 ± 4,6 | 56,8 ± 7,1 |
| 6 | 80,2 ± 2,6 | 68,1 ± 9,3 |
| 7 | 90,4 ± 2,9 | 76,6 ± 7,0 |
- N = 3/grup. Varianța = deviația standard a mediei. Niciun animal nu a fost exclus din studiu.
2.2 Reconstituirea hematopoietică netoxică cu HSC tineri crește longevitatea șoarecilor primiți în vârstă
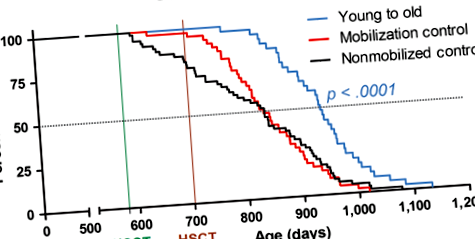
Apoi, am folosit această nouă metodă HSCT pentru a investiga impactul înlocuirii HSC în vârstă (19 luni) cu HSC donatori tineri (2 luni). Figura 1 prezintă curbele de supraviețuire pentru șoareci femele C57BL/6NIA preagețate, bazate pe un total de 144 de animale, destinatarii primind în total opt cicluri HSCT (Figura 2a). În Tabelul S2, se rezumă vârsta fiecărui grup la 50% supraviețuire și supraviețuire maximă (vârsta medie a celor mai în vârstă 10%) și este listată vârsta celui mai în vârstă supraviețuitor. Beneficiarii de HSC tineri-donatori au dat un raport de risc (HR) pentru deces de 0,33 (IÎ 95%: 0,199-0,537, p + beneficiari care primesc GFP - tineri - HSC donatori - creștere cu 17% a duratei medii a vieții și a HR de 0,14 (IC 95%, 0,054-0,348, p
Pentru a monitoriza chimerismul donatorilor, femeile care au primit vârste potrivite (19 luni) au primit HSC de două luni GFP + tinere - donatoare, în paralel cu beneficiarii în vârstă de HSC tineri donatori. Deoarece numai LT-HSC sunt capabili de auto-reînnoire pe termen lung și contribuție continuă la hematopoieză la patru luni după transplant (Dykstra și colab., 2007), am obținut probe de sânge periferic atât la una, cât și la patru luni după transplant pentru a evalua himerismul donatorului și reconstituirea celulelor donatoare pe termen. Gating pe celulele GFP + (Figura 2d), himerismul donatorului a ajuns la 91,2 ± 1,6% la 1 lună după ultimul ciclu HSCT și sa stabilizat la 74,8 ± 2,6% la 4 luni după transplant, comparabil cu himerismul donator observat la primitorii HSCT pe bază de iradiere (80,3 ± 5,6%, Figura 2e).
2.3 Reconstituirea hematopoietică netoxică întârzie acumularea de deficite asociate sănătății la șoarecii beneficiari în vârstă
2.4 Înlocuirea HSC în vârstă cu celule donatoare tinere inversează distorsionarea descendenței asociate vârstei la primitorii în vârstă
2.5 Celulele tinere - donatoare mențin o distribuție tinerească a subtipurilor de celule LSK la primitorii în vârstă
3 DISCUȚIE
Important, acest studiu include primul HSCT de succes, în care efectele adverse severe, cum ar fi scăderea rapidă a greutății corporale (Duran - Struuck & Dysko, 2009; Iestra, Fibbe, Zwinderman, Staveren și Kromhout, 2002) și supraviețuirea redusă (Guest, Ilic, Scrable și Sell, 2015) nu au fost observate. Beneficiarii care urmează această procedură HSCT bazată pe mobilizare nu au necesitat îngrijiri suplimentare - de exemplu, antibiotice, apă acidă sau schimbări frecvente în cușcă - pentru a preveni mortalitatea legată de HSCT (Duran - Struuck & Dysko, 2009). Într-un studiu în desfășurare, profilurile de toxicitate sunt comparate pentru această metodă cu procedurile convenționale HSCT (datele nu sunt prezentate). Alții proiectează regimuri de transplant care limitează toxicitatea prin eliminarea utilizării de iradiere sau medicamente chimioterapeutice, cu toate acestea, aceste metode necesită epuizarea HSC endogene (Chhabra și colab., 2016; Palchaudhuri și colab., 2016). În studiile actuale, am observat diferențe nesemnificative între toți parametrii de sănătate investigați sau în orice linie celulară investigată în sângele periferic sau în măduva osoasă la șoareci care au primit factori de mobilizare urmată de transplanturi simulate, oferind dovezi puternice ale lipsei efectelor adverse pe termen lung, în ciuda potențialei proliferări a celulelor mieloide (Knudsen și colab., 2011).
4 PROCEDURI EXPERIMENTALE
4.1 Șoareci
Toate procedurile la animale au fost efectuate în conformitate cu liniile directoare ale Institutului Național de Sănătate (NIH) și au fost aprobate de Comitetul instituțional de îngrijire și utilizare a animalelor din cadrul Centrului de Științe Sanitare de la Universitatea din Texas din San Antonio (UTHSCSA). Fondatorii de colonii (C57BL/6J, GFP - șoareci) au fost obținuți de la Institutul Național de Îmbătrânire (NIA, Bethesda, MD), provenind din Colonia Charles River. Fondatorii de colonii (C57BL/6J, GFP +) au fost obținuți din propriul nostru stoc de șoareci C57BL/6J (C57BL/6 - Tg (CAG - EGFP) 131Osb/LeySopJ) de la Laboratorul Jackson. Șoarecii donatori au fost adăpostiți și crescuți la instalația de resurse animale a laboratorului UTHSCSA în condiții standard: 12 ore ciclu lumină/întuneric, 20-22 ° C, acces ad libitum la alimente (Purina Lab Chow) și apă în rafturi ventilate cu cuști de carcasă din plastic căptușite cu așternut din lemn tăiat sau ras. Apa a fost schimbată și cuștile împrospătate săptămânal. Reproducerea femeilor care au avut parte de litiere a avut loc suficient de mult timp pentru a îndeplini cerințele de celule donatoare la un raport 2: 1 dintre șoareci donator/primitor, pe ciclu de transplant (adică, 20 de șoareci donatori pentru fiecare 10 șoareci primitori, pe ciclu de transplant). Toate procedurile mouse-ului sunt rezumate în Figura 2a și S4a.
4.2 Condiționarea bazată pe mobilizarea HSC
4.3 Condiționarea pe bază de iradiere
Doar pentru studiul de comparare a himerismului (Figura 2e), șoarecilor destinatari li s-au administrat 1.050 centigray (cGy, 123 Cs γ - raze) de iradiere totală a corpului (
80 cGy/min). Celule donatoare negative de linie GFP + de opt săptămâni (5,0 × 106) au fost transplantate în fiecare șoarece primitor iradiat prin injecție cu venă de coadă. Gentamicina la o concentrație finală de 1,0 mg/ml a fost adăugată la apa potabilă începând cu o săptămână înainte de iradiere și continuând până la patru săptămâni după transplant. Cuștile erau schimbate la fiecare două zile. Sănătatea generală a beneficiarilor iradiați a fost monitorizată de două ori pe zi pentru scăderea în greutate extremă și scorul stării corporale slabe. Animalele care prezintă semne slabe de sănătate au fost eliminate din studiu.
4.4 Colectarea celulelor donatoare
Toți șoarecii donatori utilizați în timpul colectării celulelor au fost asortați sexului (feminin) și genotipului (derivați de NIA) cu destinatari. Șoareci donatori tineri, femele, GFP + (cu vârsta de 8-10 săptămâni) au fost obținuți din propria noastră colonie de șoareci femele C57BL/6J stabiliți cu animale obținute inițial din Laboratorul Jackson. Șoareci donatori tineri, femele, GFP (de 8-10 săptămâni) au fost crescuți de la fondatorii de colonii obținuți inițial din ANI. În ziua transplantului, donatorii au fost eutanasiați prin intermediul luxația colului uterin înainte de colectarea celulelor măduvei osoase prin îndepărtarea și spălarea tibiilor, femurelor, humerelor și oaselor șoldului cu Media Dulbecco's Modified (IMDM) Iscove care conține 0,5% heparină. După liza și centrifugarea celulelor roșii din sânge, celulele descendente - negative au fost izolate folosind setul de epuizare a celulelor Lineage (Miltenyi Biotec Inc.) conform protocolului producătorului.
4.5 Evaluarea longevității
4.6 Mortalitate specifică vârstei
Rata de mortalitate instantanee la fiecare vârstă a fost calculată utilizând un model de pericol polinomial B - spline hazard presupunând o distribuție Poisson (Lambert & Eilers, 2005) folosind pericol pachet (Rebora, Salim și Reilly, 2014).
4.7 Cuantificarea deficitelor de sănătate legate de vârstă
4.8 Evaluarea consumului de alimente
Începând cu vârsta de 19 luni, aportul mediu de alimente a fost calculat lunar pentru fiecare grup de șoareci până la expirarea animalelor. Consumul mediu de alimente a fost măsurat prin înregistrarea masei totale inițiale de alimente disponibile pe cușcă, urmată de măsurarea masei de alimente rămase după douăzeci și patru de ore. Diferența de masă între alimentele disponibile inițiale și alimentele rămase după douăzeci și patru de ore a fost împărțită la numărul total de șoareci prezenți pe cușcă înainte de a calcula cu șoareci din toate cuștile măsurate în fiecare grup. Masa de alimente a fost măsurată cu ajutorul unei scale compacte CS200 (Ohaus). În plus, cuștile au fost inspectate înainte de fiecare înregistrare pentru a se vedea firimiturile de alimente. Firimitările au fost eliminate din cuști în timpul măsurării inițiale a alimentelor. Fărâmăturile găsite la douăzeci și patru de ore după măsurarea inițială au fost adăugate la totalul alimentelor disponibile pentru a asigura înregistrarea corectă a aportului alimentar. Dacă un mouse a expirat în intervalul de douăzeci și patru de ore în care a fost măsurată mâncarea, calculul a fost eliminat și a fost inițiată o nouă măsurare cu noul număr de șoareci disponibili.
4.9 Evaluarea masei corporale
Începând cu vârsta de 19 luni, masa corporală medie a fost calculată lunar pentru fiecare grup de șoareci până la expirarea animalelor. Masa corporală a fost măsurată prin înregistrarea masei șoarecilor individuali cu o scală compactă CS200 (Ohaus) și calculată în medie pentru toți șoarecii din fiecare grup. Măsurătorile au fost efectuate la aproximativ aceeași oră în fiecare lună.
4.10 Analiza sângelui periferic
Probele de sânge (40 (l) au fost colectate de la șoareci prin intermediul coada înțepând în tuburi de microfug care conțin 40 flowl flow tampon (PBS + 2,0% FBS) și heparină la un raport 3: 1 în volum (stoc 1.000 unități USP/ml). După liza celulelor roșii din sânge (tampon de liză RBC, Sigma - Aldrich), probele au fost incubate cu blocanți ai receptorilor Fc specifici pentru CD16/32 de șoarece și următorii anticorpi (diluție 1: 100) pe gheață timp de 20 de minute: Ghost Dye ™ Violet 510, anti-Cd45R/B220-PE, anti-Cd3e-Pacific Blue, anti-CD11b-PerCP-Cy5.5, anti-Ly-6G/Ly-6C-APC-Cy7 (Gr-1), anti-CD4-BV605, și anti-CD8 - Alexa Fluor 647. Celulele au fost centrifugate, resuspendate și filtrate imediat înainte de analiză într-un citometru de flux BD LSRII (BD BioSciences).
4.11 Analiza progenitorilor hematopoietici
Măduva osoasă întreagă a fost colectată prin spălarea tibiilor, femururilor, humerelor și oaselor șoldului. După liza celulelor roșii din sânge, celulele descendente - negative au fost izolate folosind setul de epuizare a celulelor Lineage (Miltenyi Biotec Inc.) conform instrucțiunilor producătorului. Celulele negative din linie au fost colorate pe gheață cu blocanți ai receptorilor Fc specifici CD16/32 de șoarece (BD Pharmingen () și cocktailuri adecvate de anticorpi pentru a determina procentele din fiecare compartiment progenitor. Celulele LT - HSC, ST - HSC și MPP au fost colorate cu anti - Sca - 1 - V - 500‐ Ly 6A/E, anti - c - Kit - BV421 - CD117, anti - Flk - 2 - PE - CF594 - CD135 și anti-CD34-Alexa-Fluor 647 timp de 20 de minute. Celulele au fost centrifugate, resuspendate în tampon de curgere (PBS + 2,0% ser fetal bovin) și apoi trecute printr-un filtru de 40 µm imediat înainte de analiză într-un citometru de flux BD LSRII (BD BioSciences).
4.12 Analize statistice
CONFIRMARE
Mulțumim lui E. Kraig și M. Jazwinski pentru ajutorul și sfaturile lor cu privire la acest proiect.
CONFLICT DE INTERESE
Autorii au declarat că nu există niciun conflict de interese suplimentar.
CONTRIBUȚIILE AUTORULUI
M.J.G., R.A.F., K.M.G., C.J.C. și S.L. a proiectat cercetări și a analizat date. J.A.G. și R.J.S. a furnizat informații științifice, statistice și tehnice critice. M.J.G. a efectuat toate lucrările experimentale cu ajutorul C.C., A.B. și G.G. S.L., J.F.N. și R.A.C. a dirijat proiectul. M.G. a scris manuscrisul cu ajutorul lui J.A.G., Y.L., J.F.N., R.S., P.J.S., R.A.C. și S.L., R.A.C., C.C. și M.J.G. au depus o cerere provizorie de brevet.
APROBARE ETICĂ
Procedurile pentru toate experimentele pe animale au fost revizuite și aprobate de Comitetul instituțional de îngrijire și utilizare a animalelor (IACUC) al Universității din Texas Health San Antonio.
Cercetare deschisă
Toate datele asociate acestui studiu sunt prezente în lucrare sau în materiale suplimentare.
Vă rugăm să rețineți: editorul nu este responsabil pentru conținutul sau funcționalitatea oricăror informații de susținere furnizate de autori. Orice întrebări (altele decât conținutul lipsă) ar trebui să fie adresate autorului corespunzător pentru articol.
- Nou mod de a activa celulele stem pentru a face părul să crească - ScienceDaily
- Nanoparticulele plus celulele stem adulte demolează placa, descoperă studiul - ScienceDaily
- Ingredient din lapte care slăbește la șoareci
- Hormonul combate grăsimile cu grăsime Orexinul previne obezitatea la șoareci prin activarea grăsimilor brune care ard calorii
- Senzori selectivi ionici pe baza de grafen indus de laser pentru evaluarea nivelurilor de hidratare umană utilizând