Tatyana V Turti
1 Centrul științific pentru sănătatea copiilor, RAMS, Prospect Lomonosovskiy, 2/62, Moscova, 119991, Rusia
Elena N Baibarina
2 Centrul de obstetrică, ginecologie și perinatologie, Moscova, Rusia
Elena A Degtiareva
3 Peoples ’Friendship University din Rusia, Moscova, Rusia
Elena S Keshishyan
4 Institutul de Cercetare Științifică din Moscova pentru Pediatrie și Chirurgie Pediatrică, Moscova, Rusia
Yurii V Lobzin
5 Institutul pentru Infecții ale Copilului, St. Petersburg, Rusia
Leyla S Namazova-Varanova
1 Centrul științific pentru sănătatea copiilor, RAMS, Prospect Lomonosovskiy, 2/62, Moscova, 119991, Rusia
Andrey P Prodeus
6 Centrul Clinic Științific Federal de Hematologie, Oncologie și Imunologie Pediatrică, Moscova, Rusia
Konstantin M Gudkov
7 Abbott, Moscova, Rusia
Anna I Kruglova
7 Abbott, Moscova, Rusia
Grigorie A Schulz
8 Abbott, Abbott Park, IL, SUA
Gerard F Notar
8 Abbott, Abbott Park, IL, SUA
Abstract
fundal
Virusul sincițial respirator (RSV) este principala cauză a infecțiilor tractului respirator inferior (LRTI) la copii la nivel global. Condițiile predispozante pentru dezvoltarea bolii RSV grave includ sugarii prematuri și cei cu boli cardiopulmonare, inclusiv bolile congenitale ale inimii (CHD) și displazia bronhopulmonară (BPD). În prezent nu este aprobat niciun vaccin pentru prevenirea infecției cu VRS. Se recomandă ca copiilor cu risc crescut să li se administreze profilactic palivizumab, un anticorp monoclonal care a fost demonstrat în mai multe studii clinice pentru a reduce ratele de spitalizare din cauza infecției cu VRS grave. Obiectivul studiului actual a fost de a determina siguranța și eficacitatea palivizumab în prevenirea bolii RSV grave la copiii cu risc ridicat din Federația Rusă. Au fost înrolați copii cu risc crescut de boală RSV gravă (adică, născuți la vârsta gestațională ≤ 35 săptămâni și vârsta ≤ 6 luni și/sau cu vârsta ≤ 24 luni cu BPD sau CHD semnificativă hemodinamic). Subiecții urmau să primească 3 până la 5 injecții lunare de palivizumab 15 mg/kg (în funcție de luna injecției inițiale) pe parcursul sezonului RSV. Obiectivul principal a fost spitalizările legate de RSV. Evenimentele adverse (AE) au fost raportate la 100 de zile după injectarea finală.
Rezultate
O sută de subiecți au primit ≥ 1 injecție cu palivizumab; 94 și-au completat programul de dozare. Nu au existat spitalizări sau decese RSV. Șase din 7 subiecți spitalizați pentru afecțiuni respiratorii/cardiace au avut un test RSV, care a fost negativ în toate cazurile. Trei AE non-grave (rinită acută intermitentă și rinită, 1 subiect; dermatită atopică, 1 subiect) au fost considerate posibil legate de palivizumab. Toate celelalte AE au fost ușoare sau moderate și s-au considerat că nu au legătură/probabil nu au legătură cu palivizumab.
Concluzie
Palivizumab a fost, în general, bine tolerat și a prevenit în mod eficient infecția cu VSR la o populație mixtă de copii cu risc ridicat din Federația Rusă.
Înregistrarea procesului
fundal
Virusul respirator sincițial (VSR) este principala cauză a infecțiilor tractului respirator inferior (LRTI) la copii la nivel global [1]. În 2005, aproximativ 33,8 milioane de cazuri de LRTI asociate cu VRS au apărut la nivel mondial la copii cu vârsta de 1 an). Toți subiecții erau albi și majoritatea (73%) aveau vârsta de 1). Vârsta gestațională medie (DE) a fost de 33,4 (5,1) săptămâni și a variat între 24 și 42 de săptămâni, iar greutatea medie (DE) la naștere a fost de 2,14 (1,02) kg. Vârsta medie (SD) la înscriere a fost de 8,2 (6,3) luni și a variat de la 2. Un total de 47% dintre subiecți trăiau cu alți copii mici, 65% trăiau într-o gospodărie cu doar 1 sau 2 camere și 24% erau expuși fumului de tutun.
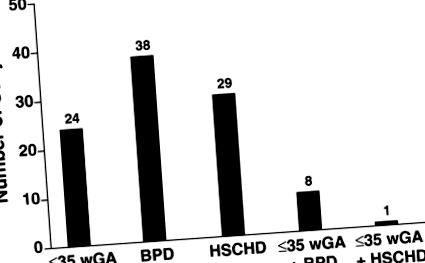
Numărul de subiecți care îndeplinesc criteriile de risc ridicat de boală RSV gravă (N = 100). BPD = displazie bronhopulmonară; HSCHD = boală cardiacă congenitală semnificativă din punct de vedere hemodinamic; RSV = virus sincițial respirator; wGA = vârsta gestațională de săptămâni.
tabelul 1
Caracteristici demografice și clinice ale subiectului (N = 100)
| Rasă,% | |
| alb | 100 |
| Gen,% | |
| Masculin | 48 |
| Femeie | 52 |
| Vârsta la înscriere | |
| ≤6 luni,% | 52 |
| 73 | |
| Media (SD), mo | 8,2 (6,3) |
| Median (interval), mo | 6.0 ( |
| Greutatea medie (DE) la naștere, kg | 2,14 (1,02) |
| Vârsta gestațională medie (SD), săpt | 33,4 (5,1) |
| Istoricul medical,% | |
| Pulmonar * | 68 |
| Sindromul de detresă respiratorie/BPD | 52 |
| Pneumonie | 25 |
| Bronșită/bronșiolită | 15 |
| Astm/boală reactivă a căilor respiratorii | 8 |
| LRTI legat de RSV | 1 |
| Cardiovascular | 61 |
| Murmur | 42 |
| Patologic | 30 |
| Funcţional | 12 |
| Boală cardiacă congenitală | 41 |
| Acianotic | 28 |
| Cianotic | 13 |
| Hipertensiune pulmonara | 10 |
| Insuficiență cardiacă congestivă | 7 |
| Aritmie cardiaca | 1 |
| Spitalizat la naștere în unitatea de terapie intensivă/critică,% | 67 |
| Spitalizat după naștere, înainte de înscrierea la studiu,% | 64 |
Displazie bronhopulmonară BPD; LRTI infecție a tractului respirator inferior; Virusul sincițial respirator RSV.
* Subiecții ar putea contribui la mai mult de o categorie.
(A) Condițiile gospodăriei și (B) expunerea la fumul de tutun (N = 100). * n = 47.
Toate dozările au avut loc între noiembrie 2009 și începutul lunii aprilie 2010, în timpul sezonului RSV în Federația Rusă [2]. Majoritatea subiecților au primit ultima injecție în martie și, astfel, au avut acoperire în aprilie în timpul vârfului sezonului RSV [2]. Palivizumabul total (SD) administrat per subiect pe parcursul studiului a fost de 516,5 (192,3) mg. Un total de 26% dintre subiecți au primit 4 doze de palivizumab; 65% au primit 5 doze. Dintre cei 15 subiecți care au suferit o intervenție chirurgicală cardiacă, 13 au avut bypass cardiopulmonar. Patru dintre acești subiecți au primit o doză suplimentară de palivizumab (2 dintre acești 4 subiecți au primit un total de 6 doze). Dintre cei 9 subiecți rămași, 5 nu au primit o doză suplimentară de palivizumab, deoarece doza lor programată în mod regulat a fost administrată la scurt timp după operație și 4 au suferit o intervenție chirurgicală fie după întreruperea studiului (n = 1), fie după perioada de profilaxie a RSV (n = 3).
Eficacitate
Nu au avut loc spitalizări din cauza infecției cu VRS în timpul studiului. Șapte subiecți au fost spitalizați în timpul studiului - 6 pentru afecțiuni respiratorii și 1 pentru afecțiuni cardiace. Șase dintre cei 7 subiecți internați au fost testați pentru antigenul RSV; toate au fost negative și niciunul nu a fost testat prin cultură virală sau test pe bază de PCR pentru a detecta acizii nucleici RSV. Nu s-a efectuat un test RSV pentru 1 subiect internat din motive respiratorii; această spitalizare a fost raportată investigatorului câteva săptămâni mai târziu. Lipsa oricăror spitalizări RSV a exclus analiza obiectivelor secundare.
Siguranță
Un total de 80 și 84 de evenimente adverse au fost raportate de 41 și 44 de subiecți în perioadele de timp de + 30 de zile și, respectiv, de + 100 de zile (Tabelul 2), dintre care majoritatea nu au fost considerate legate de palivizumab. Doar 3 evenimente adverse (rinită și rinită acută intermitentă [ambele care apar la 1 subiect] și dermatită atopică) au fost considerate posibil legate de palivizumab. Cazul de dermatită atopică (considerată ușoară ca severitate de către investigator) a fost singurul eveniment advers care a condus la întreruperea studiului de către un subiect. Evenimentele adverse au fost raportate ca fiind severe la 3 subiecți (aritmie, pneumonie și amigdalită); cu toate acestea, aceste evenimente nu au fost considerate legate de studiul medicamentului. Evenimente adverse grave au apărut la 10 subiecți în general (9 subiecți în perioada de + 30 de zile și 10 în perioada de + 100 de zile); niciunul nu a fost considerat legat de medicamentul studiat. Nu au fost raportate decese în timpul studiului.
masa 2
Cele mai frecvente evenimente adverse * (≥4% din subiecți) după severitate și relația cu medicamentul de studiu (N = 100)
| Tulburări gastrointestinale ‡ | 5 | 2 | 3 | 0 | 0 |
| Infecții | 36 | 20 | 14 | 2 || | 1 ¶ |
| Bronşită | 7 | 0 | 7 | 0 | 0 |
| Rinita | 19 | 16 | 3 | 0 | 1 ¶ |
| Infectia tractului respirator superior | 9 | 6 | 3 | 0 | 0 |
| Tulburări respiratorii, toracice și mediastinale § | 4 | 3 | 1 | 0 | 0 |
| Dermatită | 4 | 4 | 0 | 0 | 1 ¶ |
* Evenimentele adverse au fost definite ca evenimente emergente ale tratamentului, care au apărut după inițierea medicamentului de studiu și în termen de 100 de zile de la ultima doză de medicament de studiu.
† Subiecții ar fi putut avea mai mult de 1 eveniment advers.
‡ Include stenoza anală, enterita și dinții.
§ Include displazie bronhopulmonară, rinoree și hipertrofie amigdaliană.
|| Un caz de pneumonie și amigdalită.
¶ Posibil legat de medicamentul de studiu.
Discuţie
În acest studiu, palivizumab a fost, în general, bine tolerat și a prevenit în mod eficient infecția cu VSR la o populație mixtă de copii cu risc ridicat din Federația Rusă. Nu au existat spitalizări din cauza infecției cu VRS, puține evenimente adverse legate de tratament, nu au existat evenimente adverse grave legate de tratament și nu au fost raportate decese în acest studiu.
Studiile clinice controlate cu placebo, [9,10] studii observaționale, [11,12] și datele postmarketing [13-15] din America de Nord și Europa au stabilit anterior eficacitatea profilaxiei palivizumab. Studii multiple care au comparat ratele spitalizării cu VSR înainte și după introducerea palivizumab au demonstrat că spitalizările cu VSR au fost reduse după profilaxie cu 66% –92% la diferite populații de copii cu risc crescut [11,12,15]. Un studiu nu a raportat nicio diferență în rata spitalizării RSV după introducerea palivizumab, dar incidența inițială a spitalizării RSV la această populație de copii cu risc crescut a fost mai mică înainte de profilaxie (3,8%) [16] comparativ cu incidența inițială a RSV pentru populațiile cu risc crescut raportate în alte studii (
- Un studiu prospectiv, deschis, non-comparativ al profilaxiei palivizumab la copii cu vârsta mare
- Un studiu pilot al Filtrum-STI la copiii cu gastroenterită virală - Vizualizare text complet
- Fotografii Anastasia Skulkina și imagini de înaltă rezoluție - Getty Images
- Capsule de previzualizare a liceului pentru băieți; Soare Lowell
- Rezultatele studiului Belviq pot îmbunătăți averea medicamentelor pentru slăbit