Xuan Gao
1 Institutul de Științe Cardiovasculare și Medicale, Universitatea din Glasgow, Glasgow, Regatul Unit
Carlos Salomon
2 Laboratorul de biologie Exosome, Centrul pentru Diagnostice Clinice, Universitatea din Queensland Centrul de Cercetări Clinice, Royal Brisbane and Women’s Hospital, Universitatea din Queensland, Brisbane, QLD, Australia
3 Facultatea de Farmacie, Departamentul de Biochimie Clinică și Imunologie, Universitatea din Concepción, Concepción, Chile
4 Medicină materno-fetală, Departamentul de obstetrică și ginecologie, Fundația Clinicii Ochsner, New Orleans, LA, Statele Unite
5 Mater Research Institute-University of Queensland, Translational Research Institute, Woolloongabba, QLD, Australia
Dilys J. Freeman
1 Institutul de Științe Cardiovasculare și Medicale, Universitatea din Glasgow, Glasgow, Regatul Unit
Abstract
Introducere
În ultimele decenii, funcția țesutului adipos și a adipocitelor a fost supusă unui studiu amplu datorită rolului lor central în homeostazia energetică, obezitatea și diabetul (1, 2). Descoperirea adipokinelor a condus la recunoașterea rolului cheie al produselor secretoare de țesut adipos în medierea consecințelor acumulării excesive de țesut adipos și a rolului său mai larg în metabolism. Mai recent, secreția de țesut adipos a veziculelor extracelulare (EV) și rolul lor potențial în reglarea metabolismului și dezvoltarea rezistenței la insulină (IR) și a diabetului de tip 2 a fost investigat. Acest articol va analiza datele disponibile cu privire la natura EV produsă de părțile componente ale țesutului adipos și potențialele lor efecte locale și la distanță asupra organelor finale.
Veziculele extracelulare sunt vezicule sferice cu un strat strat lipidic extern, care sunt eliberate din aproape toate celulele vii de la bacterii la organismele multicelulare (3). EV-urile sunt clasificate în funcție de mărimea lor și de calea prin care au fost produse (adică membrana endocitică sau plasmatică). EV-urile sunt grupate după mărime și origine ca exosomi (
40–100 nm), microvesicule
100-1.000 nm) și corpuri apoptotice
Structura și funcția țesutului adipos
Tipuri de țesut adipos
Țesutul adipos alb uman este distribuit pe tot corpul, depozitele principale fiind clasificate ca țesut adipos subcutanat și țesut adipos visceral (7). Optzeci la sută din țesutul adipos alb se află în compartimentul subcutanat și până la 10-20% se află în compartimentul visceral, în principal în jurul mezenterului și al omentului (7). Există, de asemenea, cantități mici de țesut adipos localizate în jurul vaselor de sânge (țesut adipos perivascular) și în ficat, mușchi, articulații și măduvă osoasă. În timp ce țesutul adipos subcutanat funcționează predominant benign ca depozit de exces de acizi grași, țesutul adipos visceral este mai strâns legat de profilul metabolic și inflamator advers observat la persoanele cu obezitate și IR (8-10). Depozitele de țesut adipos maro sunt substanțiale la rozătoare, dar la om se găsesc în principal numai la sugari sau la adulți care au suferit o adaptare la frig (11). Țesutul adipos maro promovează termogeneza care nu tremură prin exprimarea proteinei 1 de decuplare în membranele sale mitocondriale și poate avea un rol important în homeostazia energetică (12). Țesutul adipos alb poate fi indus pentru a exprima unele dintre caracteristicile țesutului adipos maro, iar adipocitele rezultate sunt denumite bej (13).
Compoziția celulară a țesutului adipos
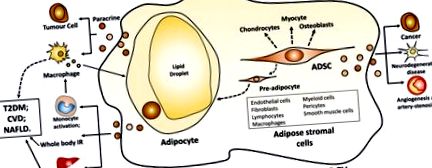
Țesutul adipos comprimă adipocitele și celulele stromale derivate din adipoză (Figura (Figura 1). 1). Adipocitele sunt principalul tip de celule din țesutul adipos. Excesul de calorii, ca acizi grași, sunt stocate în picături de lipide în adipocite sub formă de trigliceride. În perioada postprandială, nou formate, adipocite mai mici preiau mai avid acizii grași liberi eliberați din trigliceridele circulante în lipoproteinele plasmatice de către lipoproteinele lipazice rezultând în producerea de adipocite mai mari (14). Celulele stromale adipoase comprimă pre-adipocite, celule endoteliale, fibroblaste, limfocite, macrofage, celule mieloide, pericite, celule musculare netede și celule stem mezenchimale stromale (15). Celulele stromale adipoase sprijină proliferarea și diferențierea pre-adipocitelor în adipocite in vivo și in vitro și secretă o varietate de citokine și factori de creștere care exercită potențiale efecte paracrine (15). celulele stem mezenchimale derivate din țesutul adipos (ADSC) sunt multipotente și se pot diferenția în adipocite, osteoblaste, condrocite și miocite (16).
Adipocit alb și EV derivat din ADSC. Abrevieri: EV, vezicula extracelulară; ADSC, celule stem mezenchimale derivate din țesutul adipos; IR, rezistență la insulină; TGF, factor de creștere transformator; T2DM, diabet zaharat tip 2; BCV, boli cardiovasculare; NAFLD, boală hepatică grasă nealcoolică.
Extinderea țesutului adipos
Când indivizii devin obezi, aportul lor caloric în exces este stocat sub formă de trigliceride în adipocitele țesutului adipos alb. Dacă nu există o capacitate suficientă în adipocitele mature, se formează adipocite noi din pre-adipocite pentru a crește capacitatea de stocare (17). Formarea adipocitelor (adipogeneza) are loc în două faze (18). Prima fază a adipogenezei țesutului adipos alb este dedicată diferențierii și implică producerea de pre-adipocite albe angajate din celulele stem mezenchimale. Odată comise, pre-adipocitele își pierd puterea multiplă și se pot diferenția doar în adipocite sau pot prolifera. Diferențierea terminală pentru a forma adipocite albe mature are ca rezultat aspectul caracteristic al adipocitului matur conținând o singură picătură lipidică care ocupă aproape tot spațiul din celulă. În mod similar, diferențierea țesutului adipos maro cuprinde o etapă de diferențiere angajată urmată de o etapă de diferențiere terminală (18).
La unii indivizi, pare să existe o capacitate limitată de a produce adipocite mature din pre-adipocite (expansiune adipocitară hiperplazică) și, în schimb, acizii grași în exces sunt depozitați în adipocite mature existente, ducând la o creștere a dimensiunii acestora (expansiune hipertrofică) (19). Adipocitele mai mari tind să fie mai disfuncționale și devin rezistente la insulină, rezultând o lipoliză crescută datorită rezistenței la efectele anti-lipolitice ale insulinei (8). Eșecul angiogenezei și furnizarea unui aport sanguin adecvat adipocitelor hipertrofice duce la necroză, infiltrarea macrofagelor în țesutul adipos și inflamație și eliberarea adipokinei. „Spillover” de acizi grași care nu pot fi reținuți în adipocitele subcutanate duce la o creștere a compartimentului de grăsime viscerală și, în cele din urmă, la fluxul de acizi grași în locurile ectopice, stocate ca picături de lipide intracelulare în țesuturi, cum ar fi ficatul și pancreasul. Formarea grăsimii ectopice este strâns legată de dezvoltarea IR și T2DM, iar indivizii cu expansibilitate limitată a adipocitelor, cum ar fi sud-asiaticii, prezintă un risc crescut de diabet de tip 2 (20).
VE de la adipocite
Compoziția EV adipocite
Adipocitele brune murine produc exosomi și producția lor este crescută prin tratamentul AMPc (AMPc este al doilea mesager indus de expunerea la frig și stimularea β-adrenergică) (31). Producția de exosomi adipocitari de culoare bej, dar nu albă, a crescut de aproape 11 ori prin tratamentul cu AMPc (31). Când țesutul adipos întreg al șoarecelui a fost expus la frig, producția de exozomi a crescut, de asemenea (31). Profilarea miARN a exosomilor produși de adipocitele maronii marini a identificat miR-92a ca un marker specific care a fost reglat în jos la expunerea la frig (31). Hrănirea șoarecilor o dietă bogată în grăsimi a indus albirea țesutului adipos brun și o creștere a nivelului seric de miR-92a, în timp ce expunerea la frig a fost asociată cu scăderea nivelului seric de miR-92a. La oamenii slabi a căror activitate a țesutului adipos brun a fost evaluată prin absorbția marcată de glucoză, a existat o corelație negativă între activitatea țesutului adipos brun și nivelurile serice de miR-92a (31). Mai mult, la 10 subiecți umani expuși la aclimatizarea la rece timp de 10 zile, abundența miR-92a serică a scăzut și modificarea nivelurilor miR-92a a fost corelată cu modificarea activității țesutului adipos brun.
Funcțiile EV derivate din țesuturi adipoase
Adipocitele pot fi găsite în micromediul tumorii și s-a demonstrat că promovează progresia tumorii (34). Obezitatea este un factor de risc pentru melanom și progresia sa malignă. Într-un studiu al exosomilor adipocitelor subcutanate umane izolați prin ultracentrifugare diferențială (35), a existat o corelație între eliminarea exosomului de țesut adipos și IMC-ul donatorului. Atunci când sunt utilizați la concentrații egale, exosomii de la donatorii supraponderali și obezi au crescut migrația melanomului mai mult decât exosomii de la indivizii slabi într-o manieră dependentă de doză (35). Acest efect a fost considerat a fi mediat prin oxidarea acizilor grași, deoarece inhibarea etomoxirului a inversat efectul (35). Interesant, exosomii produși de adipocite 3T3-F442A mature s-au găsit prin spectrometrie de masă că conțin o abundență de proteine implicate în metabolismul lipidelor, în special cele implicate în oxidarea acizilor grași (35).
Adipocite EV și starea metabolică a întregului corp
Numărul de EV derivate din țesutul adipos visceral, dar nu subcutanat, pe gram de grăsime, cuantificat prin citometrie în flux, corelat cu HOMA-IR al întregului corp (dar nu cu indicele de masă corporală sau cu nivelurile de hsCRP) la pacienți (n = 11) cu anevrism aortic de la care au fost colectate biopsiile țesutului adipos (21). Într-un studiu similar, EV ale țesutului adipos subcutanat produse de la 16 persoane au fost corelate invers cu circumferința taliei și prezența sindromului metabolic, în timp ce EV al țesutului adipos visceral s-a corelat pozitiv cu enzimele hepatice plasmatice (24).
Microparticulele adipoase circulante, determinate de prezența perilipinei A, de la șoareci ob/ob au dus la activarea monocitelor în circulație și în țesutul adipos al șoarecilor de tip sălbatic (32). EV-urile perilipinei pozitive sunt mai mari la șoarecii cu obezitate indusă de dietă și la oamenii cu sindrom metabolic (39). La om, perilipina circulantă A-pozitivă EV ar putea fi redusă printr-o intervenție dietetică de 3 luni cu conținut scăzut de calorii. Folosind FABP-4 ca marker al exosomilor circulanți derivați de adipocite, a fost evaluată modificarea profilului miARN al exosomului derivat din adipocite la un an după intervenția chirurgicală de by-pass gastric (40). S-au observat modificări ale profilului miARN care au fost prezise pentru a regla calea de semnalizare a insulinei, iar gradul de modificare a profilului miARN legat a fost corelat atât cu modificarea IR așa cum a fost evaluată de HOMA, cât și cu modificarea nivelurilor plasmatice ale aminoacizilor cu lanț ramificat (40).
Celule stem mezenchimale derivate din țesutul adipos (ADSC)
Există un mare interes pentru țesutul adipos ca sursă de celule stem pentru medicina regenerativă pentru utilizare în cancer și alte boli. Efectele benefice ale acestor tratamente pot rezulta din efectele paracrine ale ADSC mediată de EV. Exosomii produși de ADSC izolați din țesutul adipos uman s-au dovedit a conține specii mici de ARN predominant miARN și snoARN, cu unele dovezi că speciile de ARNt sunt îmbogățite (44). Se pare că conținutul nu reflectă doar conținutul celular sursă, ci că unele specii de ARN sunt eliberate preferențial (44). Există dovezi că profilul secretor de proteine al ADSC diferă de la individ la individ și care ridică posibilitatea ca ADSC să cuprindă o populație eterogenă de celule cu subtipuri funcțional diferite și poate produce EV corespunzătoare (45). Există, de asemenea, date care sugerează că aspectele funcționale ale ADSC diferă de celulele stem derivate din alte țesuturi (46). EV-urile de la ADSC au fost considerate ca o cale de livrare pentru administrarea de miARN terapeutic către celulele bolnave.
ADSC EV în Rac
Celulele stem mezenchimale derivate din țesutul adipos au fost izolate din grăsimea abdominală de la pacienții supuși unei intervenții chirurgicale urologice neoplazice și de la participanții fără cancer (47). Profilarea miARN a exosomilor din aceste ADSC a arătat că, atât la pacienții cu cancer, cât și la cei care nu au cancer, un anumit conținut de miARN de exosomi și ADSC a fost similar. Cu toate acestea, a apărut o îmbogățire selectivă a unor miARN (let-7-a-1, miR-21 și miR-1260b) în exosomi (47). ADSC transfectat cu o plasmidă de expresie miR-122 a secretat exosomi care conțin miR-122. Când au fost adăugați exosomi care conțin miR-122 la celulele carcinomului hepatocelular, celulele au devenit sensibile la medicamentele chimioterapeutice (48). Mai mult, injecția intra-tumorală a exosomilor ADSC EV transfectați a crescut eficacitatea unui agent anticancer asupra carcinomului hepatocelular într-un model de șoarece in vivo (48). Sa demonstrat că exosomii ADSC promovează migrația unei linii celulare de cancer de sân (MCF7) (49).
ADSC EV în boala vasculară
Restenoza grefelor venoase este o problemă specială în chirurgia bypass-ului arterelor coronare. ADSC au fost utilizate pentru a încerca să reducă hiperplazia neointimală la grefele venoase. ADSC umane s-au arătat, în cultură de celule in vitro și într-un model de șoarece, pentru a reduce formarea neointimelor grefelor venelor prin inhibarea proliferării și migrației celulare a mușchiului neted vascular și reducerea migrației și inflamației macrofagelor (53). ADSC inhibă, de asemenea, activarea, diferențierea și proliferarea celulelor T (54). Într-un model porcin de sindrom metabolic și stenoza arterei renale, tratamentul cu EV autolog de la ADSC a dus la scăderea inflamației renale și la creșterea fluxului sanguin renal și a ratei de filtrare glomerulară (55). Alții au descoperit că un tratament combinat al ADSC plus exosomii derivați de ADSC au o capacitate superioară, comparativ cu unul singur, de a proteja rinichiul de leziuni acute de ischemie - reperfuzie la un model de șobolan (56).
ADSC și boala neurodegenerativă
ADSC sunt de asemenea de interes pentru tratamentul tulburărilor neurodegenerative, cum ar fi scleroza laterală amiotrofică (57). Exosomii ADSC murini protejează celulele NSC-34 asemănătoare neuronilor motori de daunele oxidative crescând viabilitatea lor (57), iar exosomii ADSC umani protejează neuronii împotriva daunelor induse de glutamat (58). Alții au arătat la șoareci in vitro că nanovesiculele și microvesiculele ADSC au prevenit apoptoza în celulele neuronale și remielinizarea crescută în feliile cerebeloase demielinizate utilizând lizofosfatidil colină (59). Din nou, EV a fost considerat un vehicul de livrare cu implicații terapeutice pentru boala neurodegenerativă. ADSC a secretat exosomi care conțin neprilysin, o enzimă majoră de degradare a peptidei β-amiloide, iar exosomii au reușit să livreze această proteină către o linie celulară de neuroblastom (N2a) rezultând o scădere a peptidei β-amiloide secretate și intracelulare (60). Prin urmare, există un potențial terapeutic pentru astfel de EV în boala Alzheimer. Mai mult, s-a demonstrat că exosomii din ADSC au potențial terapeutic într-un model de celule neuronale de șoarece in vitro al bolii Huntington (61).
Concluzie
Contribuțiile autorului
XG a analizat literatura, a scris prima schiță și a creat figura. CS a examinat articolul pentru precizie ca expert EV și a editat versiunea finală. DF a analizat literatura de specialitate, a scris proiectul final și a făcut modificări editoriale.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
Mulțumiri
Recunoaștem cu recunoștință finanțarea din următoarele surse: Diabetes UK 15/0005182, Lions Medical Research Foundation (LMRF), Universitatea din Queensland și Fondo Nacional de Desarrollo Científico y Tecnológico (FONDECYT 1170809).
- Ar putea această intervenție chirurgicală de scădere în greutate un remediu pentru diabetici de tip 2 asociați laparoscopici avansați
- Alergia experimentală alimentară duce la inflamația țesutului adipos, modificări metabolice sistemice și
- Medicamentele care combat diabetul și obezitatea pot trata Covid-19
- Grăsime și diabet de tip 1 Universitatea din Iowa Stead Family Children's s Hospital
- Remisiunea diabetului de tip 2 Cureus și reducerea substanțială a greutății corporale realizată cu metformină și