Huan Liu
a Aab Institutul de Cercetare Cardiovasculară, Departamentul de Medicină, Universitatea din Rochester Școala de Medicină și Stomatologie, Rochester, NY, SUA
b Laborator cheie de conservare și întreținere a fertilității Ministerului Educației, Departamentul de Biochimie și Biologie Moleculară, Școala de Științe Medicale de Bază, Universitatea de Medicină Ningxia, Yinchuan, China
Shuya Zhang
a Aab Institutul de Cercetare Cardiovasculară, Departamentul de Medicină, Universitatea din Rochester Școala de Medicină și Stomatologie, Rochester, NY, SUA
b Laborator cheie pentru conservarea și întreținerea fertilității Ministerului Educației, Departamentul de Biochimie și Biologie Moleculară, Școala de Științe Medicale de Bază, Universitatea de Medicină Ningxia, Yinchuan, China
Suowen Xu
a Aab Institutul de Cercetare Cardiovasculară, Departamentul de Medicină, Universitatea din Rochester Școala de Medicină și Stomatologie, Rochester, NY, SUA
Marina Koroleva
a Aab Institutul de Cercetare Cardiovasculară, Departamentul de Medicină, Universitatea din Rochester Școala de Medicină și Stomatologie, Rochester, NY, SUA
Eric M. Mic
a Aab Institutul de Cercetări Cardiovasculare, Departamentul de Medicină, Universitatea din Rochester Școala de Medicină și Stomatologie, Rochester, NY, SUA
Zheng Gen Jin
a Aab Institutul de Cercetare Cardiovasculară, Departamentul de Medicină, Universitatea din Rochester Școala de Medicină și Stomatologie, Rochester, NY, SUA
HL, SZ și ZGJ au scris manuscrisul cu comentarii și contribuții de la toți autorii. HL, SZ și MK au efectuat experimente. SX a corectat și revizuit manuscrisul. EMS a furnizat reactivi cheie. ZGJ a conceput studiul. Toți autorii au aprobat versiunea finală a manuscrisului.
Date asociate
Abstract
Fibroza hepatică este o consecință frecventă a diferitelor hepatite cronice și leziuni hepatice. Miofibroblastele, prin acumularea proteinelor din matricea extracelulară (ECM), sunt strâns asociate cu progresia fibrozei hepatice. Cu toate acestea, mecanismele moleculare care stau la baza reglării transcripționale a genelor fibrogene și a proteinelor ECM în miofibroblaste rămân în mare parte necunoscute. Folosind linii de șoarece care exprimă Cre-specific miofibroblastului inductibil cu tamoxifen cu ștergere selectivă a factorului de transcripție Yin Yang 1 (YY1), aici arătăm că ștergerea YY1 din miofibroblaste atenuează fibroza hepatică indusă de tetraclorură de carbon. Acest efect protector al ablației YY1 asupra fibrozei hepatice a fost însoțit de expresia redusă a genelor profibrogene și a proteinelor ECM, inclusiv TNF-α, TGF-β, PDGF, IL-6, α-SMA și Col1α1 în țesuturile hepatice de la șoarecii mutanți YY1. Mai mult decât atât, folosind linia de celule stelate hepatice umane (HSC) LX-2, am constatat că eliminarea YY1 în miofibroblaste prin tratament cu siRNA a diminuat proliferarea miofibroblastelor, expresia α-SMA și depunerea de colagen. Colectiv, descoperirile noastre relevă un rol specific al YY1 în miofibroblastele hepatice și sugerează o nouă strategie terapeutică pentru bolile hepatice asociate fibrozei hepatice.
1. Introducere
Factorul de transcripție Yin Yang 1 (YY1) joacă un rol crucial în diferite procese biologice, inclusiv proliferarea celulară, diferențierea și dezvoltarea [7]. Cu toate acestea, nu este clar dacă YY1 contribuie la activarea miofibroblastelor și la producerea ECM în timpul dezvoltării fibrozei hepatice. Prin utilizarea șoarecilor nou-proiectați postn Cre recombinază indusă de tamoxifen, direcționată spre gena (Postn MCM), pentru șoareci genetici YY1 în miofibroblaste, aici raportăm că ștergerea YY1 specifică miofibroblastului a inhibat formarea miofibroblastelor și a atenuat fibroza hepatică la șoarecii deficienți cu tetrach de carbon).
2. Materiale și metode
2.1. Șoareci și tratamente
Pentru a evalua efectul potențial al deficitului de YY1 la miofibroblaste asupra modelului șoarecilor cu fibroză tratați cu CCL4, șoarecii deficienți YY1 specifici ai miofibroblastelor (YY1 flox/flox, Postn MCM +) au fost generați prin încrucișarea șoarecilor YY1 flox/flox [8] cu Postn MCM + șoareci [9]. Șoarecii knockout condiționati YY1 (YY1 flox/flox) [8] au fost cumpărați de la Jackson Laboratory; Șoarecii Postn MCM + au fost înzestrați de Jeffery D Molkentin [9] (Cincinnati Children's’s Hospital). Șoarecii YX1 flox/flox au fost folosiți ca littermate de tip sălbatic (WT). Flox/flox YY1 de 10 săptămâni; Șoarecii Postn MCM + au fost hrăniți cu o dietă alimentară tamoxifen (Envigo, nr. TD.130857) timp de 8 săptămâni cu CCL4 (Sigma, Nr. Cat.289116 2 μl/g, diluat 1: 4 în ulei de măsline (Sigma, Cat Nr. O1514) injectat o dată pe zi timp de cinci zile. (Total de 12 ori). După opt săptămâni, șoarecii au fost sacrificați sub anestezie 48 de ore după ultima doză de CCL4. Toate studiile la animale au fost aprobate de Comitetul instituțional de îngrijire și utilizare a animalelor din Centrul Medical al Universității din Rochester.
2.2. Histologie și imunohistochimie
2.3. Experimente de cultură celulară
Linia de celule stelate hepatice umane (HSC) LX-2 [10] (MilliporeSigma, Nr. Cat. SCC064). Celulele LX-2 au fost cultivate în DMEM High Glucose (Millipore Cat. Nr. SLM-021-B), 2% FBS (Millipore Cat. No. ES009-B), 1% Pen/Strep (Millipore Cat. No. TMS- AB2-C) și 1% glutamină (Millipore Cat. Nr. TMS-002-C) medii. Celulele LX-2 au fost subculturate cu tripsină (Millipore Cat. Nr. SM-2003-C) și apoi trecute înainte de utilizare. Celulele LX-2 au fost stimulate de TGF-β (10 μg/ml; Sigma, Cat Nr. SAB4502958) timp de 24 de ore pentru a se transforma în miofibroblast.
2.4. transfecție siARN
Miofibroblaste la o confluență mai mare de 80% în vase de 60 mm au fost utilizate pentru transfecție. Pe scurt, agentul de transfectare RNAiMax (6 μl; Invitrogen; Cat Nr. 13-778-030) a fost amestecat cu Opti-MEM (250 μl; Invitrogen; Cat No.11-058-021), și apoi siRNA uman YY1 (25 nM, Invitrogen; Cat Nr. AM16708) sau non-target control siRNA (25 nM, Invitrogen; Cat Nr. AM4065) diluat în 250 μl Opti-MEM a fost adăugat la soluție, amestecat ușor și incubat la temperatura camerei timp de 20 min . Un total de 0,5 ml din acest amestec a fost adăugat la MF în 1,5 ml Opti-MEM și incubat timp de patru ore. Apoi, mediul a fost înlocuit cu mediu DMEM complet și celulele au fost tratate după 48 de ore după transfecție [11].
2.5. PCR cantitativ în timp real
După tratament, ARN-ul total a fost extras folosind un kit QIAGEN RNeasy Mini (Qiagen, nr. Cat. 74136) [11]. Concentrația și puritatea ARN au fost determinate de spectrofotometrul Nanodrop2000 (Thermo Fischer Scientific). Pentru transcrierea inversă, 0,5-1 μg de ARN total au fost transformate mai întâi în ADN complementar catenă (ADNc) folosind un kit de transcripție inversă ADNc de mare capacitate (Applied Biosystems, Cat No. 4374966) urmând instrucțiunile producătorului. PCR cantitativă în timp real a fost apoi efectuată cu un ciclor termic PCR în timp real Bio-Rad iQ5, utilizând iQ SYBR Green Supermix (Bio-Rad, Nr. Cat 1708886) pentru cuantificarea relativă a ARNm. Toate secvențele de exemplu au fost enumerate în Tabelul S1. Metoda comparativă a pragului ciclului (Ct) (2 - ΔΔCt) a fost utilizată pentru a determina expresia relativă a ARNm a genelor țintă după normalizarea genei menajere GAPDH sau β-actină.
2.6. Analiza Western blot
Țesuturile hepatice congelate și lizatele celulare totale au fost recoltate în tampon de liză proaspăt preparat (20 mM Tris-HCI pH 7,5, 150 mM NaCI, 1% Triton X-100, 1 mM EDTA, 1 mM EGTA, 2,5 mM pirofosfat de sodiu, 1 mM β-Glicerolfosfat, 50 mM NaF, 1 mM Na3VO4 și 1% inhibitor de cocteil proteazic). După clarificare la 4 ° C, celulele au fost rotite la 12.000 g timp de 10 minute; lizatul celular total a fost colectat pentru analiza gelului SDS-PAGE. După un transfer de 1,5 ore la 250 mV, membranele au fost blocate în tampon de blocare LI-COR diluat 1: 1 cu PBS la temperatura camerei timp de o oră. Apoi, pete au fost incubate cu anticorpi primari (enumerați în Tabelul S2) diluați în 3% BSA la 4 ° C peste noapte sau la temperatura camerei timp de o oră, urmată de incubare cu LI-COR IRDye ® 680RD capră IgG anti-șoarece (H + L) sau IRDye ® 800CW capră anti-iepure IgG (H + L) sau IRDye ® 680RD măgar anti-capră IgG (H + L) (diluare la 1: 10.000) la temperatura camerei timp de 30 min. Imaginile au fost vizualizate folosind un sistem de imagistică cu infraroșu Odyssey (LI-COR) [11]. Analiza densitometriei bloturilor a fost efectuată utilizând software-ul NIH Image J (http://imagej.nih.gov/ij/).
2.7. analize statistice
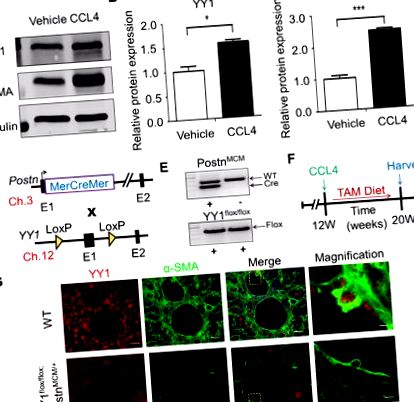
Datele sunt prezentate ca mijloace ± SEM. Analiza statistică a fost efectuată utilizând GraphPad Prism Software versiunea 5.02 (GraphPad Software, La Jolla, CA). Rezultatele au fost evaluate prin testul t sau printr-o analiză a varianței unidirecțională (ANOVA), atunci când este cazul. O valoare P P Fig. 1A și andB, B, C). C). Pentru a explora funcția YY1 derivată din miofibroblaste in vivo, am ablat în mod specific gena YY1 în miofibroblaste murine prin generarea șoarecilor knock-out YY1 specifici pentru miofibroblaste. Locusul genetic Postn a fost vizat cu un ADNc MerCreMer (MCM) inductibil de tamoxifen (MCM) [9], iar acești șoareci au fost încrucișați cu o tulpină YY1 flox/flox țintită [8] (Fig. 1D). Am generat Postn MCM +; Șoarecii YY1 flox/flox mutanți (Postn MCM +; YY1 flox/flox) șoarecii și șoarecii controlează șoarecii YY1 flox/flox de tip sălbatic (WT) (Fig. 1E). Pentru a stabili un model de șoarece de fibroză hepatică, șoarecii adulți mutanți și șoareci WT (8-10 săptămâni) au fost supuși injecției intraperitoneale de CCL4 timp de 8 săptămâni și alimentat stimulat cu tamoxifen (TAM) care conține dietă, astfel încât proteina Cre să poată facilita recombinarea în activat fibroblaste/miofibroblaste pentru a șterge gena YY1 (Fig. 1F). Folosind colorarea cu imunofluorescență dublă a YY1 și a markerului miofibroblast α-SMA, am observat o ștergere cu aproximativ 80% a proteinei YY1 în miofibroblaste în timpul fibrozei hepatice (Fig. 1G). Aceste rezultate indică faptul că alela Postn MCM elimină în mod eficient gena YY1 vizată de loxP în miofibroblaste hepatice de șoareci expuși la CCL4.
Generarea șoarecilor deficienți YY1 specifici pentru miofibroblaste. (A) Analiza Western-blot a arătat expresia proteică a YY1 și a-SMA în ficatul șoarecilor C57BL/6J cu fibroză indusă de CCL4. (B) Expresia relativă a proteinei YY1 în ficat de la șoareci martori și tratați cu CCL4. (C) Expresia relativă a proteinei a-SMA în ficat de la șoareci martori și tratați cu CCL4. (D) Strategia schematică de reproducere a diferitelor linii de șoarece. Locusul genetic Postn conținând o casetă ADNc MCM reglată de tamoxifen inserată în exonul 1 (E1) a fost încrucișată cu YY1 flox/flox conținând linii direcționate spre gene. Se arată cromozomul șoarecelui legat de fiecare alelă. (E) Imagine reprezentativă pentru genotiparea rezultatelor PCR ale Postn MCM/+; Șoareci YY1 flox/flox și șoareci YY1 flox/flox. (F) O schemă experimentală prin care șoarecii au fost injectați cu CCL4 timp de 8 săptămâni și hrăniți cu alimente tamoxifen cu 48 de ore înainte de injecția CCL4 și apoi au fost menținuți pe dieta tamoxifen până la recoltare. (G) Colorare reprezentativă a imunofluorescenței care arată că expresia YY1 pe miofibroblaste hepatice (celule α-SMA pozitive) în ficat de la șoareci WT și Postn MCM/+; Șoareci YY1 flox/flox după 8 săptămâni de injecție CCL4 (n = 4). Bara de scalare: 20 μm.
3.2. Deficitul de YY1 la miofibroblaste ameliorează fibroza hepatică la șoareci
Am stabilit un model de șoarece de fibroză hepatică prin injectarea CCL4 la Postn MCM/+ adult; Șoareci YY1 flox/flox și șoareci WT (YY1 flox/flox) timp de 8 săptămâni în prezența dietei tamoxifen, astfel încât proteina MCM să poată intermedia recombinarea în miofibroblaste. Ficatul de șoarece a fost recoltat, iar nivelul fibrozei hepatice a fost analizat mai întâi prin imagini macroscopice ale ficatului întreg (Fig. 2A). Dimensiunea ficatului de la Postn MCM/+; Șoarecii YX1 flox/flox au fost mai mari decât cei de la șoarecii WT. Mai puțini noduli în suprafața ficatului Postn MCM/+; Șoarecii YY1 flox/flox au fost vizibili în comparație cu șoarecii WT (Fig. 2A). Greutatea ficatului a fost crescută în Postn MCM/+; YY1 flox/flox ficat decât în ficatul WT (Fig. 2B). Mai mult, analiza histologică a colorării H&E a evidențiat mai puțină necroză și formarea de noduli regenerativi și septuri fibrotice în Postn MCM/+; Șoarecii YX1 flox/flox, în timp ce grupurile WT au prezentat steatoză severă și necroză (Fig. 2C). Colorarea cu roșu Picro Sirius a arătat că depunerea hepatică de colagen a scăzut remarcabil în Postn MCM/+; YY1 șoareci flox/flox comparativ cu cei de la șoareci WT (Fig. 2D). Aceste rezultate indică faptul că ștergerea YY1 din fibroblastele nou activate (miofibroblaste) reduce semnificativ răspunsul fibrotic al ficatului și inhibă în mod eficient progresia fibrozei hepatice.
Ștergerea specifică a miofibroblastelor YY1 reduce fibroza hepatică la șoareci. (A) Imagini reprezentative macroscopice ale ficatului din Postn MCM/+; Șoareci YY flox/flox și șoareci WT (flox/flox) după opt săptămâni de injecție CCL4 și tratament cu tamoxifen. (B) Comparația greutății hepatice a Postn MCM/+; YY șoareci flox/flox și șoareci WT. (C) Colorarea reprezentativă H&E a ficatului de la Postn MCM/+; YY șoareci flox/flox și șoareci WT. (D) Fotografii histologice ale colorării roșii Picro Sirius a fibrozei hepatice în Postn MCM/+; YY șoareci flox/flox și șoareci WT.
3.3. Ștergerea YY1 specifică miofibroblastelor inhibă expresia genelor fibrotice în ficat
Ștergerea YY1 specifică miofibroblastelor diminuează expresia genelor ECM și a factorilor profibrogeni din ficat. (A) PCR cantitativă în timp real a arătat expresia genei legate de fibroză în ficat din WT și Postn MCM/+; YY șoareci flox/flox după 8 săptămâni de injecție CCL4 și tratament cu tamoxifen. Datele au fost reprezentate ca media ± SEM pentru șase șoareci. * p șoareci flox/flox WT. (B) Analiza Western-blot a arătat expresia proteinelor a-SMA în ficatul Postn MCM/+; YY șoareci flox/flox comparativ cu șoareci WT. (C) Imunofluorescența a detectat expresia α-SMA în Postn MCM/+; yy flox/flox șoareci ficat comparativ cu șoareci WT. Culoarea albastră este colorarea nucleelor DAPI. Bara de scalare, 100 μM.
3.4. Depleția YY1 de către ARNsi atenuează proprietatea profibrogenă a miofibroblastelor umane
Miofibroblastele produc o cantitate semnificativă de α-SMA și colagen Iα, care contribuie la fibrogeneza ficatului [12]. Pentru a determina relevanța funcțională a YY1 în fibrogeneza declanșată de miofibroblaste, am cultivat celule HSC umane (linia celulară LX-2) și am tratat celulele cu TGF-β timp de 24 de ore pentru a induce activarea/diferențierea HSC în miofibroblaste, urmată de tratamentul YY1 siARN timp de 24 de ore până la eliminarea expresiei endogene YY1. În mod consecvent, analiza qPCR (Fig. 4A), Western blot (Fig. 4B) și imunocitochimie (Fig. 4C) au arătat că a existat o reducere semnificativă a expresiei α-SMA în miofibroblaste epuizate YY1 decât în celulele tratate cu siRNA de control amestecat . Aceste rezultate indică faptul că pierderea YY1 atenuează expresia miofibroblastelor α-SMA, sugerând că epuizarea YY1 poate opri fenotipurile miofibroblastelor și împiedica aceste celule să secrete proteine ECM (Fig. 4D).
Depleția YY1 de către ARNsi atenuează proprietatea profibrogenă a miofibroblastelor umane. (A). PCR cantitativă în timp real a detectat nivelul mARN al α-SMA și al colagenului Iα. Graficele au arătat cuantificarea expresiei mARN-ului α-SMA în celulele LX-2 expuse la TGF-β timp de 24 de ore și apoi tratate cu YY1 siARN (si-YY1) sau control ARNm (si-Con) timp de 24 de ore. Datele reprezintă media ± SEM pentru 3 experimente independente. * P șoareci MCM, am generat șoareci knockout YY1 specifici pentru miofibroblaste pentru a delimita rolul YY1 în fibroza hepatică. Rezultatele noastre indică faptul că alela Postn MCM șterge în mod eficient gena YY1 vizată de loxP din fibroblastele activate din ficat. Șoarecii Postn MCM Cre au fost folosiți recent în mai multe studii de fibroză cardiacă și s-au dovedit a fi un instrument foarte util pentru disecarea cascadelor de semnalizare care stau la baza fibrozei cardiace și a insuficienței cardiace [14]. Prin utilizarea unui model de șoarece de fibroză hepatică indusă de CCL4, am constatat că ablația genetică a YY1 în miofibroblaste protejează împotriva progresiei fibrozei hepatice. Descoperirile noastre arată că inhibarea specifică a YY1 la miofibroblaste hepatice ar putea limita progresia fibrozei hepatice in vivo.
Pe scurt, acest studiu dezvăluie o nouă funcție a YY1 specifică miofibroblastelor în promovarea fibrozei hepatice. Descoperirile noastre implică YY1 ca o țintă terapeutică nouă pentru combaterea progresiei fibrozei hepatice.
Material suplimentar
Material suplimentar
Confirmare
Acest studiu a fost susținut de subvențiile Institutelor Naționale de Sănătate (NIH) [HL128363, HL130167 către ZGJ] și de Asociația Americană a Inimii Grant-In-Aid [17GRNT33660671 către ZGJ]. SX este beneficiarul Premiului pentru Dezvoltarea Carierei de la American Heart Association (18CDA34110359). SZ a fost, de asemenea, sprijinit de subvenții de la Fundația Națională de Științe Naturale din China (81360094 și 31560290) și China de Vest de primă clasă Discipline Științe medicale de bază la Ningxia Medical University (NXYLXK20T7B07). Mulțumim Dr. Jeffery Molkentin de la Centrul Medical al Spitalului de Copii din Cincinnati pentru că ne-a furnizat șoareci Postn MCM knock-in.
Note de subsol
Anexa A. Date suplimentare
Date suplimentare la acest articol pot fi găsite online la https://doi.org/10.1016/j.bbrc.2019.05.004.
Conflicte de interes
Autorii declară că nu au niciun conflict de interese.
- Ficatul de porc - Date nutriționale
- Cartofi cu bacon și ficat - Bucătărie hrănită
- Fructul de rodie - vital pentru o dietă sănătoasă a ficatului
- Organic Detox Master Cleanse, Colon Cleanse, Liver Cleanse, Kidney Cleanse, Blood Detox, Incurables
- Modificări pre-replicative legate de fază în colerezele induse de acidul biliar în ficatul de șobolan regenerant