Date asociate
Abstract
Context și scopuri
KPV este o tripeptidă (Lys-Pro-Val) care posedă proprietăți antiinflamatorii, însă mecanismele sale de acțiune rămân încă necunoscute. PepT1 este un transportor di/tripeptidic exprimat în mod normal în intestinul subțire și indus în colon în timpul bolii inflamatorii intestinale (IBD). Scopul acestui studiu a fost de a 1) investiga dacă efectul anti-inflamator KPV este mediat de PepT1 în celulele epiteliale și imune intestinale și 2) a examina efectul anti-inflamator KPV în două modele de șoareci colită.
Metode
Celulele epiteliale intestinale umane (Caco2-BBE și HT29-Cl.19A) și celulele T umane (Jurkat) au fost stimulate cu citokine pro-inflamatorii în prezența sau absența KPV. Efectul antiinflamator KPV a fost evaluat folosind un reporter al genei luciferazei NF-κB, western blot, RT-PCR în timp real și ELISA. Experimentele de captare au fost efectuate folosind KPV rece ca un concurent pentru substratul marcat cu hPepT1 sau folosind [3 H] KPV pentru a determina caracteristicile cinetice ale captării KPV. Efectul antiinflamator al KPV a fost, de asemenea, investigat în colita indusă de DSS și TNBS la șoareci. KPV a fost adăugat la apa potabilă și inflamația a fost evaluată la nivel histologic și prin expresie pro-inflamatorie de ARNm de citokină.
Rezultate
Concentrațiile nanomolare de KPV inhibă activarea căilor de semnalizare inflamatorie NF-κB și MAP kinază și reduc secreția pro-inflamatorie de citokine. Am constatat că KPV acționează prin hPepT1 exprimat în celulele epiteliale imune și intestinale. Mai mult, administrarea orală de KPV reduce incidența colitei induse de DSS și TNBS, indicată de o scădere a expresiei citokinelor pro-inflamatorii.
Concluzie
Acest studiu indică faptul că KPV este transportat în celule de PepT1 și poate fi un nou agent terapeutic pentru IBD.
INTRODUCERE
Una dintre funcțiile normale de transport ale celulelor epiteliale intestinale este absorbția peptidelor mici din dietă prin activitatea de transport a peptidelor (1). Aceasta este mediată prin intermediul transportorului oligopeptidic cuplat H + (PepT1) care este situat la membrana apicală a celulelor epiteliale intestinale (IEC) și care cotransportă peptide și H + (2). Specificitatea hPepT1 este largă și include multe di- și tripeptide în plus față de diferite medicamente derivate din peptide (3-8). PepT1 se exprimă în principal în membranele periferice ale enterocitelor din intestinul subțire, în celulele tubulare proximale ale segmentului S1 al rinichiului și în celulele epiteliale ale căilor biliare (4, 5, 9-15). Prin contrast, în colon, expresia mARN-ului și proteinei PepT1 este scăzută (16) și uneori nu poate fi detectată (10, 15, 17). Deși PepT1 uman nu este exprimat în celulele epiteliale colonice normale (10, 16, 17), am detectat expresia acestuia la membrana apicală a celulelor epiteliale în colonul inflamat cronic (17). Interesant, am arătat, de asemenea, că celulele imune, cum ar fi macrofagele, care sunt în contact strâns cu lamina propria a intestinului, exprimă, de asemenea, PepT1 la nivelul membranelor lor (17, 18).
Deoarece expresia hPepT1 colonică este reglată în sus în IBD, activitatea sa de transport constituie un potențial nou obiectiv pentru terapiile antiinflamatorii. Mai mult, importanța exprimării hPepT1 de către celulele imune în timpul inflamației intestinale ar trebui evaluată deoarece poate fi terapeutic avantajos să se dezvolte medicamente antiinflamatoare mediate de PepT1. Tripeptida KPV (Lys-Pro-Val), care este secvența C-terminală a hormonului de stimulare a α-melanocitelor (α-MSH), are activitate antiinflamatorie (19-21) și, deși mecanismele de bază rămân de determinat, se știe că KPV inhibă activarea NF-κB, indicând inhibarea sintezei de citokine pro-inflamatorii. În studiul de față, am examinat tripeptida KPV ca mediator al efectelor antiinflamatorii prin PepT1 exprimată în celulele epiteliale și imune inflamate ale colonului, precum și proprietățile sale antiinflamatorii in vivo, utilizând modele murine de colită.
MATERIALE ȘI METODE
Cultură de celule
Celulele Caco2-BBE și HT29-Cl.19A au fost cultivate în DMEM suplimentat cu NaHCO3 14 mM, 10% FBS și penicilină/streptomicină (Invitrogen, Grand Island, NY). Celulele Jurkat au fost crescute în RPMI 1640 (Invitrogen) suplimentat cu 10% FBS.
Reactivi
Animale
Șoareci C57BL/6 femele (8 săptămâni, 18-22 g, Jackson Laboratories, Bar Harbor, ME) utilizate pentru acest studiu au fost adăpostite în grup sub o temperatură controlată (25 ° C) și fotoperiodă (12: 12 ore ciclu lumină-întuneric ), și a permis accesul nerestricționat la dieta standard și la apa de la robinet. Șoarecii au fost lăsați să se acomodeze cu aceste condiții timp de cel puțin 7 zile înainte de includerea în experimente.
Inducerea colitei
Colita a fost indusă prin adăugarea de 3% (greutate/volum) dextran sulfat de sodiu (DSS; greutate moleculară 40.000 Da; ICN Biochemicals, Aurora, OH) la apa potabilă sau prin injecție colonică de 150 mg/kg greutate corporală de trinitrobenzen sulfonic acid (TNBS; Sigma) dizolvat în etanol 50%. Inflamația colonică a fost evaluată la 8 zile după tratamentul DSS sau la 48 de ore după administrarea TNBS. N = 10 șoareci/grup.
Activitatea mieloperoxidazei (MPO) în colon
Test de reporter dual-luciferază
Analiza Western blot
Experimente de captare
Celulele Caco2-BBE au fost cultivate pe filtre timp de 15 zile (suprafață = 1cm 2; dimensiunea porilor 0,4 μm; Membranele poliesterice Transwell-Clear, Costar VWR, Suwanee, GA), spălate și stabilizate în HBSS + -10 mM HEPES (pH 7,4) în compartimentul basolateral și 10 mM MES (pH 6,2) în compartimentul apical timp de 15 minute la 37 ° C. Compartimentul apical a fost încărcat timp de 15 minute la temperatura camerei cu HBSS + -10 mM MES (pH 6,2) conținând 20 nM [3 H] KPV ± 20 mM Glicină-Leucină, sau 20 μM [14 C] Glicină-Sarcozină ± 100 μM KPV sau 20 μM [14 C] Glicină-Sarcozină ± 100 μM Glicină-Leucină sau 20 nM [14 C] Glicină-Sarcozină ± 20 mM Glicină-Leucină. Celulele au fost apoi spălate în PBS răcit cu gheață, iar radioactivitatea asociată celulelor a fost determinată prin numărarea scintilației lichide într-un contor β.
Pentru celulele Jurkat, s-au utilizat 5,10 6 celule pe test. Celulele au fost spălate de două ori cu HBSS + -10 mM MES (pH 6,2), stabilizate timp de 15 minute la 37 ° C și incubate timp de 1 oră la temperatura camerei în același tampon conținând concentrații diferite de [3H] KPV ± 20 mM glicină -Leucina. Ulterior, celulele au fost spălate în PBS rece cu gheață și s-a determinat radioactivitatea totală. Absorbțiile specifice au fost calculate după cum urmează: (absorbția peptidei radiomarcate) - (absorbția peptidei radiomarcate + Glicină-Leucină).
măsurarea AMPc
Extracția ARN și RT-PCR în timp real
ARN-ul total a fost extras din celule sau colon folosind reactivul TRIzol (Invitrogen) și transcris invers utilizând sistemul RETROscript® (Ambion Inc, Austin, Tx). Sistemul de detectare a secvenței iCycler în timp real (Bio-Rad) a fost utilizat pentru RT-PCR în timp real. Pe scurt, 10 ng de ADNc au fost amplificate la 95 ° C timp de 3 minute, urmate de 40 de cicluri de 95 ° C timp de 15 secunde și 60 ° C timp de 1 minut folosind 10 μM de primeri specifici genei (Tabelul 1, date suplimentare) și iQ SYBR Suppermix verde (Bio-Rad). Nivelurile de expresie GAPDH sau 36B4 au fost utilizate ca gene de menaj, iar inducerea pliurilor a fost calculată folosind metoda Ct după cum urmează: Δ CT = (CtTarget - Cthousekeeping) tratament - (CtTarget - Cthousekeeping) netratament, iar datele finale au fost derivate din 2 -ΔCT .
Detectarea MCR-urilor în celule
PCR de ADNc pentru fiecare dintre receptorii melanocortinei a fost realizată printr-o abordare semianestratată cu primeri înainte și invers în primii PCR și primari interni înainte (infw) și rev în PCR ulterioară așa cum s-a descris anterior (22). Grundele sunt prezentate în Tabelul 2, Date suplimentare. Produsele PCR au fost donate în pGEM ® -T Easy Vectors (Promega), amplificate și secvențiate.
analize statistice
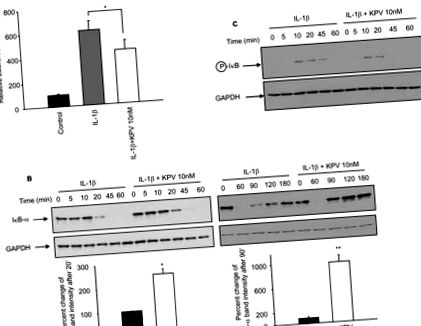
Toate evaluările au fost efectuate utilizând software-uri SigmaPlot (SPSS, Chicago, IL) și InStat v3.06 (GraphPad, San Diego, CA), cu date raportate ca medii ± SEM. Mai multe grupuri au fost comparate de ANOVA, folosind testul post-hoc al lui Tukey. * Valorile P Figura 1A). Cu toate acestea, co-incubația celulelor Caco2-BBE cu KPV (10 nM) și IL-1β a scăzut semnificativ activitatea de luciferază indusă de IL-1β (Figura 1A). Pentru a confirma că KPV scade activarea NF-κB, degradarea și fosforilarea IκB-α, care pot explica activarea NF-κB, au fost evaluate prin analize imunoblotate în celulele Caco2-BBE tratate cu IL-1β ± KPV. Am găsit niveluri ridicate de degradare IκB-α la 20 de minute după stimularea IL-1β în timp ce, în prezența KPV, degradarea IκB-α a fost redusă în acest moment (Figura 1B). Nivelul IκB-α a revenit apoi la nivelul inițial după 180 de minute de stimulare IL-1β în timp ce, în prezența KPV, nivelurile inițiale IκB-α au fost atinse în 90 de minute de stimulare (Figura 1B). Mai mult, IκB-α a fost încă fosforilat după 45 de minute de stimulare IL1-β, dar nu în prezența KPV (Figura 1C). Colectiv, rezultatele noastre arată că KPV întârzie activarea NF-κB și, de asemenea, a scurtat întârzierea recuperării IκB-α, sugerând că KPV scade durata activării NF-κB. Scăderea mediată de KPV a activității NF-κB a fost confirmată și de EMSA (Rezultate suplimentare, Figura 1).
Se știe că activarea căilor MAPK și NF-κB în IEC induce producția de citokine pro-inflamatorii care au un rol în recrutarea celulelor imune precum IL-8 (25). Pentru a examina dacă KPV afectează expresia și secreția IL-8 de către celulele Caco2-BBE, nivelurile de ARNm și proteine IL-8 au fost evaluate prin RT-PCR și ELISA în timp real. Am constatat că IL-1β a indus a
Creșterea de 200 de ori a ARNm IL-8 după 3 ore de stimulare în comparație cu celulele netratate (Figura 1E). Cu toate acestea, în prezența KPV, creșterea indusă de IL-1β a mARN-ului IL-8 a fost semnificativ redusă (cu
35%) (Figura 1E). Corelativ, creșterea concentrației de IL-8 în mediul de cultură al celulelor Caco2-BBE tratate cu IL-1β timp de 3 sau 5 ore a fost semnificativ redusă prin co-incubație cu KPV (Figura 1F).
Împreună, aceste rezultate arată că KPV reduce activarea NF-κB și MAPK, care constituie căile de semnalizare clasice implicate în secreția de citokine de către IEC inflamat.
Efectul antiinflamator al KPV este mediat de hPepT1 în celulele epiteliale intestinale
- Obstrucție intestinală parțială după înghițirea unui burete autoexpandabil pentru reducerea greutății -
- Ovăzul, tărâțele de secară pot reduce creșterea în greutate, inflamația hepatică
- Vechiul medicament oferă o nouă speranță copiilor cu tulburări devastatoare. Fenfluramina reduce crizele
- Exercițiul aerob structurat reduce masa de grăsime și este parțial compensat prin aportul de energie
- Gastrectomia mânecii reduce riscul de fractură HCPLive