Date asociate
Abstract
1. Introducere
Leucina, unul dintre aminoacizii esențiali, aparține familiei aminoacizilor cu lanț ramificat (BCAA). Au existat numeroase studii intervenționale care au indicat faptul că creșterea BCAA dietetice, inclusiv leucina, are un efect benefic pentru sănătate, legat de obezitate și diabetul de tip 2 (T2D) [1, 2, 3, 4]. Cu toate acestea, în mod paradoxal, creșterea nivelului sanguin al BCAA s-a dovedit recent a fi asociată cu riscuri crescute de T2D și rezistență la insulină [5, 6]. BCAA din sânge și metaboliții lor s-au dovedit a fi biomarkeri promițători pentru tulburările metabolice [7]. Două teorii au fost postulate pentru a explica efectul negativ potențial al creșterii BCAA din sânge asupra homeostaziei glucozei [5, 6]. Una este că creșterea nivelului de BCAA ar stimula ținta mamiferelor de rapamicină complexul 1 (mTORC1), ducând la decuplarea semnalizării insulinei prin fosforilarea substratului receptorului de insulină (IRS). A doua ipoteză este că metaboliții mitotoxici ai BCAA, dar nu și BCAA în sine, provoacă disfuncții mitocondriale ale celulelor β și agravează T2D. Deși este încă o problemă nerezolvată cu privire la mecanismul molecular care stă la baza asocierii observate a creșterii BCAA cu T2D, studiile actuale favorizează a doua teorie [6, 8].
Newgard și colab. a investigat cu atenție efectele BCAA folosind șobolani hrăniți cu dietă bogată în grăsimi (HFD) timp de 15 săptămâni [9]. BCAA suplimentare plus HFD au cauzat rezistență la insulină, în timp ce hrănirea asociată cu HFD pentru a se potrivi cu aportul de calorii nu ar duce la rezistență la insulină [9]. De asemenea, s-a constatat că suplimentarea cu BCAA plus HFD a dus la fosforilarea cronică a mTOR și INS1 în mușchiul scheletic și ficat, sugerând o suprimare a semnalizării insulinei în aceste țesuturi. În mod consecvent, sa constatat că restricția BCAA la șobolanii grași Zucker este capabilă să îmbunătățească sensibilitatea la insulină în mușchii scheletici prin creșterea oxidării acizilor grași și a exportului de acil-glicină [10]. Ștergerea BCATm, o enzimă care catalizează primul pas al metabolismului BCAA, duce la o creștere a cheltuielilor de energie și la îmbunătățirea toleranței la insulină la șoareci, în asociere cu activarea unui ciclu inutil de transformare a proteinelor [8]. În ultimul timp, s-a constatat că kinaza și fosfataza care reglează cetoacidul dehidrogenază cu lanț ramificat (BCKDH), o enzimă crucială pentru catabolismul BCAA, poate modula homeostazia glucozei la șobolanii grași Zucker prin ATP-citrat liaz [11].
Deși BCAA și în special leucina joacă roluri importante în reglarea homeostaziei glucozei, în prezent nu este clar dacă reducerea BCAA dietetice este eficientă ca strategie intervențională în îmbunătățirea sensibilității la insulină și intervine în T2D. În ultimul timp, postul intermitent sa dovedit a fi o modalitate promițătoare de a îmbunătăți funcția celulelor β și de a îmbunătăți controlul glicemic la șoarecii diabetici [21]. Postul intermitent cu o dietă care mimează postul este capabil să intervină în progresia diabetului la șoareci prin creșterea numărului de celule β din insule. Mai mult, postul intermitent cu o dietă care mimează postul la om este capabil să reducă factorii de risc asociați cu tulburările metabolice [22]. Cu toate acestea, în prezent nu există niciun studiu care să combine conceptul de „post intermitent” cu „privarea de leucină”. În acest studiu, am explorat ideea dacă deficitul intermitent de leucină este sau nu capabil să intervină în progresia T2D într-un model de șoarece diabetic [6].
2. Materiale și metode
2.1. Modelul mouse-ului
Șoarecii de sex masculin C57BL/ksJ-db (db/db) de șase săptămâni au fost achiziționați de la SLAC (Shanghai, China) și întreținuți într-o singură cușcă și în stare fără patogeni la unitatea animală a Institutului de Științe Biologice din Shanghai (SIBS), Academia Chineză de Științe (CAS). Toți șoarecii au fost ponderați la început și distribuiți aleatoriu la două grupuri: chow normal cu acces gratuit la perechea de alimente și apă (CTRL, n = 8) și privarea intermitentă de leucină în fiecare zi (LEU-, n = 8). Perechea de alimente (cu aminoacizi complet) și alimente cu deficit de leucină au fost obținute de la Research Diets, Inc. (New Brunswick, NJ, SUA; Cat A05080202 pentru dieta rozătoarelor L-aminoacizi fără leucină adăugată și Cat A10021B pentru dieta rozătoarelor L-aminoacizi). Aceste diete erau izocalorice și aveau aceeași compoziție în ceea ce privește glucidele și lipidele. În plus, cuștile au fost schimbate atunci când dieta a fost schimbată, astfel încât șoarecii nu au avut acces la propriile pelete fecale. Aceste experimente au fost efectuate în conformitate cu liniile directoare ale Comitetului instituțional de îngrijire și utilizare a animalelor din Institutul pentru Științe Nutritive, SIBS, CAS cu un număr de aprobare 2010-AN-8.
2.2. Măsurarea glicemiei și insulinei
Șoarecii au fost postiti timp de 6 ore (9:00 a. M ± 15:00 p. M) înainte de măsurarea glicemiei. Glicemia a fost măsurată prin vena cozii utilizând sistemul OneTouch UltraEasy de monitorizare a glicemiei din sânge (Lifescan, Milpitas, CA, SUA). Nivelurile serice de insulină au fost măsurate prin testul imunosorbent legat de enzima șoarecelui (Shanghai Enzyme-linked Biotechnology Co., Shanghai, China), conform instrucțiunilor producătorului. Sângele întreg a fost retras prin îndepărtarea globilor oculari, iar plasma a fost separată prin centrifugare la 3.000 rpm timp de 15 minute în microtuburi tratate cu EDTA-K2 (Kangjian Medical, Jiangsu, China). Evaluarea modelului homeostatic (HOMA) a fost metoda utilizată pentru a cuantifica rezistența la insulină (HOMA-IR) și funcția celulei beta (% B). HOMA-IR a fost calculat utilizând următoarea formulă: HOMA-IR = (glucoză de post × insulină de post)/22,5. HOMA% B a fost calculat utilizând următoarea formulă: HOMA-% B = (20 x insulină de post)/(glucoză de post - 3,5)%.
2.3. Testarea toleranței la glucoză (GTT) și testarea toleranței la insulină (ITT)
Înainte de test, șoarecii au fost cușcați singuri și au postit timp de 4 ore pentru ITT (post de dimineață) și au postit peste noapte pentru GTT. Glucoza (2 g/kg) sau insulina (2 unități/kg) au fost injectate intraperitoneal. Nivelurile de glucoză din sânge au fost măsurate la 0, 15, 30, 60 și 90 de minute după injectare.
2.4. Analiza compoziției corpului
Compoziția corpului șoarecilor a fost evaluată la vârsta de 2 luni prin echoMRI (Houston, TX, SUA) și datele despre masa totală de grăsime și masa slabă au fost înregistrate pentru fiecare șoarece, conform instrucțiunilor producătorului.
2.5. Măsurarea ratei metabolice și a activității fizice
Șoarecii la vârsta de 2 luni au fost alocați aleatoriu (n = 4 pentru fiecare grup) la testarea ratei metabolice și a activității fizice de către sistemul complet de monitorizare a animalelor de laborator (CLAMS-16, Columbus Instruments, OH, SUA), conform instrucțiunilor producătorului . Șoarecii au fost lăsați să se adapteze la sistem timp de 24 de ore. Absorbția de oxigen (VO2), producția de dioxid de carbon (VCO2) și raportul de schimb respirator (RER) au fost înregistrate în următoarele 24 de ore. Locomoția a fost monitorizată din rupturile fasciculului axei X.
2.6. Analiza imunofluorescenței
2.7. Măsurarea parametrilor serici și hepatici
Șoarecii au fost eutanasiați ad libitum în jurul orei 13:00. pe dieta de control și sângele a fost imediat colectat din sinusul orbital în microtuburi tratate cu EDTA-K2 (Kangjian Medical, Jiangsu, China). Apoi microtuburile au fost centrifugate la 3.000 rpm timp de 15 min și serul supernatant a fost colectat și depozitat la -80 ° C. Lipidele hepatice au fost extrase cu cloroform/metanol (2: 1). Nivelurile plasmatice de aspartat transaminază (AST) și alanină transaminază (ALT) au fost determinate de setul de determinare AST/ALT (ShenSuo UNF, Shanghai, China). Nivelurile plasmatice și hepatice ale trigliceridelor (TG), colesterolului total (TC), au fost determinate de kituri corespunzătoare (ShenSuo UNF, Shanghai, China). Toate aceste teste au fost efectuate conform instrucțiunilor producătorului.
2.8. Colorarea H&E a probelor de ficat și pancreas
Probele de ficat și pancreas de șoareci au fost colectate și spălate în PBS, apoi fixate în paraformaldehidă 4% peste noapte. După aceea, probele au fost deshidratate și încorporate în parafină. În cele din urmă, probele au fost secționate în felii groase (4 μm). Apoi probele au fost colorate cu hematoxilină și eozină (H&E). Imaginile au fost capturate folosind un obiectiv de 10 ori cu un microscop OLYMPUS BX51.
2.9. Anticorpi și imunoblotare
Anticorpii au fost cumpărați după cum urmează: anticorpii împotriva AKT, p-AKT, IR, p-IR, provin de la Cell Signaling Technology (Danvers, MA, SUA). Anticorpii împotriva S6k și p-S6K provin de la Santa Cruz Biotechnology (Dallas, Texas, SUA). Protocoalele pentru imunoblotare au fost descrise anterior (Feng și colab., 2007).
2.10. Analiza aminoacizilor serici
Serul șoarecilor a fost colectat așa cum s-a descris anterior. Apoi probele de ser au fost precipitate și diluate în urma marcării cu reactivul aTRAQTM Δ8. După aceea, am combinat aTRAQTM Reagent samples8-Labled samples și aTRAQTM Internal Standard. Probele derivate au fost introduse în sistemul Agilent 1200 LC. Pentru analiza LC-MS/MS s-au utilizat sistemul AB SCIEX 4000 QTRAP LC-MS/MS cu sursă de ioni TurbolonSpray (Foster City, California, SUA). Standardul intern a fost utilizat pentru a cuantifica rezultatele.
2.11. Colectarea probelor fecale de șoareci
Toți șoarecii au fost în cuști individual. Probele fecale proaspete de șoareci au fost colectate de către pensete în microtuburi între orele 14:00 - 15:00. la libitum pe o dietă de control pentru a minimiza posibilele efecte circadiene. Probele au fost colectate în tuburi goale de Eppendorf pe gheață și stocate imediat la -80 ° C pentru utilizare ulterioară.
2.12. Analiza microbiotei intestinale
ADN-ul fecal a fost extras folosind trusa ADN de sol E.Z.N.A.® (Omega Bio-tek, Norcross, GA, SUA) conform instrucțiunilor producătorului. Concentrația și purificarea ADN au fost determinate de spectrofotometrul UV-vis NanoDrop 2000 (Thermo Scientific, Wilmington, SUA), iar calitatea a fost verificată folosind 1% electroforeză pe gel de agaroză. Regiunile V3-V4 au fost apoi amplificate. Apoi, produsele PCR au fost extrase dintr-un gel de agaroză 2% și purificate folosind kitul de extracție a gelului ADN AxyPrep (Axygen Biosciences, Union City, CA, SUA). Produsele purificate au fost combinate în echimolar și secvențiat (2 × 300) pe o platformă Illumina MiSeq (Illumina, San Diego, SUA) în conformitate cu protocoalele Majorbio Bio-Pharm Technology Co. Ltd. (Shanghai, China). Fișierele rapide fastq au fost demultiplexate, filtrate de calitate de Trimmomatic și combinate de FLASH. Unitățile taxonomice operaționale (OTU) au fost grupate cu o limită de similaritate de 97% utilizând UPARSE (versiunea 7.1 http://drive5.com/uparse/) și secvențele himerice au fost notate și șterse folosind UCHIME. Taxonomia fiecărei secvențe de gene ARNr 16S a fost studiată prin algoritmul clasificatorului RDP (http://rdp.cme.msu.edu/) împotriva bazei de date rRNA 16S Silva (SSU123) folosind pragul de încredere de 70%.
2.13. analize statistice
Toate datele sunt exprimate ca mijloace ± SEM. Diferențe semnificative au fost evaluate prin testul t Student cu două cozi. Testele statistice au fost efectuate folosind Microsoft Excel (Microsoft, Redmond, WA, SUA), R v3.3.2 sau Prism6 (GraphPad Software, La Jolla, CA, SUA), după caz.
3. Rezultate
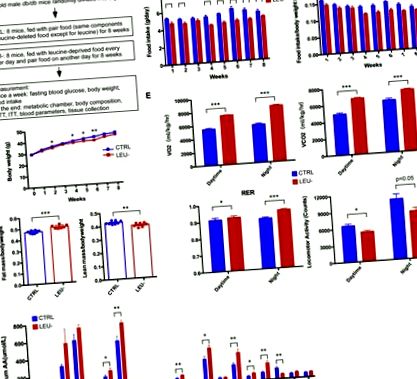
3.1. Privarea intermitentă de leucină modifică compoziția corpului, rata metabolică și activitatea fizică la șoarecii db/db
3.2. Privarea de leucină în fiecare zi reduce glicemia în repaus alimentar și îmbunătățește sensibilitatea la insulină
În continuare am investigat dacă privarea intermitentă de leucină ar putea avea sau nu impact asupra homeostaziei glucozei. Șoarecii db/db au dezvoltat T2D sever în perioada experimentală arătată ca o creștere continuă a nivelului de glucoză din sânge în repaus alimentar (Fig. 2 A). Cu toate acestea, privarea intermitentă de leucină a împiedicat în mod semnificativ dezvoltarea T2D la acești șoareci. Începând cu a cincea săptămână, nivelul glicemiei în jeun a fost redus semnificativ prin lipsa intermitentă de leucină (Fig. 2 A). În mod consecvent, toleranța la glucoză și sensibilitatea la insulină a șoarecilor, măsurate prin GTT și ITT, au fost ambele îmbunătățite semnificativ prin lipsa intermitentă de leucină (Fig. 2 B și C). HOMA-IR calculat a fost redus prin lipsa intermitentă de leucină (Fig. 2 D). Pe de altă parte, funcția calculată a celulei β a fost semnificativ crescută prin deficiența de leucină (Fig. 2 E). Aceste date, colectiv, indică faptul că privarea intermitentă de leucină este capabilă să intervină în dezvoltarea T2D la șoarecii db/db.
Privarea intermitentă de leucină scade nivelul glicemiei la jeun și îmbunătățește sensibilitatea la insulină la șoarecii db/db. (A) Nivelurile de glucoză din sânge ale celor două grupuri de șoareci (n = 8 șoareci/grup). Probele de sânge au fost colectate o dată pe săptămână. Șoarecii au fost postiti timp de 6 ore (post dimineața) înainte de măsurarea glicemiei. Un nivel al glicemiei în jeun> 11,1 mmol/L a fost definit ca diabetic (linie punctată). (B, C) Testul de toleranță la glucoză (GTT) și testul de toleranță la insulină (ITT) în săptămâna 9. Zona de sub curbă (ASC) este prezentată în panoul din dreapta pentru fiecare test. (D, E) Evaluarea modelului homeostatic (HOMA) a rezistenței la insulină (IR) și a funcției stării de echilibru a celulei β (% B) în săptămâna 9. Datele sunt exprimate ca medii ± SEM. * p Fig. 3 A). Colorarea fluorescenței secțiunilor pancreasului cu anticorpi specifici împotriva insulinei și glucagonului a demonstrat că numărul de celule β a fost crescut prin lipsa intermitentă de leucină, împreună cu o creștere a numărului de celule α (Fig. 3 B și C). Nivelul de insulină din sânge în condiții de post nu a fost semnificativ diferit între cele două grupuri de șoareci (Fig. 3 D). Cu toate acestea, nivelul de insulină din sânge în condiții de hrănire a fost semnificativ crescut de lipsa de leucină (Fig. 3 D). Prin urmare, aceste date indică în mod clar că privarea de leucină intermitentă este capabilă să prevină în mod eficient pierderea celulelor β la șoarecii db/db.
Dimensiunea insulei pancreatice și numărul de celule β sunt îmbunătățite prin lipsa intermitentă de leucină. (A) Colorare reprezentativă H&E a insulelor din secțiunile pancreasului. Bara de scalare: 50 μm. Raportul dintre zona insulei în secțiunile pancreasului este prezentat în panoul din dreapta. (B) Colorarea reprezentativă a imunofluorescenței secțiunilor pancreatice cu anticorpi împotriva insulinei și glucagonului. Nucleul a fost colorat cu Hoechst 33342. Bara de scală, 50 μm. (C) Cuantificarea celulelor β și a celulelor α pe insulă pe baza colorării imunofluorescente. (D) Nivelurile de insulină serică, atât în condiții de repaus alimentar, cât și în stare de hrănire. Eșantioanele de sânge au fost colectate în săptămâna 9. Șoarecii au fost postiti timp de 6 ore pentru stare de post (n = 8 șoareci/grup). Datele sunt exprimate ca mijloace ± SEM. * p Fig. 3), am investigat apoi dacă creșterea celulelor β la șoareci este asociată cu modificări ale proliferării celulare și ale expresiei Ngn3, un marker pentru progenitori care dau naștere la celule β [21]. Colorarea imunofluorescentă cu anticorp Ki67, un marker pentru proliferarea celulară, a dezvăluit că rata de proliferare celulară a celulelor β a fost semnificativ crescută prin privarea intermitentă de leucină (Fig. 4 A). Pe de altă parte, colorarea Ngn3 în insulițe a fost, de asemenea, crescută prin lipsa intermitentă de leucină (Fig. 4 B). Prin urmare, aceste date indică faptul că privarea de leucină intermitentă este capabilă să mărească proliferarea celulelor β și să ridice numărul de progenitori ai celulelor β.
Privarea intermitentă de leucină crește proliferarea celulelor β și expresia Ngn3 în insule. Colorare imunofluorescentă reprezentativă a secțiunilor pancreatice pentru a detecta Ki67 (A) și Ngn3 (B). Bara de scalare, 50 μm. Nucleul a fost colorat cu Hoechst 33342. Cuantificarea imaginilor este prezentată în panoul din dreapta. Datele sunt exprimate ca mijloace ± SEM. *** p Fig. 5 A). În mod consecvent, nivelurile trigliceridelor hepatice și ale colesterolului total au fost semnificativ crescute prin deficit de leucină (Fig. 5 B). În plus, nivelurile sanguine ale ALT și AST au fost semnificativ crescute prin deficit de leucină (Fig. 5 C). Colectiv, aceste date indică faptul că steatoza hepatică și funcția ficatului sunt compromise de lipsa intermitentă de leucină la șoarecii db/db.
3.6. Modificări ale microbiotei intestinale prin lipsa intermitentă de leucină
Pentru a avea o mai bună înțelegere a profilului microbian intestinal al șoarecilor, am efectuat apoi analiza genei 16S rARN a bacteriilor fecale de șoareci. Mai mulți indici pentru diversitatea alfa, inclusiv indici Shannon, Simpson, Ace și Chao, au arătat că nu a existat nicio diferență semnificativă între cele două grupuri (Fig. 6), indicând faptul că bogăția microbiomului nu a fost modificată. După cum se arată în curbele de rarefacție respective (Fig. 7), aceste curbe au devenit mai plate la dreapta, ceea ce înseamnă că numărul secvențelor analizate a fost suficient și comunitatea microbiotei intestinale a fost pe deplin reprezentată.
Diversitatea alfa a microbiotei intestinale în cele două grupuri de șoareci. Estimatori ai diversității alfa a indicelui Shannnon (A), indicelui Simpson (B), indicelui Ace (C) și indicelui Chao (D) la nivel de gen (n = 7 șoareci/grup).
Curba de rarefacții a microbiotei intestinale în cele două grupuri de șoareci. Curbele rare ale indicelui Shannnon (A), indicelui Simpson (B), indicelui Ace (C) și indicelui Chao (D) la nivelul genului (n = 7 șoareci/grup).
Privarea intermitentă de leucină modifică compoziția microbiotei intestinale la șoarecii db/db. (A) Gruparea ierarhică a microbiotei intestinale la nivel de gen (n = 7 șoareci/grup). (B) Grafic PCoA bazat pe abundența relativă a microbiomului la nivel de gen. (C) Graficul barei de testare a sumei de rang Wilcoxon care prezintă modificări semnificative în abundența relativă la nivel de filum. Valoarea p este afișată în dreapta. * p (196K, pdf) Figura 1 suplimentară
- Dieta scăzută față de cea bogată în carbohidrați în diabetul de tip 1 Un crossover randomizat de 12 săptămâni, deschis
- Factorii stilului de viață prezic probabilitatea modificărilor dietei după diagnosticul de diabet de tip 2
- Dieta bogată în săruri dublează riscul cardiac în diabetul de tip 2 - Autogestionarea diabetului
- Dieta bogată în grăsimi protejează șobolanii BBOK de apariția diabetului de tip 1 - PubMed
- Dieta cu conținut scăzut de calorii oferă speranță de vindecare a diabetului de tip 2 Diabetes The Guardian