Date asociate
Abstract
Efectele IL-6 asupra mușchiului scheletic.
Introducere
Țesutul muscular scheletic reprezintă peste 80% din absorbția glucozei mediată de insulină și oxidarea acizilor grași (Breen și colab., 2008). Mușchiul scheletic joacă un rol fundamental în homeostazia glucozei prin conversație interactivă cu țesutul hepatic și adipos (Kim și colab., 2008). Prin urmare, scăderea transportului glucozei în țesutul muscular poate duce la rezistență la insulină (Breen și colab., 2008; Zygmunt și colab., 2010).
Multe studii au demonstrat rezistența la insulină în asociere cu inflamația cronică de grad scăzut (Kim și Sears, 2010; Chen și colab., 2015). În starea de inflamație cronică, infiltrarea macrofagelor modifică proprietățile metabolice ale celulelor musculare care produc citokine inflamatorii precum IL-6 și TNF-α (Kim și colab., 2013). Un studiu recent a descris efectele duale ale IL-6 asupra acțiunii insulinei în mușchiul scheletic (Nieto-Vazquez și colab., 2008). Mai exact, tratamentul pe termen scurt cu IL-6, controlul îmbunătățit al glucozei și sensibilitatea la insulină, în timp ce tratamentul pe termen lung cu IL-6 a contribuit la intoleranță la glucoză și rezistență la insulină (Nieto-Vazquez și colab., 2008; Kim și colab., 2013 ). Este general acceptat faptul că epuizarea IL-6 îmbunătățește reglarea glucozei și obezitatea la modelul șoarecelui (Klover și colab., 2005) și rezistența la insulină asociată obezității în diabetul de tip 2 la om (Mashili și colab., 2013).
În mușchii scheletici umani, s-a raportat că expunerea pe termen lung la IL-6 reglează în jos expresia proteinelor STAT3 și SOCS3 (Senn și colab., 2003; Kim și colab., 2008; Mashili și colab., 2013). STAT3 este implicat în dezvoltarea rezistenței la insulină indusă de IL-6 în miotuburile scheletice cultivate obținute de la pacienții cu toleranță la glucoză afectată (Kim și colab., 2013). SOCS3 este asociat cu calea IL-6 - STAT3 în semnalizarea insulinei (Senn și colab., 2003) și a fost raportat a fi crescut la nivelul mușchiului scheletic la pacienții cu obezitate severă sau cu diabet de tip 2 (Steinberg și colab., 2006; Jorgensen și colab., 2013). Aici am testat nivelurile de activare a proteinelor de pSTAT3 și SOCS3 în mușchiul scheletic. Studii recente au sugerat că SOCS3 blochează fosforilarea IRS1 și reglează în jos complexele PI3K și fosforilarea AKT (Ueki și colab., 2004; Jorgensen și colab., 2013). Prin urmare, am evaluat nivelurile de fosforilare ale AKT pentru a valida controlul glucozei în asociere cu expresia SOC3.
Inflamarea cronică afectează parțial acțiunea insulinei prin activarea receptorului asemănător (TLR), în mod specific TLR2 și TLR4 (Kim și Sears, 2010). TLR4 este exprimat în țesuturile țintă ale insulinei, inclusiv ficatul, țesutul adipos și mușchiul scheletic (Kim și Sears, 2010; Chen și colab., 2015). Astfel, activarea TLR4 poate exacerba direct sensibilitatea la insulină, prin activarea kinazelor inflamatorii (Konner și Bruning, 2011). Datele anterioare sugerează că semnalizarea TLR poate lega, de asemenea, inflamația cronică de rezistența la insulină în mușchiul scheletic (Reyna și colab., 2008; Kim și Sears, 2010; Konner și Bruning, 2011). Aici am emis ipoteza că nivelurile crescute de IL-6 pot fi asociate cu niveluri crescute de TLR4.
S-a raportat că alantolactona, o lactonă sesquiterpenică izolată din Inula helenium, are proprietăți antiinflamatorii și anticanceroase (Chun și colab., 2012, 2015). Mecanismul care stă la baza activității antiinflamatorii a alantolactonei este inhibarea căii de semnalizare STAT3 (Chun și colab., 2012). Luând în considerare efectul său semnificativ de inhibare a STAT3, am proiectat un studiu în care a fost indusă o stare intolerantă la glucoză și rezistentă la insulină folosind IL-6, care activează fosforilarea STAT3 în mușchiul scheletic. Prin urmare, am emis ipoteza că alantolactona poate exercita efecte antiinflamatorii în asociere cu intoleranța la glucoză. Am observat o îmbunătățire a intoleranței la glucoză indusă de IL-6 prin reducerea la tacere a STAT3 mediată de RNAi, sugerând că reducerea la tăcere a genei STAT3 exercită efecte pozitive asupra homeostaziei glucozei. De asemenea, am examinat legătura dintre căile IL-6 - STAT3 și TLR4 prin studii de ARNsi și inhibitori.
Având în vedere importanța mușchilor scheletici în reglarea controlului glucozei și a rezistenței la insulină, allantolactona poate fi un candidat puternic pentru tratamentul intoleranței la glucoză și al tratamentului rezistent la insulină în viitor.
Materiale și metode
Reactivi
Toate substanțele chimice și reactivii, cu excepția cazului în care sunt specificate, au fost cumpărate de la Sigma - Aldrich (Sigma - Aldrich, MO, Statele Unite). Testul de absorbție a glucozei fluorescente 2-NBDG a fost achiziționat de la Invitrogen (Carlsbad, CA, Statele Unite). IL-6 a fost achiziționat de la Thermo fisher scientific (Waltham, MA, Statele Unite). Anticorpii primari pSTAT3, STAT3, pAKT, AKT, SOCS3, TLR4 și β-actină, precum și anticorpii anti-iepure și anti-șoareci conjugați cu HRP au fost cumpărați de la Santa Cruz (Dallas, TX, Statele Unite). Penicilina, streptomicina, DMEM (glucoză ridicată), serul bovin fetal (FBS) au fost obținute de la GenDepot (Barker, TX, Statele Unite). siRNA-urile STAT3 și TLR4 au fost proiectate și create din Bioneer (Daejeon, Coreea de Sud). RNAiMAX pentru transfecție a fost achiziționat de la Invitrogen (Carlsbad, CA, Statele Unite).
Material vegetal și prepararea Alantolactonei
Rădăcina I. helenium (Compositae), cunoscută și sub numele de elecampane, a fost achiziționată de pe piața plantelor din Jechun, Chungbuk din Coreea de Sud. Alantolactona a fost izolată din I. helenium, conform lucrării noastre recente (Kim și colab., 2017). Puritatea a fost evaluată peste 98% prin HPLC și structura chimică a fost confirmată cu 1 H și 13 C RMN (date suplimentare).
Cultură de celule
Miotuburile de șobolan L6 au fost obținute din colecția American Type Culture Collection (Manassas, VA, Statele Unite). Celulele L6 au fost crescute în DMEM conținând 10% FBS, 100 U/ml penicilină și 100 μg/ml streptomicină la 37 ° C într-un incubator cu 5% CO2. Diferențierea a fost indusă de mediu FBS 2%. Experimentele au fost efectuate după 6-7 zile de însămânțare.
2-NBDG Analiza absorbției de glucoză
Mioblastele L6 au fost însămânțate și serul a fost lipsit timp de 24 de ore. Alantolactona a fost pretratată timp de 4 ore înainte de tratamentul cu IL-6 timp de 24 de ore. Mediul de cultură a fost îndepărtat și înlocuit cu mediu de cultură cu 2-NBDG fluorescent 500 μM (Molecular Probes-Invitrogen), un derivat fluorescent al glucozei, timp de 3 ore și stimulat cu sau fără insulină 100 nM timp de 30 de minute. Supernatanții au fost apoi îndepărtați și tampon PBS a fost adăugat la fiecare godeu. Imaginile fluorescente 2-NBDG au fost determinate prin microscopie fluorescentă (Olympus CKX41, × 200).
Western Blotting
Probele de proteine (20 μg) au fost separate prin SDS - PAGE, electro-șterse (BioRad) la membrană și blocate cu lapte degresat timp de 1 oră. Au fost măsurați anticorpii primari împotriva pSTAT3, STAT3, pAKT, AKT, SOCS3, TLR4 și β-actină (Santa Cruz). Toate Western blot au fost măsurate de mai mult de trei ori.
siRNA Transfection
Celulele L6 au fost transfectate cu siRNA care vizează STAT3 și TLR4 (Bioneer). Celulele au fost însămânțate în medii fără ser și antibiotice și transfectate cu siRNA-STAT3 și TLR4 (100 nM din fiecare secvență oligonucleotidică) sau 50 nM secvență amestecată conform instrucțiunilor producătorului (RNAiMax, Invitrogen). După 72 de ore de transfecție, celulele au fost spălate și tratate cu sau fără alantolactonă timp de 4 ore urmate de 40 ng/ml IL-6 timp de 24 de ore. Proteina a fost extrasă cu sau fără insulină 100 nM timp de 10-30 minute pentru Western Blot. Mediul conținând 500 μM 2-NBDG (Invitrogen) a fost incubat timp de 3 ore, urmat de incubare de 30 de minute cu sau fără insulină pentru analiza absorbției glucozei.
Analize statistice
Western blots de alantolactonă și Stattic în celulele L6 stimulate de insulină induse de IL-6. Toate Western blot au fost măsurate de mai mult de trei ori. (A) Efectele allantolactonei și Stattic asupra stimulării insulinei induse de IL-6 asupra fosforilării STAT3 și activării SOCS3. (B) Efectele allantolactonei și statticului asupra fosforilării AKT stimulate de insulină indusă de IL-6. (C) Efectele alantolactonei și ale Stattic asupra expresiei genei TLR4 stimulate de insulină indusă de IL-6.
Fosforilarea AKT stimulată cu insulină stimulată de IL-6 activată cu alantolactonă
Pentru a examina reglarea absorbției de glucoză, a fost evaluată fosforilarea AKT. Tratamentul cu IL-6 a suprimat fosforilarea AKT, în timp ce allantolactona a inversat suprimarea la nivelul de control (Figura Figura 3B 3B ). Cu toate acestea, pretratarea cu Stattic nu a prezentat nicio modificare semnificativă în comparație cu grupul stimulat de IL-6, care susține rezultatul anterior al absorbției de glucoză.
Alantolactona a inversat expresia genei TLR4 stimulată de insulină indusă de IL-6
Expresia receptorului 4 de tip toll a fost evaluată în asociere cu tratamentul cronic cu IL-6. Am demonstrat niveluri crescute de expresie ale genei TLR4 în grupul stimulat de insulină tratat cu IL-6. Atât alantolactona, cât și Stattic au suprimat aceste expresii (Figura Figura 3C 3C ).
Silențiere genetică bazată pe ARNsi a absorbției îmbunătățite a glucozei STAT3
Pentru a examina rolul STAT3 și TLR4 în dezvoltarea intoleranței la glucoză, am testat captarea de 2-NBDG stimulată de insulină indusă de IL-6 în mușchiul scheletic (Figura Figura 4A 4A ). După 72 de ore de transfecție cu siRNA-STAT3, urmată de 24 de ore de tratament cu IL-6, nivelul de glucoză din siRNA-STAT3 stimulat de insulină a fost inversat la cel al grupului de siRNA amestecat netratat IL-6 (Figura Figura 4B 4B ). Comparativ cu siARN-TLR4, transfecția cu siARN-STAT3 a arătat o absorbție mai îmbunătățită a glucozei. Prin urmare, a fost ales să studieze calea de semnalizare suplimentară.
Discuţie
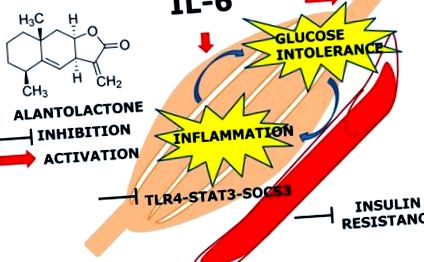
Principala constatare a acestui studiu a fost că expunerea prelungită (24 de ore) la IL-6 mediază expresia genei TLR4 prin activarea STAT3-SOCS3 și induce intoleranță la glucoză și inflamație în mușchiul scheletic. Pretratamentul cu alantolactonă a arătat un efect protector împotriva tratamentului cronic cu IL-6 și creșterea nivelului de absorbție a glucozei, sugerând activitatea sa potențială asupra intoleranței la glucoză și rezistenței la insulină (Figura Figura 5 5 ).
Schema căii Alantolactonei. Alantolactona suprimă expresia TLR4 stimulată de IL-6 prin fosforilarea STAT3 și expresia SOCS3, care activează fosforilarea AKT.
Acumularea de dovezi clinice sugerează că monocitele/macrofagele joacă un rol critic în patogeneza rezistenței la insulină prin infiltrarea țesuturilor țintă ale insulinei (Reyna și colab., 2008; Chen și colab., 2015). Citokinele precum TNF-α și IL-6 secretate de mai multe țesuturi sunt recunoscute ca mediatori inflamatori care cauzează rezistența la insulină prin reducerea expresiei transportorului de glucoză4 (GLUT4) și IRS-1 (Chen și colab., 2015). S-a raportat că aceste efecte exercită activarea căii de semnalizare JAK-STAT urmată de expresia SOCS3 (Chen și colab., 2015). S-a raportat, de asemenea, că IL-6 induce rezistența la insulină prin blocarea căii PI3K și AKT și afectează sinteza glicogenului prin reglarea descendentă a microRNA200s și reglarea ascendentă a prietenului GATA 2 (FOG-2) (Chen și colab., 2015). Un studiu recent (Chun și colab., 2015) a raportat efectul inhibitor al allantolactonei asupra STAT3 inductibil și activat constitutiv, suprimarea translocației nucleare și activitatea de legare a ADN a STAT3 in vitro. Acest rezultat susține ipoteza noastră că efectul antiinflamator al alantolactonei poate fi suprimat inflamația cronică prin inhibarea activării STAT3, urmată de expresia TLR4 indusă de expunerea la IL-6.
Concluzie
Aceste rezultate ale acestui studiu indică faptul că allantolactona își exercită efectele antiinflamatoare prin inhibarea intoleranței la glucoză stimulată de insulină și a rezistenței la insulină indusă de IL-6 și a rezistenței la insulină în mușchiul scheletic. Din câte știm, acest studiu este primul care a raportat că alantolactona suprimă expresia TLR4 stimulată de IL-6 prin fosforilarea STAT3 și activarea SOCS3. Prin urmare, alantolactona poate avea un potențial mare pentru tratamentul tulburărilor metabolice cronice asociate inflamației, cum ar fi rezistența la insulină și diabetul de tip 2.
Contribuțiile autorului
Experimentele de cultură celulară, absorbția de glucoză 2-NBDG, transfecția celulelor siARN și Western blot au fost finalizate de MK. Izolarea allantolactonei a fost finalizată și asigurată de KS. Aprobarea protocolului de studiu și corectarea manuscriselor au fost efectuate de YK în calitate de autor corespunzător.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi construite ca un potențial conflict de interese. Revizorul MH și editorul de gestionare și-au declarat afilierea partajată, iar editorul de gestionare afirmă că procesul a îndeplinit totuși standardele unei revizuiri corecte și obiective.
Abrevieri
| 2-NBDG | 2- (N- (7-nitrobenz-2-oxa-1,3-diazol-4-il) amino) -2-deoxiglucoză |
| ACT | alfa serina/treonina-proteina kinaza |
| GLUT4 | transportor de glucoză 4 |
| IL-6 | Interleukina-6 |
| IRS-1 | substrat receptor al insulinei-1 |
| PI3K | fosfoinozidă 3-kinază |
| SOCS3 | supresor al semnalizării citokinelor 3 |
| STAT3 | traductor de semnal și activator al transcrierii 3 |
| TLR4 | receptor de tip taxă 4 |
| TNF-a | factor de necroză tumorală alfa |
Note de subsol
Finanțarea. Această lucrare a fost susținută de subvenții (NRF-2013R1A1A2A10005492 și MRC-2009-0083533) de la Fundația Națională de Cercetare din Coreea.
- Asocieri ale grăsimii corporale și ale mușchilor scheletici cu hipertensiune arterială - Han - 2019 - The Journal of
- Antrenamentul aerob inversează semnalizarea pro-inflamatorie indusă de dietă bogată în grăsimi la mușchii scheletici ai șobolanilor
- 5 fructe pentru a lupta împotriva inflamației în această vară
- Nașterea prin cezariană, travaliul prelungit influențează bacteriile intestinale ale sugarului, riscul de obezitate infantilă și
- Ben Affleck; Planul de dietă pentru câștigul muscular de 24 de lb (rolul lui Batman) - PK de bază - Modul în care starurile devin slabe