Geoffrey A. Mueller
1 Laborator de biologie structurală, Institutul Național de Științe ale Sănătății Mediului, Research Triangle Park, NC, SUA
Soheila J. Maleki
2 Departamentul Agriculturii SUA, Serviciul de Cercetare Agricolă, Centrul Regional de Cercetare Sud, New Orleans, LA, SUA
Lars C. Pedersen
1 Laborator de biologie structurală, Institutul Național de Științe ale Sănătății Mediului, Research Triangle Park, NC, SUA
Abstract
Alergenii de arahide pot declanșa un răspuns imun puternic și uneori periculos la un număr tot mai mare de oameni. Structurile moleculare ale acestor alergeni formează baza pentru înțelegerea acestui răspuns. Această revizuire descrie structurile alergene de arahide cunoscute în prezent și discută modul în care modificările atât enzimatice, cât și non-enzimatice afectează digestia, recunoașterea imună înnăscută și interacțiunile IgE. Structurile alergene ajută la explicarea reactivității încrucișate în rândul alergenilor din surse diferite, ceea ce este util în îmbunătățirea diagnosticului pacientului. În mod surprinzător, s-a observat recent că secvențele scurte de peptide asociate printre alergenii de arahide ar putea fi, de asemenea, o sursă de reactivitate încrucișată. Caracteristicile moleculare ale alergenilor de arahide continuă să informeze predicțiile și să ofere noi direcții de cercetare în studiul bolilor alergice.
Introducere
Alergiile la arahide reprezintă o problemă majoră de sănătate publică. Date recente sugerează că incidența este în creștere și în prezent 1-2% dintre americani, sau aproape 30 de milioane de oameni, sunt alergici la arahide [1]. Nu este surprinzător faptul că baza pentru alergia la arahide a făcut obiectul unor cercetări ample. În această revizuire, sperăm să evidențiem noi date axate pe recunoașterea moleculară a alergenilor de arahide de către sistemul imunitar adaptativ și înnăscut. Această revizuire va aprofunda două subiecte majore recente: reactivitatea încrucișată între alunele neomoloage și alergenii la nuci și modificările moleculare ale arahidelor și consecințele lor imunologice. Discutăm pe scurt epitopii IgE în general, deoarece acest subiect a fost recent revizuit [2-4]. Începem prin a discuta structurile moleculare ale alergenilor pentru arahide, pentru a stabili scena pentru aceste subiecte.
Structuri proteice ale alergenilor de arahide
Mai mult de 50% din toți alergenii vegetali pot fi clasificați în doar patru familii de proteine structurale; superfamilia prolaminelor, superfamiliei cupinelor, profilinelor și proteinelor legate de Bet v-1 [5]. Aproape toate acestea sunt proteine de depozitare sau de apărare a plantelor [6]. Alunele adăpostesc 12 alergeni și izoforme multiple recunoscute de Subcomitetul Nomenclaturii Alergenilor din Uniunea Internațională a Societăților Imunologice, dintre care 70% se încadrează în aceste familii. Acești 12 alergeni, pot fi clasificați în cele mai frecvente patru familii de alergeni alimentari: superfamilia Cupin (Ara h 1, 3), superfamilia Prolamin (Ara h 2, 6, 7, 9), familia Profilin (Ara h 5), și proteinele legate de Bet v-1 (Ara h 8), precum și două familii suplimentare, Oleosin (Ara h 10,11) și Defensin (Ara h 12, 13). În prezent, există date structurale pentru Ara h 1, 2, 3, 5, 6 și 8 [7-13]. Am împărțit aceste descrieri structurale în alergenii majori care au cea mai mare prevalență de legare a IgE și alergenii minori, care au o prevalență mai mică de legare a IgE, dar reactivitate încrucișată semnificativă cu alergeni din alte surse.
Alergeni majori
Alergenii dintr-un aliment sunt considerați majori dacă sunt recunoscuți de serul IgE mai mare de 50% din populația alergică. Alergenii majori din arahide sunt în general considerați Ara h 1 și Ara h 3 care sunt membri ai superfamiliei cupinelor de proteine și Ara h 2 și Ara h 6 care sunt membri ai superfamiliei prolaminelor. După cum se poate deduce din descrierile de mai jos, a fost obținută o cantitate remarcabilă de informații structurale, biofizice și bioinformatice despre acești alergeni.
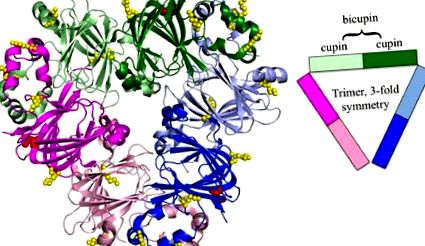
Ara h 1 tundere. Ara h 1 din superfamilia cupin este un trimer de bicupini, colorat de domeniile cupin (PDB: 3SMH). Bicupinele individuale sunt colorate în roz, verde și albastru, cu domenii Nterminal ușor umbrite, iar domeniile C-terminal cu o nuanță mai închisă. În structură sunt evidențiate siturile identificate de glicozilare colorată în roșu (47) și glicare colorată în galben. Pe măsură ce tehnologia se îmbunătățește, pot fi identificate mai multe site-uri de glicație și modificări AGE [59]
Ara h 3 este o globulină sau legumină 11S din superfamilia cupinului și împarte identitatea secvenței cu 21% Ara h 1. Pe lângă faptul că este o proteină de stocare a semințelor, Ara h 3 este, de asemenea, un inhibitor al tripsinei [18]. Spre deosebire de Ara h 1, Ara h 3 poate fi cristalizat în forma sa nativă purificată din miez de arahide uscate [13]. În ciuda identității secvenței reduse, structura cristalină a Ara h 3 este foarte asemănătoare cu cea a Ara h 1 cu un r.m.s.d. de 2,4 Å peste 316 din reziduurile miezului. Ara h 3 formează un hexamer format din două trimere similare Ara h 1 stivuite cap la cap (Fig. 2). Ara h 3 este modificat post-translațional printr-un clivaj proteolitic care apare între cele două domenii cupin pe o buclă flexibilă. Acest decolteu pare a fi necesar pentru formarea hexamerului, deoarece această buclă trebuie îndepărtată pentru ca cele două trimere să formeze interfața hexamerică. Cele două domenii cupin sunt cunoscute sub numele de subunitate acidă și bazică și pot fi ușor separate prin focalizare izolectrică [19]. Anumite soiuri de arahide lipsite de subunitatea de bază a Ara h 3 au fost studiate ca potențial mai puțin alergenice [20].
Ara h 3 hexamer. Ara h 3 este un hexamer de două trimestre de bicupini (PDB: 3C3V). Un aparat de tundere este de culoare roz, iar pentru celălalt: două bicupini sunt de culoare gri și al treilea albastru închis pentru domeniul cupin N-terminal de bază și cian pentru domeniul cupin C-terminal acid. Hexamerul se formează după scindarea unei peptide între domeniile cupinului (situl de scindare încercuit în roșu). Siturile de glicație identificate sunt colorate în galben [59]
Ara h 2 a familiei promalin. Evidențiat pe Ara h 2 sunt peptide care s-au dovedit a inhiba legarea IgE de Ara h 1 (colorat în verde) și Ara h 3 (colorat în albastru). Reziduurile care lipsesc din structura cristalină sunt indicate cu o linie întreruptă. Conectivitatea disulfură este prezentată cu bețe magenta și galbene (PDB: 3OB4)
Alergeni minori
Alergenii minori sunt recunoscuți de serul IgE cu mai puțin de 50% din populația alergică. Alergenii minori din arahide, pentru care există informații structurale, includ Ara h 5 din familia de proteine profilină și Ara h 8 din superfamilia asemănătoare Bet v 1. Aceste două structuri au fost determinate recent.
Spre deosebire de alergenii menționați anterior, Ara h 5 nu este o proteină de stocare a semințelor, ci mai degrabă aparține familiei de profil din proteine. Profilurile sunt mici,
15-kDa, proteine găsite în toate celulele eucariote care interacționează cu actina și sunt implicate într-o serie de procese celulare, cum ar fi dinamica citoscheletală. La plante, acestea sunt implicate în alungirea celulelor, menținerea formei celulare, creșterea polarizată a părului rădăcinii și timpul de înflorire [29, 30]. Figura 4 arată că structura cristalină a Ara h 5 recombinantă este alcătuită din profilul canonic motiv α/β cu o foaie β centrală paralelă flancată de helice α [11]. Secvența ridicată și conservarea structurală a profilinelor de la alte specii, cum ar fi alergenul polen Bet v 2 și alergenul latex Hev b 8, pot explica de ce panalergenii profilinici prezintă reactivitate încrucișată din surse multiple [31].
Ara h 5 și Ara h 8. Structuri ale Ara h 5 (A) din familia profilin și Ara h 8 (b) din familia de proteine legate de Bet v 1. Liganzii găsiți în situl activ al Ara h 8 din diferite structuri (MES color cyan și epicathecin color magenta) sunt redate cu o suprafață semitransparentă (PDB: 4ESP, 4M9W și respectiv 4MA6)
Ara h 8 este un membru de 17 kDa al clasei de proteine legate de patogeneză 10 (PR-10), care aparține superfamiliei asemănătoare Bet v 1. Rolurile funcționale ale proteinelor PR-10 nu sunt bine înțelese, dar unele pot juca un rol într-un mecanism de răspuns la stres/apărare generală, deoarece pot fi induse de atacul patogenilor [32]. Structurile proteinelor PR-10 constau în general dintr-o foaie β-paralelă curbată cu șapte catene flancată de trei helice α pe o parte creând o cavitate hidrofobă cu capacitatea de a lega liganzi hidrofobi [32]. Ara h 8 împărtășește aceste caracteristici structurale și s-a dovedit că leagă un număr de compuși biologici, inclusiv flavonoizi, sugerând un rol potențial ca proteină purtătoare de flavonoizi [12]. Diferite structuri cristaline ale Ara h 8 exprimate recombinant demonstrează legarea epicatechinei, precum și a tamponului de laborator MES la cavitatea de legare a ligandului (Fig. 4). Acești compuși sunt localizați în poziții care nu se suprapun, sugerând că mai mulți liganzi se pot lega simultan, similar cu studiile de legare a ligandilor la prototipul Bet v 1 [33]. Conservarea structurală a petelor de suprafață între Ara h 8 și polenul alergen Bet v 1 poate explica reactivitatea încrucișată IgE între acești panalergeni [12].
Epitopii IgE
Reactivitate încrucișată în rândul alergenilor de arahide
Una dintre cele mai mari dificultăți în diagnosticarea și detectarea alergiilor alimentare implică reactivitatea încrucișată a alergenilor. Fenomenul reactivității încrucișate în alergie poate fi relevant din punct de vedere clinic sau irelevant. Este obișnuit să se observe rezultatele pozitive ale testului IgE (sIgE) pozitiv (prin ELISA sau prin testul cutanat) la alimentele care sunt tolerate. De exemplu, persoanele alergice la arahide pot demonstra o reactivitate încrucișată la mai multe nuci și/sau leguminoase, dar prezintă simptome clinice la arahide și nu tolerează niciunul, unul sau mai multe dintre alimentele cu reacție încrucișată. De fapt, aproximativ 50% dintre pacienții alergici cu arahide au teste cutanate pozitive la alte leguminoase, dar mai puțin de 5% sunt clinic simptomatice la ingestia de leguminoase [35]. Fără un istoric medical bun și o provocare alimentară, este din ce în ce mai dificil să se atribuie diete precise de evitare a alimentelor și deseori duce la diete inutile de eliminare a paturilor [36]. Aceste tipuri de evitare a alimentației pe scară largă sunt foarte dificile pentru pacient și familiile lor [36].
Înțelegerea acestei reactivități încrucișate „neomoloage” poate fi legată de severitatea răspunsului pacientului. Sensibilizarea la un singur alergen de arahide corelată cu reacții mai puțin severe la arahide comparativ cu pacienții care au fost sensibilizați la mai mulți alergeni de arahide [41-43]. Ipotezăm că acei pacienți sensibilizați la alergeni cu alune multiple recunosc epitopii IgE care sunt reactivi încrucișat printre proteinele neomoloage, ducând la un răspuns mai sever.
Modificări moleculare
Pentru a înțelege în continuare recunoașterea și răspunsul sistemului imun alergen, trebuie adăugate complexitățile adăugate ale modificărilor la alergeni și rolul lor potențial în reactivitatea încrucișată. Au fost descrise anterior două categorii de modificări moleculare ale alergenilor pentru arahide, enzimatice și non-enzimatice. Modificările enzimatice includ glicozilarea, în timp ce modificările non-enzimatice apar din procesarea alimentelor, în principal sub formă de produse finale avansate de glicație sau AGE.
Enzimatic
Într-adevăr, s-a demonstrat că determinanții carbohidraților de pe Ara h 1 au proprietăți imunomodulatoare [52]. Glicozilarea Ara h1 este bogată în manoză și conține ocazional porțiuni de xiloză [47]. Acești carbohidrați interacționează cu diferiți receptori ai celulelor dendritice (DC), care joacă un rol important de sentinelă în răspunsul imun înnăscut. S-a demonstrat că stimularea Ara h 1 a DC prin receptorii de lectină MR și DC-SIGN induce citokine cunoscute că influențează răspunsul imun către un răspuns alergic sau de tip Th2 [52, 53]. Prin urmare, starea de gicosilare a alergenilor de arahide stimulează celulele imune înnăscute să semnaleze că un răspuns de tip alergic este justificat de celulele T din aval. Proprietățile stimulării imune prin intermediul receptorilor de lectină de tip C au fost studiate pe larg în cazul alergenilor la acarieni, așa cum sa analizat recent [54].
Non-enzimatic
Proteinele pot fi, de asemenea, modificate de carbohidrați într-un mecanism non-enzimatic cunoscut sub numele de reacția Maillard. Formarea AGE-urilor are loc atunci când zaharurile reacționează în primul rând cu aminele libere și sunt supuse rearanjării Amadori [55]. Modificările sunt cele mai frecvente la lizine și sunt mai puțin frecvente observate la arginine, capătul N-terminal și cisteine [56]. În plus, între reziduurile menționate mai sus se pot forma legături încrucișate covalente stabile. Acest proces este accelerat de temperaturi mai ridicate (adică de gătit): prăjirea uscată versus fierbere poate crește numărul de modificări AGE cu mai mult de 10 ori [57]. Este important să rețineți că aceste modificări sunt spontane și apar la temperatura camerei, deși la un ritm mai lent în comparație cu temperaturile de gătit. Într-adevăr, modificările AGE pot fi detectate în arahide brute în grade diferite [58, 59]. Prin urmare, poate fi mai prudent să se utilizeze alergeni recombinați în studii menite să izoleze efectul AGE-urilor în loc să compare alunele crude cu cele prăjite.
Modificări moleculare, alergie și imunologie
Modificările de vârstă ale arahidelor sunt sugerate pentru a distorsiona răspunsul imun la alergie. S-a demonstrat că mecanismul pentru aceasta este stimularea receptorilor precum RAGE (Receptor pentru produsele finale avansate de glicație) și a receptorilor de captură clasa A tip I și II (SR-AI/II) [64-66]. Două studii independente au demonstrat că stimularea celulelor dendritice cu OVA modificat AGE în comparație cu OVA control duce la activarea mai multor celule T care produc IL-4- [65] sau IL-5 [66] decât IFN-γ Celulele T. Ambele rezultate sugerează o prejudecată Th2. Alte studii efectuate pe celule Caco-2, care sunt un model pentru epitelii intestinali, au demonstrat că activarea RAGE de către AGE stimulează MAP-kinazele [67]. Mai recent, s-a demonstrat că Ara h 1 modificat AGE influențează proliferarea celulelor Caco-2, într-o manieră dependentă de timpul și temperatura de incubație, indicând posibilitatea ca modificări specifice AGE să fie importante pentru influențarea rețelei pro-inflamatorii [68 ].
Cu toate acestea, este puțin probabil ca AGE să fie în primul rând ceea ce este recunoscut de IgE. În sprijinul acestei presupuneri este o lucrare recentă care a comparat recunoașterea IgE a Ara h1 recombinantă pe o perioadă de timp de încălzire în prezența zaharurilor pentru a crea AGE [59]. Legarea IgE a cinci pacienți a fost similară cu conținutul total de proteine pe parcursul întregii perioade și a crescut ușor cu mai multe modificări AGE. Prin urmare, unele modificări comune sunt probabil recunoscute de IgE, dar recunoașterea puternică a rAra h 1 nemodificată indică faptul că alergenul este în primul rând ceea ce este recunoscut. Când legarea IgE obținută de la trei dintre pacienți a fost testată împotriva unui alergen de control, Bos d 6, care fusese modificat AGE în același protocol, nu a fost detectată nici o legare IgE, indicând din nou că alergenul este mai important decât AGE modificări și că AGE-urile sunt recunoscute în contextul proteinei [59]. Deoarece AGE-urile sunt prezente în aproape toate alimentele gătite, ar părea extrem de periculos să existe anticorpi IgE în mod specific împotriva AGE-urilor, analog discuției de mai sus despre a avea anticorpi împotriva carbohidraților obișnuiți din plante.
Dacă modificările AGE sunt atât de frecvente în gătit, există efecte importante asupra sănătății în alte alimente? Importanța AGE dietetice, în general, este larg dezbătută în literatura de specialitate. La modelele animale, există o legătură clară între dietele cu vârstă scăzută AGE și inhibarea aterosclerozei și prevenirea nefropatiei diabetice [79]. Cu toate acestea, există studii contradictorii cu privire la consecințele AGE dietetice la om. Unele studii descriu AGE-urile ca „glicotoxine” și încurajează reducerea AGE-urilor în dieta umană [57]. În contrast, o meta-analiză recentă a studiilor la om care implică diete cu restricție AGE a concluzionat că nu există dovezi suficiente pentru a încuraja această restricție dietetică la persoanele sănătoase, diabetice sau cu insuficiență renală [80]. Revizuirea menționează în continuare că toate studiile care indică un efect benefic al dietelor cu restricție AGE au apărut dintr-un grup de cercetare și toate studiile ar putea beneficia de un design mai bun al studiului și de măsurători standardizate pentru a facilita comparații mai bune [80].
Motivul pentru care arahidele generează reacții atât de puternice este puțin probabil să aibă un singur factor cauzal, dar este probabil o combinație de evenimente nefericite care funcționează de concert. Modificările AGE și proprietățile inhibitoare ale tripsinei Ara h 2 și Ara h 3 reduc proteoliza. Acest lucru duce la mai multe proteine de arahide care supraviețuiesc digestiei și, prin urmare, mai multe proteine întregi intră în intestin. Este probabil ca proteinele supraviețuitoare sau fragmentele acestora să mențină elemente structurale [81]. Acest lucru stimulează probabil sistemul imunitar atât prin sistemul imunitar adaptiv prin legarea IgE, cât și prin răspunsul imer înnăscut prin receptori de lectină și receptori, cum ar fi RAGE, recunoscând glicozilarea și modificările glicației, respectiv.
Concluzii
Caracteristicile structurale ale alergenilor și familiile de proteine oferă informații importante despre detectarea, diagnosticarea și proiectarea instrumentelor terapeutice în alergie. Date recente demonstrează că reactivitatea IgE în cadrul familiilor de proteine, adică printre proteinele neomoloage, este, de asemenea, important în alergia la arahide și se poate corela cu cele mai severe simptome. Glicozilarea alergenilor de arahide este puțin probabil să fie importantă pentru legarea anticorpilor IgE, dar poate fi mai importantă pentru stimularea imunității înnăscute prin receptorii de dectină sau lectină. În mod similar, starea de glicație (adăugarea de produse finale avansate de glicație) este sugerată pentru a afecta stimularea imună înnăscută, digestia alergenilor alune și recunoașterea anticorpilor alergenilor.
Mulțumiri
Autorii doresc să mulțumească doctorilor. Robert London, Michael Fessler și Jason Williams pentru lecturi critice ale manuscrisului. Această cercetare a fost susținută de numărul proiectului de cercetare Z01-ES102885-01 și ZIA-> ES102645 din Programul de cercetare intramurală al Institutului Național de Științe ale Sănătății Mediului, Institutele Naționale de Sănătate.
Note de subsol
Respectarea liniilor directoare de etică
Drepturile omului și animalelor și consimțământul informat
Acest articol nu conține studii efectuate de subiecți umani sau animale efectuate de niciunul dintre autori.
Conflict de interese
Geoffrey A. Mueller, Soheila J. Maleki și Lars C. Pedersen declară că nu au niciun conflict de interese.
- Știința și magia fabricării gemurilor Biochimie și biologie moleculară The Guardian
- Aceste două produse alimentare întregi sunt reamintite din cauza temerilor alergice
- Ce este întrebările frecvente, tehnicile și rețetele despre gastronomia moleculară
- Nose Your The Ultimate Air Cleaner Allergy; Rețeaua astmului
- Sugestii de proteine Alimentele bogate de consumat se bazează pe semnul dvs. zodiacal - Dreptul la proteine