Abstract
fundal
Boala limfoproliferativă post-transplant este o complicație recunoscută după transplantul de organe solide. Aceasta este de obicei o boală a celulelor B și frecvent asociată cu infecția cu virusul Epstein Barr, deși poate apărea PTLD cu celule T. PTLD cu celule T este de obicei o boală monomorfă, limfomatoasă, asociată cu un prognostic advers.
Raport de caz
Raportăm un bărbat în vârstă de 52 de ani, beneficiar de transplant renal preventiv, care a dezvoltat diaree severă cu scădere în greutate după intensificarea imunosupresiei sale din cauza respingerii mediată de anticorpi la 3 ani după transplant. Biopsia duodenală a demonstrat duodenita monoclonală a celulelor T CD8 + ducând la creșterea limfocitelor intraepitliene și la atrofia vilozitară subtotală care imită boala celiacă. Boala celiacă a fost exclusă prin testarea anticorpilor negativi anti-țesut transglutaminază, testarea HLA-DQ2 și HLA-DQ8. Nu au existat dovezi de limfom nici pe biopsie, nici pe enterografie CT și nici o boală avidă FDG pe PET. Simptomele nu s-au îmbunătățit odată cu reducerea imunosupresiei, dar s-au rezolvat complet la întreruperea completă a tratamentului. Transplantul a eșuat și a fost stabilit în dializă. Diagnosticul a fost PTLD precoce.
Concluzii
Esofagogastroduodenoscopia cu biopsii ale intestinului subțire este o investigație utilă pentru determinarea cauzei diareei la pacienții cu transplant renal atunci când au fost excluse cauze mai frecvente. Acesta este primul raport despre care suntem conștienți de PTLD cu celule T clonice care imită boala celiacă care s-a rezolvat numai după retragerea completă a imunosupresiei. Deoarece tratamentele pentru limfom sunt agresive, acestea sunt inițiate doar în faza malignă, iar gestionarea PTLD în stadiu incipient este de a minimiza riscul de progresie prin reducerea imunosupresiei. Orice plan de retransplantare va trebui să ia în considerare posibilitatea ca PTLD să reapară.
fundal
Termenul de boală limfoproliferativă post-transplant (PTLD) a fost introdus pentru prima dată în 1984 [1] și descrie o serie de patologii care apar ca o consecință a imunosupresiei de la hiperplazia limfoidă reactivă la limfom. Incidența PTLD după transplantul de rinichi este
3% [2] și este crescută prin imunosupresie mai intensă. PTLD poate fi monomorf sau polimorf și PTLD cu celule B este frecvent asociat cu infecția cu virusul Epstein Barr (EBV) sau cu reactivarea cu celule care prezintă un model distinct de expresie a antigenului EBV. PTLD cu celule T este mai puțin frecventă și reprezintă 4% din cazuri în perioada post-transplant precoce și 15% din cazurile de PTLD tardivă (> 2 ani de la transplant) [3]. PTLD cu celule T este un grup eterogen de boli care sunt asociate doar cu infecția cu EBV în aproximativ 30% din cazuri [4, 5]. Acestea sunt cel mai frecvent monomorfe, deși este descrisă boala polimorfă și asociate cu un prognostic slab.
La pacienții cu alogrefe renale există multe cauze potențiale ale diareei persistente, inclusiv cele asociate cu imunosupresia, cum ar fi efectele secundare ale acidului micofenolic și ale PTLD intestinale, precum și cele care cauzează diaree la pacienții neimunosupresați. Boala celiacă afectează aproximativ 1% dintre adulți, poate afecta pacienții cu transplant și ar trebui inclusă în lista diagnosticelor diferențiale. Boala celiacă, datorită unui răspuns imun la glutenul alimentar, cauzează de obicei simptome gastro-intestinale, dar este, de asemenea, asociată cu o serie de manifestări non-GI. Autoanticorpii transglutaminazei tisulari (anti-TTG) se găsesc la 95% dintre pacienții cu boală celiacă, dar biopsia duodenală rămâne piatra de temelie a diagnosticului. De obicei, acest lucru arată dovezi ale unui infiltrat limfocitar, hiperplazie de criptă, inflamație a laminei proprii și atrofie viloasă [6]. Tratamentul se face cu o dietă fără gluten, deși rareori se recunoaște boala refractară.
Raportăm un pacient care a dezvoltat diaree severă cu un infiltrat limfocitar duodenal bogat în celule T, imitând boala celiacă, dar datorită PTLD cu celule T monoclonale. Boala s-a rezolvat la retragerea imunosupresiei.
Prezentarea cazului
Un bărbat în vârstă de 52 de ani a primit un transplant renal preventiv de la soția sa pentru tratamentul bolii renale în stadiul final din cauza bolii renale polichistice autozomale dominante (nepotrivire HLA 1-1-1, nepotrivire CMV D +/R-, EBV IgG nu detectat). El a primit alemtuzumab la inducție (30 mg subcutanat în ziua 0 și ziua 1) urmat de imunosupresie de întreținere cu tacrolimus, micofenilat mofetil (MMF) și prednisolon. Întrucât a fost înscris într-un studiu clinic, utilizarea alemtuzumabului pentru inducție a fost determinată de brațul în care a fost randomizat. El a continuat tratamentul cu tacrolimus înainte de a fi randomizat la 6 luni pentru a trece la sirolimus ca parte a studiului clinic [7]. Un an mai târziu, el a trebuit să părăsească studiul, întrucât era supus unei reparații de hernie incisivă, așa că sa întors la imunosupresia bazată pe tacrolimus.
La trei ani după transplant funcția renală a început să scadă. Respingerea mediată a anticorpilor cronici (CAMR) a fost găsită la biopsia renală de transplant și au fost detectați noi anticorpi specifici donatorului împotriva HLA clasa II. Dozele de Tacrolimus și MMF au fost crescute și el a repornit la 5 mg prednisolon. Doza zilnică totală de tacrolimus a crescut de la 3 mg la 5 mg, cu niveluri crescând de la 5,4 μg/L la 7,0 μg/L, iar doza zilnică de MMF a fost dublată de la 1000 mg la 2000 mg. La o lună după această schimbare, s-a prezentat asistenței medicale primare, după ce a trecut sânge franc în scaun și cu o istorie de durere abdominală și urgență fecală. Ca răspuns la aceste simptome, MMF a fost trecut la acid micofenolic, dar diareea a continuat și a fost internat de două ori din cauza agravării funcției renale.
La cinci luni după ce biopsia a confirmat CAMR, rituximabul a fost început cu o doză de 200 mg cu o frecvență planificată la fiecare 6-8 luni, iar acidul micofenolic a fost retras. Deși sângerarea rectală a rezolvat, diareea a continuat și a suferit 4 kg de pierdere în greutate în 2 luni, cu o pierdere totală în greutate de aproximativ 14 kg pe parcursul unui an.
Investigațiile pentru cauza diareei sale au inclus CMV și EBV PCR și cultura scaunului, care au fost toate negative la prezentarea inițială. Elastaza fecală a fost, de asemenea, normală, iar testarea anticorpilor cu celule parietale gastrice și enterocite a fost negativă. Flexisigmoidoscopia a arătat hemoroizi care nu sângerează, iar colonoscopia a fost normală. Studiul bilei radionucleotidice SeHCAT pentru a evalua malabsorbția acidului biliar a fost, de asemenea, normal. Studiile de imagistică care includ PET, torace CT-abdomen-pelvis, enterografie CT și RMN intestinului subțire nu au evidențiat nicio dovadă de malignitate sau altă patologie intestinală.
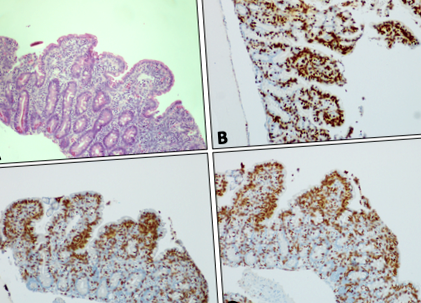
ADN-ul EBV nu a fost detectabil în ser prin PCR la debutul diareei și EBV IgG a rămas negativ. Cu toate acestea, la 6 săptămâni de la debutul diareei, ADN-ul EBV a fost detectat la titruri de 1612 UI/ml și apoi a fluctuat între nedetectat și 6770 UI/ml pe durata diareei sale. ADN-ul EBV a fost detectat la niveluri scăzute (Fig. 1
Mucoasa duodenală care prezintă atrofie viloasă subtotală, hiperplazie criptă și limfocite intraepiteliale crescute pe (A) Colorarea H&E. Colorare imunohistochimică (prezentată în maro) a mucoasei duodenale pentrub) TCR, (c) CD8 și (d) CD3. Toate imaginile cu mărire × 10
Repetați OGD după 6 luni de dietă fără gluten a identificat o populație clonală de celule T. Celulele T intraepiteliale au avut imunohistochimie normală, în sensul că au exprimat antigenele CD3 și CD8, dar au fost detectate rearanjări ale receptorilor clonali T-clon (TCR) beta și TCR gamma utilizând un test PCR multiplex [8]. Rearanjările genei lanțului greu ale imunoglobulinei au fost policlonale, excluzând proliferarea clonală a celulelor B. Nu au existat dovezi de limfom nici pe biopsie, nici pe enterografie CT și nici o boală avidă FDG pe PET.
După reduceri suplimentare ale tacrolimusului, biopsiile duodenale repetate au constatat o persistență a populației de celule T clonale și leziuni ale mucoasei cu atrofie viloză subtotală și sugestie de hiperplazie a criptelor. Aproape 3 ani de la episodul de CAMR și debutul diareei, toată imunosupresia a fost retrasă și dializa peritoneală a fost începută. Diareea s-a ameliorat în câteva zile de la oprirea imunosupresiei și pacientul rămâne bine în dializă fără diaree și și-a recăpătat cu succes greutatea pe care a pierdut-o când nu se simte bine.
discutii si concluzii
Raportăm duodenită cu atrofie sero-negativă viloasă și proliferare clonală de celule T non-maligne secundară imunosupresiei la un beneficiar de transplant renal. Diagnosticul PTLD precoce este susținut de rezolvarea completă a simptomelor la întreruperea imunosupresiei. Din câte știm, nu există alte rapoarte de caz care să descrie acest set de constatări.
Limfomul, inclusiv PTLD, este o complicație recunoscută după transplantul de organe solide. În acest caz, proliferarea clonală a celulelor T a fost pre-malignă, cu un risc ridicat de progresie la enteropatie asociată cu limfomul cu celule T (EATL). Pacientul nostru avea o sarcină imunosupresivă ridicată în momentul prezentării, deoarece terapia sa fusese crescută pentru a gestiona CAMR și primise alemtuzumab la inducție. Ca agent de epuizare a limfocitelor, alemtuzumab provoacă imunosupresie prelungită, recuperarea completă a celulelor B durând 12 luni și celulele T atingând 50% din nivelurile normale la 36 de luni [9]. Tratamentele pentru limfom sunt agresive, deci sunt inițiate numai în faza malignă, iar gestionarea PTLD în stadiu incipient este de a minimiza riscul de progresie prin reducerea imunosupresiei. Constatările histologice în limfom sunt variabile, dar pot include dovezi morfologice ale afectării mucoasei de către o populație limfocitară aberantă cu un fenotip limfocitar anormal și pierderea a cel puțin unuia dintre antigenele celulelor T. La imagistică prezența leziunilor avide FDG pe PET este caracteristică [10]. Niciuna dintre aceste caracteristici nu a apărut în cazul nostru.
Alte diferențiale pentru atrofia sero-negativă a vilozității includ boala celiacă și enteropatia autoimună. Enteropatia autoimună este o boală rară, mai frecventă la copii, iar diagnosticul nu a fost susținut aici, deoarece toate testele de anticorpi au fost negative și afecțiunea a fost tratată cu imunosupresie [11].
Boala celiacă care nu răspunde la o dietă fără gluten și are celule T clonale pe biopsie este denumită boală celiacă refractară de tip II (RCD II). În această condiție, limfocitele intraepiteliale sunt CD3 + și CD8-, deci sunt fenotipice anormale, iar riscul crescut asociat de transformare în EATL ar încuraja o reducere a imunosupresiei [12]. Testarea anti-TTG este importantă pentru diagnosticarea bolii celiace cu o sensibilitate> 90% și o specificitate> 95%. TTG este o enzimă care îndepărtează o grupare amidică din peptidele glutenice pentru a crește legarea lor de HLA-DQ2 și DQ8 pe celulele care prezintă antigen, stimulând un răspuns inflamator. HLA-DQ2 și DQ8 sunt puternic asociate cu boala celiacă, deoarece 95% dintre persoanele cu afecțiune sunt pozitive pentru HLA-DQ2 și celelalte 5% pozitive pentru HLA-DQ8, dar 30-40% dintre persoanele sănătoase vor fi, de asemenea, pozitive pentru unul dintre aceste alele. Testarea HLA este utilă pentru a exclude boala celiacă, deoarece valoarea predictivă negativă se apropie de 100%. Putem fi siguri că cazul nostru nu a fost boala celiacă, deoarece a fost negativ pentru anti-TTG și HLA-DQ2/DQ8 [13, 14].
Pacientul nostru a avut o rezolvare completă a simptomelor sale după retragerea imunosupresiei. Biopsiile duodenale nu au fost repetate, dar presupunerea este că duodenita și atrofia viloasă se vor fi rezolvat, reflectând îmbunătățirea simptomelor. Nu știm dacă clona celulei T a fost complet distrusă sau este acum controlată și, prin urmare, nu putem prezice dacă boala va reapărea dacă imunosupresia este reintrodusă. Pacienții au fost retransplantați după tratamentul cu succes al PTLD [15, 16], dar orice planuri de retransplantare a acestui pacient trebuie să ia în considerare posibilitatea ca acest lucru să reapară.
PTLD cu celule T clonale este o cauză rară de diaree severă la pacienții cu transplant renal. Din punct de vedere clinic, aceasta imită boala celiacă și, odată ce au fost excluse mai multe cauze frecvente, se poate face un OGD cu biopsii ale intestinului subțire și imunohistochimie pentru a căuta populația clonală de celule T specifice PTLD de celule T. Deoarece tratamentul implică retragerea imunosupresiei, vor exista implicații pentru grefa curentă și poate fi necesar să se testeze medicamente imunosupresoare pentru opțiuni adecvate înainte de a lua în considerare re-transplantarea.
Disponibilitatea datelor și a materialelor
Partajarea datelor nu se aplică acestui articol, deoarece nu au fost generate sau analizate seturi de date în timpul studiului actual.
- Dieta mexicană provoacă boli cardiace rampante
- Lipsa acestui nutrient ar putea cauza boala gingiei! Good-Gums
- Vindecarea naturală a cistitei interstițiale - Mama mea; Povestea bolii cronice
- Este munca ta dentară care provoacă inflamații și simptome autoimune
- Boala renală asociată cu hipertensiunea arterială Poate că nu mai există o societate americană de nefrologie