Subiecte
Abstract
Receptorul nuclear al receptorului estrogen 2 (ESR2, ERβ) modulează proliferarea celulelor canceroase și creșterea tumorii, exercitând un rol oncosuppresiv în cancerul de sân (BC). Proteomica de interacțiune prin purificarea afinității tandem cuplată cu spectrometria de masă a fost aplicată anterior în celulele BC pentru a identifica proteinele care acționează în concordanță cu ERβ pentru a controla funcțiile celulare cheie, inclusiv transcrierea genelor, splicarea ARN și reglarea ARNm post-transcripțională. Aceste studii au relevat o implicare a ARN-ului în asamblarea și funcțiile interacțiunii ERβ. Prin aplicarea purificării complexului de proteine native urmată de nano LC-MS/MS înainte și după in vitro Îndepărtarea ARN-ului a generat un set de date mare de interacțiori ERβ nucleari nou identificați, inclusiv un subset care se asociază cu receptorul prin intermediul Acoperirea ARN-ului. Aceste seturi de date vor fi utile pentru a investiga în continuare rolul ERβ, al ARN-urilor nucleare și al celorlalte proteine identificate aici în BC și alte tipuri de celule.
| Tipul (tipurile) de proiectare | proiectare grup paralel • proiectare comparare tip celular • obiectiv de identificare a interacțiunii proteinei și ARN-ului |
| Tipul (tipurile) de măsurare | detectarea interacțiunii proteine-proteine |
| Tipuri de tehnologie | nanofluor cromatografie lichidă-spectrometrie de masă tandem |
| Tip (factori) de factor | genotip • condiție experimentală • replică biologică |
| Caracteristică (e) eșantion | celula nemuritoare de linie celulară derivată din sân uman |
Context și rezumat
Identificarea și caracterizarea complexelor multiproteice implicate în funcțiile ERβ este un pas critic pentru identificarea bazelor moleculare ale semnalizării sale în celulele BC. Proteomica de interacțiune, care combină purificarea complexelor de proteine native și identificarea prin spectrometrie de masă, este standardul de aur pentru a obține astfel de informații, iar noi și alții am cartografiat interacții ERβ ai celulelor umane în diferite condiții experimentale 14-19. Prin această abordare, am demonstrat recent că ERβ poate interacționa cu AGO2 în celulele BC și că aceasta este mediată de unul sau mai mulți ARN 19, sugerând pentru prima dată că ARN joacă un rol în asamblarea și/sau stabilizarea interactomilor ERβ, așa cum deja prezentat pentru alți receptori nucleari 20-22 .
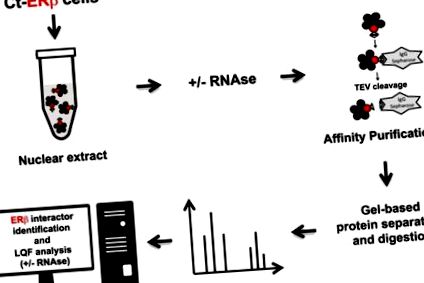
În studiul de față am generat noi seturi de date de proteine care interacționează cu ERβ prin purificarea complexelor native extrase din nucleele celulelor MCP-7 care exprimă ERβ (Ct-ERβ) MCF-7 marcate cu capătul terminal înainte și după tratamentul cu RNase, urmate de proteomică cantitativă fără etichete (Fig. 1). Rezultatele oferă o vedere extinsă a interacțiunii nucleare ERβ a celulelor BC, inclusiv identificarea interacțiunilor proteină-proteină mediată de ARN, care poate fi acum exploatată nu numai pentru a înțelege bazele moleculare ale activităților ERβ, ci și funcțiile tuturor celorlalte proteine identificate.
Rezumatul fluxului de lucru experimental aplicat pentru a genera seturile de date proteice.
(A) Rețea globală care include toate proteinele co-purificate în mod specific cu ERβ prin cromatografie de afinitate și analiză de spectrometrie de masă, prezentând asociații cunoscute, raportate în bazele de date de interacțiune proteină. Subrețele de proteine asociate cu ERβ implicate în (b) transcriere și rețele validate de receptori de estrogen nuclear, (c) moarte celulară și apoptoză și (d) splicing, obținut prin analiza FunRich.
(A) Graficul vulcanului rezumând modificările cantitative ale proteinelor asociate cu ERβ la tratamentul cu RNază. Linia punctată (prag) reprezintă limita (valoarea q ≤0,05)b) Harta de căldură a proteinelor reprezentate în jos, care arată nivelul intensităților LFQ înainte și după tratamentul cu RNase (scara blu). Scăderea nivelului de proteine (+ vs. - RNase) sunt afișate la scară verde. (c) Analiza funcțională de îmbogățire prin IPA a proteinelor asociate ERβ a căror interacțiune cu receptorul a fost redusă prin tratamentul cu RNase (superior histogramă) și o mărire a categoriei funcționale Expresie genică (inferior histogramă).
Interesant este că mai multe dintre ele sunt cunoscute a fi implicate în controlul expresiei genelor, ciclului celular și alte funcții cunoscute ca făcând parte din răspunsurile celulare la ERβ (Fig. 3c).
Setul de date prezentat aici va fi util pentru a investiga mecanismul molecular al activității ERβ și pentru a proiecta modalități de investigare a compoziției și rolurilor funcționale ale complexelor macromoleculare din nucleele celulare BC cuprinzând proteine și ARN-uri, urmărind și identificarea nodurilor interactomului care reprezintă potențiale ținte ale medicamentului împotriva acesta și, eventual, alte tipuri de cancer.
Metode
Extracția și tratamentul proteinelor nucleare
Celulele MCF7 Ct-ERβ 3.14 și ERβ-negative (care au fost lipsite de steroizi prin cultivare timp de 5 zile în mediu fără fenol roșu și cu 5% ser tratat cu cărbune acoperit cu dextran), au fost recoltate prin răzuire în PBS rece și lizate așa cum s-a descris anterior 23. Pe scurt, peletele celulare au fost resuspendate în 3 volume de tampon hipotonic (20 mM HEPES pH 7,4, 5 mM NaF, 10 μM molibdat de sodiu, 0,1 mM EDTA, 1 mM PMSF și 1X cocktail inhibitori de protează (Sigma Aldrich) și incubate pe gheață timp de 15 Fracția citosolică a fost aruncată după adăugarea 0,5% Triton X-100 și rotirea timp de 30 s la 15000 X g la 4 ° C. Peletele nucleare au fost apoi suspendate într-un volum de tampon de liză nucleară (20 mM HEPES pH 7,4, 25% glicerol, 420 MM NaCI, 1,5 mM MgCl2, 0,2 mM EDTA, 1 mM PMSF și 1X cocktail inhibitori de protează (Sigma Aldrich), incubat timp de 30 min la 4 ° C rotativ și centrifugat timp de 30 min la 15000 X g la 4 ° C. au fost în cele din urmă recuperate, diluat 1: 3 cu tampon de liză nucleară fără NaCI pentru a restabili concentrația salină fiziologică și cuantificat.
Purificarea complexelor nucleare ERβ
Mărgele IgG-Sepharose (GE Healthcare), pretratate conform instrucțiunilor producătorului și echilibrate în tampon TEV (50 mM Tris-HCl pH 8,0, 0,5 mM EDTA, 0,1% Triton X-100, 150 mM NaCl, 1 mM DTT), au fost adăugate la extracte de proteine nucleare și incubate timp de 3 ore la 4 ° C cu rotație ușoară, așa cum s-a descris anterior 14,16,23,25,26. Unde este indicat (a se vedea Tabelul 1), 100 μg/ml RNaseA au fost adăugate la probe înainte de legare așa cum s-a descris anterior 19.27. După incubare, proteinele nelegate au fost aruncate după centrifugare și mărgelele au fost spălate bine cu 100xVol tampon IPP150 (20 mM HEPES pH 7,5, 8% glicerol, 150 mM NaCl, 0,5 mM MgCl2, 0,1 mM EDTA, 0,1% Triton X-100) și echilibrat în 30xVol de tampon TEV în coloane de cromatografie Poly-Prep (0,8x4 cm, Bio-Rad) la 4 ° C. Apoi s-au adăugat 4xBeads Vol of Cleavage Buffer (TEV Buffer conținând 1 U/μl margele de TEV protează, Invitrogen) și s-au efectuat două reacții de scindare ulterioare timp de 2 ore și respectiv 30 min la 16 ° C cu agitare ușoară. Eluații au fost apoi colectați, după sedimentarea mărgelelor care încă se leagă de proteine nespecificate și nespecifice.
Nano LC-MS/MS și analiza datelor
Disponibilitatea codului
Următoarele programe și versiuni au fost utilizate pentru controlul calității și analiza datelor:
- RSK2 protejează celulele umane de cancer de sân sub stresul reticulului endoplasmatic prin activare
- Dieta îmbogățită cu ulei de măsline ajută supraviețuitorii cancerului de sân să piardă mai mult în greutate - ScienceDaily
- Reglarea descendentă a receptorilor de estrogen selectivi orali (SERD), o terapie endocrină descoperitoare pentru
- Modulatorul selectiv al receptorului de estrogen promovează pierderea în greutate la maimuțele rhesus feminine ovariectomizate
- Pierderea în greutate postmenopauză poate reduce riscul de cancer mamar