Antonio Paoli
1 Laborator de nutriție și fiziologie a exercițiului, Departamentul de Științe Biomedice, Universitatea din Padova, Padova, Italia
Gerardo Bosco
1 Laborator de nutriție și fiziologie a exercițiului, Departamentul de Științe Biomedice, Universitatea din Padova, Padova, Italia
Enrico M. Camporesi
2 Departamentul de Chirurgie, Universitatea din Florida de Sud, Tampa, FL, SUA
3 TEAMHealth, Tampa, FL, SUA
Devanand Mangar
3 TEAMHealth, Tampa, FL, SUA
4 Tampa General Hospital, Tampa, FL, SUA
Abstract
Deși fenomenul de reducere a foamei raportat în timpul dietelor ketogene este bine cunoscut, mecanismele moleculare și celulare subiacente rămân incerte. S-a demonstrat că cetoza exercită un efect anorexigenic prin eliberarea colecistokininei (CCK) în timp ce reduce semnalele orexigenice, de exemplu, prin grelină. Cu toate acestea, corpurile cetonice (KB) par să poată crește aportul de alimente prin fosforilarea proteinei kinazei (AMPK) activată de AMP, acid gamma-aminobutiric (GABA) și eliberarea și producția de adiponectină. Scopul acestei revizuiri este de a oferi un rezumat al cunoștințelor noastre actuale despre efectele dietei ketogenice (KD) asupra controlului alimentelor într-un efort de a unifica datele aparent contradictorii într-o imagine coerentă.
Introducere
Foamea și sațietatea sunt două mecanisme importante implicate în reglarea greutății corporale. Chiar dacă oamenii pot regla consumul de alimente prin voință, există sisteme în sistemul nervos central (SNC) care reglează consumul de alimente și cheltuielile de energie. Această rețea complexă, al cărei centru de control este răspândit în diferite zone ale creierului, primește informații de la țesutul adipos, tractul gastro-intestinal (GIT) și de la sângele și receptorii senzoriali periferici. Acțiunile centrelor de foame/sațietate ale creierului sunt influențate de nutrienți, hormoni și alte molecule de semnalizare. Corpurile cetonice sunt sursa principală de energie în perioadele de post și/sau lipsă de carbohidrați și ar putea juca un rol în controlul aportului alimentar.
Controlul hipotalamic al hrănirii/apetitului/foamei
Rolul nutrienților în controlul aportului alimentar
Hipotalamusul este principalul centru al creierului responsabil pentru controlul foamei/sațietății (H/S). În teoria pe care Mayer a propus-o acum mai bine de 60 de ani, el a atribuit un rol central nivelurilor de glucoză în controlul H/S: așa-numita „teorie glucostatică” (Mayer, 1955). Mayer a sugerat că epuizarea disponibilității carbohidraților duce la foamete, iar centrele hipotalamice cu receptori sensibili la nivelurile de glucoză ar putea fi implicate în reglarea pe termen scurt a aportului de energie (Mayer, 1955). „Centrul de hrănire” din zona hipotalamică laterală (LHA), conform teoriei glucostatice, reacționează la căderea glicemiei între mese și stimulează consumul de alimente. LHA conține neuroni inhibați de glucoză care sunt stimulați de hipoglicemie, un proces crucial pentru medierea hiperfagiei indusă în mod normal de hipoglicemie. Hiperglicemia post-prandială ulterioară activează „centrul de sațietate” în hipotalamusul ventromedial (VMH), care conține neuroni excitați de glucoză și inhibă atât „centrul de hrănire”, cât și aportul de alimente.
În 1953, Kennedy a propus ipoteza lipostatică sugerând că metaboliții lipidici ar putea fi implicați și în reglarea alimentelor (Kennedy, 1953), iar în 1956, Mellinkoff a studiat efectele metabolismului proteinelor sugerând o ipoteză aminostatică (Mellinkoff și colab., 1956).
Neuronii sensibili la glucoză au fost identificați într-o serie de regiuni ale SNC, inclusiv în centrele de control metabolice ale hipotalamusului. Medeiros et. al. au folosit electrofiziologia cu patch-clamp pentru a examina dacă neuronii dintr-o regiune specializată specifică cunoscută sub numele de organ subfornical (SFO), o zonă în care bariera hematoencefalică nu este prezentă, sunt, de asemenea, sensibili la glucoză. Aceste experimente au demonstrat că neuronii SFO răspund la glucoză și că SFO este un senzor important și un centru integrator al semnalelor circulante de stare a energiei (Medeiros și colab., 2012).
Dar profilarea transcripțională cuprinzătoare a neuronilor cu sensibilitate la glucoză este dificilă, deoarece glucokinaza (Gck) și alte proteine cheie care transduc semnale de glucoză sunt exprimate la niveluri scăzute. Glucoza exercită, de asemenea, o acțiune asemănătoare hormonilor asupra neuronilor; înregistrările electrofiziologice au demonstrat, de exemplu, că hipoglicemia activează neuronii hormonului care eliberează hormonul de creștere (GHRH), sugerând o legătură mecanistică între nivelurile scăzute de glucoză din sânge și eliberarea hormonului de creștere (Stanley și colab., 2013).
Neuronii sensibili la nutrienți care reacționează la concentrațiile de glucoză, dar și la acizi grași (FA) sunt prezenți în multe locuri din creier și pot juca un rol cheie în controlul neuronal al energiei și al homoeostaziei glucozei. Administrarea centrală a oleatului, de exemplu, inhibă consumul de alimente și producția de glucoză la șobolani. Acest lucru sugerează că variațiile zilnice ale concentrațiilor plasmatice de FA ar putea fi detectate de SNC ca un semnal care contribuie la reglarea echilibrului energetic (Moulle și colab., 2014).
Chiar dacă metabolismul intracelular și activarea canalelor K + sensibile la ATP par a fi necesare pentru unele efecte de semnalizare ale FA, o cantitate mare de răspunsuri FA în neuronii hipotalamici ventromediali sunt mediate de interacțiunile cu acidul gras translocază (FAT)/CD36. Translocaza este un transportor/receptor FA care activează semnalizarea în aval chiar și în absența metabolismului intracelular (Moulle și colab., 2014).
Modelul clasic unificat se bazează pe rolul celor trei substraturi metabolice: lipide, glucoză și proteine / aminoacizi în menținerea stării nutriționale în lociurile corespunzătoare din SNC, dar există multe alte semnale și ținte cerebrale (Williams și colab., 2001).
Rolul sistemului neuroendocrin în controlul consumului de alimente
Mai recent, au fost identificate alte regiuni de control al apetitului hipotalamic, inclusiv cele din nucleul arcuat (ARC), nucleul periventricular (PVN) și nucleul hipotalamic dorsomedial (DMH) (Valassi și colab., 2008). Acestea sunt situri de convergență și integrare a multor semnale centrale și periferice, nu doar macronutrienți, care sunt implicați în mecanismele de consum alimentar și de cheltuire a energiei, de exemplu, un grup de neuroni din ARC stimulând aportul alimentar prin neuropeptida Y (NPY) și gena agouti -proteine înrudite (AGRP). Acești neuroni interacționează cu cei care produc pro-opiomelanocortina anorexigenică (POMC) și transcriptul reglementat de cocaină/amfetamină (CART) (Williams și colab., 2001). Astfel, un model mai cuprinzător, unificat, ar trebui să includă macronutrienții, precum și mulți aminoacizi unici și alte molecule de semnalizare.
Există două tipuri distincte de reglare a consumului de alimente: a) pe termen scurt (semnale de sațietate, SS) care apar la începutul și la sfârșitul unei singure mese; include, de asemenea, lungimea dintre mese și b) reglarea pe termen lung (semnal de adipozitate, AS) care este influențată de factori precum depunerea grăsimii corporale.
SS-urile care furnizează informații creierului trimit în principal informații către nucleul tractului solitar (SNT). Aceste semnale sunt generate în GIT și viscerele abdominale, precum și în cavitatea bucală și oferă informații despre proprietățile mecanice și chimice ale alimentelor. Informația este transmisă prin nervul vagal și spinal către SNT. AS ajung la eminența mediană prin ARC sau prin bariera hematoencefalică (BBB). Toate aceste aferente sunt integrate într-o rețea complexă și care nu este pe deplin înțeleasă.
Hormonii precum leptina și insulina, ambii secretați în sânge, reflectă grăsimea corporală stocată. Acești hormoni pot trece BBB și stimula receptori specifici. Zonele hipotalamice sunt bogat furnizate de axoni din ARC, care are concentrații mai mari de receptori de leptină și insulină decât orice alt sit hipotalamic (Valassi și colab., 2008).
ARC exercită acțiuni opuse asupra consumului de alimente care răspund nu numai la leptină și insulină, ci și la hormoni intestinali (cei mai studiați sunt grelina și, recent, PYY). Căile neurofiziologice sugerează că hrănirea este reglată de o buclă de feedback, unde hipotalamusul furnizează intrarea de reglementare pe termen lung a SNT, care acționează ca un punct de referință (Williams și colab., 2001).
Recent s-a propus că ARC este necesar pentru coordonarea sistemelor circadiene homeostatice, inclusiv temperatura și activitatea. Autorii au testat această ipoteză prin injectarea de toxină saporină conjugată cu leptină în ARC de șobolani. Wiater și colab. a arătat că rețeaua sensibilă la leptină este necesară pentru antrenarea activității prin indicii fotice și antrenarea temperaturii de către alimente, dar nu este necesară pentru antrenarea activității de către alimente sau temperatura prin indicii fotice (Wiater și colab., 2013).
Un alt jucător: tractul gastro-intestinal și microbiota intestinală
Legătura intestin-creier este importantă nu numai pentru hormonii produși de intestin, ci și pentru reglarea pe termen lung a greutății corporale. Studiile efectuate la șoareci indică faptul că microbiomul intestinal influențează ambele părți ale echilibrului energetic contribuind la absorbția nutrienților și reglând genele gazdei care afectează adipozitatea [cu toate acestea, există rapoarte contradictorii (Parks și colab., 2013; Schele și colab., 2013)]. Cu toate acestea, rămâne incert cât de importante sunt microbiota intestinală pentru absorbția nutrienților la om. Un studiu de cohortă a demonstrat că încărcătura de nutrienți este o variabilă cheie care poate influența conținutul bacterian intestinal/fecal pe perioade scurte de timp. Mai mult, asocierile observate între microbii intestinali și absorbția nutrienților indică un posibil rol al microbiotei intestinale umane în reglarea aportului și utilizării nutrienților (Jumpertz și colab., 2011).
Mai mult, conform dovezilor recente, debutul meselor pare a fi indus biochimic numai în cazul deprivării energetice grave, în timp ce este de obicei controlat de factori sociali, culturali și de mediu strict legați de stilul de viață (Karatsoreos et al., 2013).
Cetoza sistemică în terapia KD
Dietele ketogenice au devenit populare în ultimele decenii pentru efectele pozitive demonstrate asupra pierderii în greutate (Bueno și colab., 2013), deși mecanismul precis de acțiune nu este pe deplin înțeles (Paoli, 2014). De fapt, există date contradictorii despre KD la șoareci și șobolani. De fapt, există date contradictorii despre KD la șoareci și șobolani. De exemplu, deși o cantitate imensă de date confirmă faptul că KD la om este eficientă în reducerea greutății, îmbunătățind lipidemia și toleranța la glucoză (Bueno și colab., 2013), s-a demonstrat recent că o KD pe termen lung (22 săptămâni) a cauzat dislipidemie, o stare pro-inflamatorie, steatoză hepatică, intoleranță la glucoză și o reducere a masei celulelor beta și alfa, toate fără pierderea în greutate la șoareci (Ellenbroek și colab., 2014). Trebuie luate două considerații: (1) inducerea cetozei și răspunsul la cetoză la oameni și șoareci sunt destul de diferite și (2) șoarecii și oamenii au durate de viață diferite, iar rezultatele obținute la șoareci după câteva săptămâni în dietă pot corespunde la câteva luni de dietă la om (Demetrius, 2005, 2006).
Indiferent de eficacitatea sa pentru pierderea în greutate, durata dietei medie-lungă (Paoli și colab., 2013) este primită prea mult de către medici, poate din cauza lipsei de atenție a subiectului la cursurile de educație medicală specializată. Drept urmare, majoritatea medicilor asociază termenul „cetoză” numai în contextul cetoacidozei diabetice.
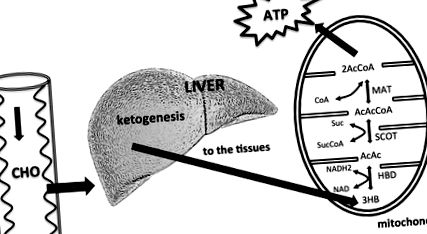
O disponibilitate redusă de carbohidrați alimentari duce la o creștere a producției hepatice de KB. Ficatul nu poate utiliza KB, deoarece nu are enzima mitocondrială succinil-CoA: 3-cetoacid (oxoacid) CoA transferază (SCOT) necesară pentru activarea acetoacetatului în acetoacetil CoA. KB-urile sunt utilizate de țesuturi, în special de creier. KB-urile intră în ciclul acidului citric după ce au fost transformate în acetil CoA de hidroxibutirat dehidrogenază (HBD), succinil-CoA: 3 - CoA transferază (SCOT) și metilacetoacetil CoA tiolază (MAT). Modificat din Owen (2005), Paoli și colab. (2014).
tabelul 1
Nivelurile sanguine în timpul unei diete normale, dietă ketogenică și cetoacidoză diabetică (Paoli și colab., 2012).
| Glucoza (mg/dL) | 80–120 | 65-80 | > 300 |
| Insulină (μU/L) | 6–23 | 6.6–9.4 | ≅ 0 |
| KB conc (mmol/L) | 0,1 | 7-8 | > 25 |
| pH | 7.4 | 7.4 | (Figura 3); 3); BHB induce expresia AgRP în timp ce crește ATP și inhibă fosforilarea AMPK (Cheng și colab., 2008). Mai mult, Laeger și colegii săi au demonstrat recent că, în condiții fiziologice, BHB scade fosforilarea AMPK și expresia mRNA AgRP în celulele hipotalamice GT1-7 (Laeger și colab., 2012). |
Efectele corpurilor cetonice asupra acțiunilor proteinei kinazei activate de AMP (AMPK) în diferite țesuturi.
Alte mecanisme posibile
Microbiotă bună
Se știe că diferite componente dietetice exercită unele efecte asupra compoziției microbiomului intestinal, în principal în legătură cu obezitatea și stările inflamatorii. În general, o dietă mediteraneană are un efect pozitiv, în timp ce o dietă bogată în proteine pare să aibă efecte dăunătoare din cauza fenomenelor de putrefacție (Lopez-Legarrea și colab., 2014; Flint și colab., 2015). Puține date sunt disponibile în acest moment despre efectele KD asupra microbiotei intestinale. De exemplu, un studiu realizat de Crawford și colab. (2009) au investigat reglarea metabolismului cetonei miocardice de către microbiota intestinală și au demonstrat că, în timpul postului, prezența microbiotei intestinale a îmbunătățit aprovizionarea cu corpuri cetonice către inimă unde KB-urile au fost oxidate. În absența unei microbiote, nivelurile scăzute de KB au fost asociate cu o creștere aferentă a utilizării glucozei, dar greutatea inimii a fost încă redusă semnificativ. Reducerea masei miocardice a fost complet inversată la șoarecii fără germeni hrăniți cu o dietă ketogenică. În ceea ce privește controlul alimentelor, putem emite ipoteza că starea metabolică particulară a cetozei ar putea oferi un anumit beneficiu controlului greutății și alimentelor prin acțiuni sinergice între producția de butirat de către bacteriile intestinale și cetonele circulante din sânge (Sanz et al., 2015).
Specii reactive de oxigen
Ca și în cazul GABA, ipoteza speciilor reactive intracelulare de oxigen (ROS) funcționează împotriva rolului de suprimare a foamei a KD: s-a demonstrat că creșterea ROS hipotalamică prin NADPH oxidază este necesară pentru efectul de inhibare a consumului de insulină ( Jaillard și colab., 2009); în plus, s-a demonstrat că există o cale de semnalizare dependentă de ROS în cadrul hipotalamusului care reglează homeostazia energetică și că activarea mecanismelor sensibile la ROS ar putea fi suficientă pentru a promova sațietatea (Benani și colab., 2007). Pe de altă parte, KB-urile scad producția mitocondrială de ROS prin creșterea oxidării NADH în lanțul respirator mitocondrial (Maalouf și colab., 2007).
Concluzii
Deși efectul de reducere a foamei de KD este bine documentat, principalele sale mecanisme de acțiune sunt încă evazive. Tabloul global este complicat de rolul contradictoriu al cetozei asupra semnalelor anorexigenice și orexigenice (rezumat în Figura Figura 4). 4). Cetonele (în principal BHB) pot acționa atât orexigen, fie anorexigen. În mecanismul orexigen, crește nivelul circulant al adiponectinei, crescând fosforilarea GABA și AMPK a creierului și scăderea producției de ROS a creierului. Mecanismul anorexigenic declanșează un răspuns normal la masa de glucoză, crescând FFA circulant după masă (reducând astfel NPY cerebral), menținând răspunsul CCK la masă și scăzând grelina circulantă. Se poate postula că echilibrul net al stimulilor contrastanți are ca rezultat o reducere generală a foametei percepute și a consumului de alimente. Sunt necesare mai multe studii pentru a explora mecanismul potențialelor efecte benefice ale KD asupra controlului alimentelor.
Schema efectelor orexigenice și anorexigenice ale cetozei. Imaginea este extrem de schematică. Pentru mai multe detalii vă rugăm să consultați textul. AMPK, proteina kinază activată cu AMP; CCK, colecistochinina; GABA, acid gamma-aminobutiric; BHB, acid β-hidroxibutiric; FFA, acizi grași liberi; ROS, specii reactive de oxigen; NPY, neuropeptidă Y; AgRP, proteină legată de gena agouti.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
- Ketosis Pasadena Ketogenic Diet Pasadena Keto Diet Los Angeles
- Cum să-ți mănânci toate întrebările legate de alimentație și dietă Răspuns; CĂRȚĂRI WHISTLESTOP
- Îmbunătățirea consumului de alimente la rezidenții caselor de îngrijire medicală cu asistență alimentară Jurnalele de gerontologie
- Lista alimentelor aprobate de HCG pentru faza 3 - Dieta HCG
- KAYTEE Fiesta Gourmet Variety Diet Gerbil; Alimente pentru hamsteri, 2