Departamentul de Pediatrie, Centrul de Epilepsie, Colegiul de Medicină al Universității Inje, Spitalul Sang - gye Paik, Seul
Departamentul de Pediatrie, Centrul de Epilepsie, Colegiul de Medicină al Universității Inje, Spitalul Sang - gye Paik, Seul
Spitalul Ilsan Paik, Goyang
Departamentul de Pediatrie, Spitalul de Securitate, Institutul de Cercetare pentru Copii cu Handicap, Institutul de Cercetare a Creierului, Colegiul de Medicină al Universității Yonsei, Seul, Coreea
Departamentul de Pediatrie, Centrul de Epilepsie, Colegiul de Medicină al Universității Inje, Spitalul Sang - gye Paik, Seul
Departamentul de Pediatrie, Centrul de Epilepsie, Colegiul de Medicină al Universității Inje, Spitalul Sang - gye Paik, Seul
Spitalul Ilsan Paik, Goyang
Departamentul de Pediatrie, Spitalul de Securitate, Institutul de Cercetare pentru Copii cu Handicap, Institutul de Cercetare a Creierului, Universitatea Yonsei, Colegiul de Medicină, Seul, Coreea
Abstract
Rezumat: Scop: Acest studiu a fost întreprins pentru a evalua limitările exacte ale dietei ketogenice (KD) și pentru a colecta date privind prevenirea și gestionarea riscurilor sale.
Metode: Pacienții (129) care au fost în KD din iulie 1995 până în octombrie 2001 la centrul nostru de epilepsie au fost evaluați în studiu. Debutul precoce (în decurs de 4 săptămâni de la începerea KD până la stabilizare) și complicațiile cu debut tardiv (care apar după 4 săptămâni) au fost revizuite.
Rezultate: Cea mai frecventă complicație cu debut precoce a fost deshidratarea, în special la pacienții care au început KD cu postul inițial. De asemenea, au fost observate frecvent tulburări gastrointestinale (GI), cum ar fi greață/vărsături, diaree și constipație, uneori asociate cu gastrită și intoleranță la grăsimi. Alte complicații cu debut precoce, în ordinea frecvenței, au fost hipertrigliceridemie, hiperuricemie tranzitorie, hipercolesterolemie, diferite boli infecțioase, hipoglicemie simptomatică, hipoproteinemie, hipomagnezemie, hiponatremie repetitivă, concentrații scăzute de lipoproteine cu densitate mare, pneumonie lipoidă datorată aspirației, hepatitei, pancreatitei și acidoză metabolică persistentă. Complicațiile cu debut tardiv au inclus, de asemenea, osteopenia, calculii renali, cardiomiopatia, hipocarnitinemia secundară și anemia cu deficit de fier. Majoritatea complicațiilor cu debut precoce și tardiv au fost tranzitorii și au fost gestionate cu succes prin urmărire atentă și strategii conservatoare. Cu toate acestea, 22 (17,1%) pacienți au oprit KD din cauza diferitelor tipuri de complicații grave și patru (3,1%) pacienți au murit în timpul KD, doi cu septicemie, unul cu cardiomiopatie și unul cu pneumonie lipoidă.
Concluzii: Cele mai multe complicații ale KD sunt tranzitorii și pot fi gestionate cu ușurință cu diferite tratamente conservatoare. Cu toate acestea, complicațiile care pun viața în pericol trebuie monitorizate îndeaproape în timpul urmăririi.
Dieta ketogenică (KD) este acceptată ca un tratament antiepileptic puternic pentru epilepsia infantilă intratabilă (1-5), dar este încă utilizată numai la pacienți limitați din cauza îngrijorării toleranței sale scăzute și a unui număr semnificativ de complicații diferite asociate cu aceasta (6- 10). De la aplicarea activă a KD după mijlocul anilor 1990 (1-5), au fost raportate multe tipuri de complicații în mai multe studii, dintre care unele nu au fost descrise anterior (6-13).
Studiul nostru oferă o descriere detaliată a complicațiilor cu debut precoce și tardiv ale KD și date cu privire la întinderea exactă, severitatea, rezultatele și managementul.
METODE
Subiecții acestui studiu au fost 129 de pacienți ai Centrului de Epilepsie de la Spitalul Sanggye Paik de la Universitatea Inje, care au fost tratați pentru epilepsie infantilă intratabilă cu KD din iulie 1995 până în octombrie 2001. Acești pacienți au fost urmăriți> 12 luni.
Optzeci și șapte de pacienți au fost tratați cu protocolul Johns Hopkins (14), începând cu o perioadă inițială de post de aproximativ 2 zile, cu un aport de lichide echivalent cu 75% din aportul de întreținere. Patruzeci și doi de pacienți au fost introduși direct în KD, cu o treime din totalul caloriilor zilnice ingerate în prima zi, fără post inițial; cu două treimi din caloriile zilnice ingerate în a doua zi; și calorii complete din a treia zi a KD în continuare, așa cum sunt tolerate, fără restricții de lichide.
Toți pacienții au fost internați pentru o perioadă medie (± SD) de 5,4 (± 0,53) zile pentru o observație atentă pentru a evalua toleranța inițială a dietei, pentru a monitoriza eventualele complicații acute și pentru a-și educa familiile despre pregătirea dietei la domiciliu. . Toți pacienții au primit KD clasic cu un raport de lipide la nonlipide de 4: 1. KD a fost suplimentat cu multivitamine, calciu la o doză de ± 30 mg/kg pe zi și vitamina D2 la o doză de 40 UI/kg/zi, pe parcursul ciclului său. L-carnitina în doză de 66 mg/kg/zi a fost adăugată, de asemenea, în dietele a 114 pacienți după 1998. Medicamentele antiepileptice (DEA) au fost menținute la aceleași doze, deși formulele au fost modificate pentru a conține cât mai puțini carbohidrați. Acetazolamida (ACZ) a fost întreruptă înainte de începerea KD, dar alte AED, cum ar fi acidul valproic de sodiu (VPA), topiramatul (TPM) și zonisamida (ZNS), au fost continuate în timpul KD.
Am examinat tolerabilitatea inițială și complicațiile asociate cu KD, iar aceste evaluări programate în mod regulat sunt rezumate în Tabelul 1. Criteriile pentru studiile de laborator au fost cele menționate în Nelson Manual de Pediatrie (15). Au fost recomandate vizite periodice ambulatorii la intervale lunare, cu excepția cazului în care s-a observat vreo boală sau complicație medicală. Fizica corpului, toleranța KD și simptomele clinice după începerea acesteia au fost monitorizate îndeaproape. Pacienții cu orice constatare anormală în testele clinice sau de laborator au fost verificați mai frecvent în timpul KD.
| 0, 3, 6 zile și 1, 2, 3, 6, 12, 18, 24 luni |
| CBC cu trombocite, BUN/creatinină, profile hepatice, electroliți cu t CO2, calciu/fosfor/fosfatază alcalină, |
| magneziu, acid uric, profile lipidice, cetonă din sânge, zahăr din sânge, analiză a urinei |
| 0, 3, 6, 12, 24 luni |
| Niveluri DEA din sânge, ultrasunografie abdominală |
| 0, 6, 12, 24 luni |
| Zinc, radiografie simplă pe încheietura mâinii, dacă este necesar; densitometrie osoasă, profiluri de enzime osoase, ecocardiografie |
- CCB, hemograma completă; BUN, azot uree din sânge; profiluri hepatice, proteine / albumine totale, bilirubină totală, aspartat aminotransferază și alanină aminotransferază; profiluri lipidice, colesterol, colesterol lipoproteic cu densitate mare, trigliceride; DEA, medicamente antiepileptice; profile enzimatice osoase, hormon paratiroidian, 25 (OH) vitamina D3, 1,25 (OH) 2 vitamina D3, osteocalcină.
Eficacitatea generală a KD a fost revizuită prin jurnalele de convulsii, iar rata de continuare a KD la acei pacienți cu o reducere a convulsiilor de> 50% este prezentată ca o curbă Kaplan-Meier (SPSS v. 10). Au fost revizuite complicațiile cu debut precoce în decurs de 4 săptămâni de la începerea KD până la stabilizare și complicațiile cu debut tardiv după 4 săptămâni de la începerea tratamentului. De asemenea, am comparat incidența complicațiilor cunoscute anterior ca fiind agravate de VPA, la pacienții tratați cu sau fără VPA (7, 16, 17). Atât analiza χ 2, cât și nepereche t testele au fost efectuate cu SPSS v. 10.
REZULTATE
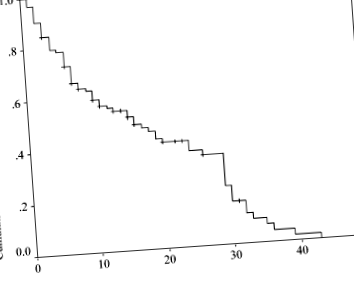
Dintre cei 129 de pacienți înrolați în acest studiu, 69 erau băieți și 60 erau fete. Vârsta medie (± SD) a pacienților la începutul dietei a fost de 64,9 (± 59,3) luni, iar durata medie a KD a fost de 12,0 (± 10,1) luni. Clasificarea epilepsiei și a sindroamelor epileptice este prezentată în Tabelul 2. Rezultatele KD au fost după cum urmează: 36 (27,9%) pacienți au devenit liberi de convulsii; 57 (44,2%) au avut o scădere a convulsiilor> 50%; iar 36 (27,9%) pacienți au avut o scădere a convulsiilor de 50%, 41 nu au putut menține dieta din cauza intoleranței la 18 pacienți; diverse complicații la 20 de pacienți; și abandon la trei pacienți. Cincizeci și doi (40,3%) de pacienți au menținut cu succes KD (Fig. 1).
| Masculin Feminin | 69:60 |
| Vârsta la începutul anului | 7 luni - 27 ani |
| dieta ketogenica (mo) | (medie ± SD, 64,9 ± 59,3) |
| Durata ketogenică | 1–43 |
| dieta (lunar) | (medie ± SD, 12,0 ± 10,1) |
| Clasificare; Nu. de pacienti (%) | |
| Sindromul Lennox - Gastaut | 32 (24,8) |
| Spasmele infantile | 30 (23,3) |
| Encefalopatie epileptică infantilă timpurie | 3 (2.3) |
| Epilepsie mioclonică severă în copilărie | 12 (9,3) |
| Sindromul Landau - Kleffner | 3 (2.3) |
| Sechestru generalizat neclasificat | 11 (8,5) |
| Sechestru parțial neclasificat | 38 (29,5) |
Kaplan - estimarea Meier a ratei cumulative de continuare a dietei ketogenice (KD) la pacienții cu o reducere a convulsiilor de> 50%. Din 93 (72,1%) pacienți care nu aveau convulsii sau au avut o reducere a crizelor> 50%, 41 nu au putut menține dieta din cauza intoleranței la 18 pacienți, a diverselor complicații la 20 de pacienți și a abandonului la trei pacienți. Cincizeci și doi (40,3%) de pacienți au menținut cu succes KD.
| Deshidratare A | 60 (46,5) | ||
| Disconfort gastro-intestinal b | 50 (38,7) | 36 (27,9) | 13 (10,1) |
| Boală infecțioasă c | 12 (9,3) | 27 (20,9) | 5 (3,9) |
| Pneumonie cu aspirație lipoidă | 3 (2.3) | 6 (4.7) | 1 (0,8) |
| Profiluri lipidice | |||
| Hipertrigliceridemie | 35 (27,1) | 26 (20,2) | 15 (11,6) |
| Hipercolesterolemie | 19 (14,7) | 25 (19,4) | 3 (2.3) |
| Hypo HDL d colesterolemie | 5 (3,9) | 1 (0,8) | |
| Hiperuricemie | 34 (26,4) | 10 (7,8) | |
| Hipoglicemie simptomatică e | 9 (7,0) | 1 (0,8) | 1 (0,8%) |
| Hipoproteinemie | 7 (5,5) | 5 (3,9) | |
| Hipomagneziemie | 6 (4.7) | 14 (10,9) | 1 (0,8) |
| Hiponatremie repetată | 6 (4.7) | ||
| Hepatita | 3 (2.3) | 7 (5.4) | |
| Pancreatita acuta | 1 (0,8) | ||
| Acidoza metabolică persistentă | 1 (0,8) | ||
| Osteopenia | 19 (14,7) | ||
| Piatra renală | 4 (3.1) | ||
| Hidronefroză | 1 (0,8) | ||
| Anemie cu deficit de fier | 2 (1,6) | ||
| Hipocarnitinemie secundară | 2 (1,6) | ||
| Cardiomiopatia | 1 (0,8) | ||
- A O reducere a greutății corporale de> 5% din valoarea inițială și a pielii uscate sau a turgorului mucos marcat cu greutatea specifică a urinei crescută de> 1.020.
- b Greață/vărsături, diaree, constipație.
- c Pneumonie, cistită, boală febrilă nespecifică.
- d Lipoproteină de densitate mare.
- e 1.000 mg/dl, în ciuda scăderii raportului lipidă-nonlipidă la 3: 1. Dintre cei 41 de pacienți cu hipercolesterolemie, 30 (73,2%) s-au îmbunătățit spontan și 11 au fost menținuți cu succes cu hipercolesterolemie prelungită cu 50%. Acești 26 de pacienți au prezentat următoarele complicații: nouă (12,3%) pacienți au fost printre cei 73 de pacienți cu tulburări gastrointestinale; cinci (14,7%) au fost printre cei 34 de pacienți cu boli infecțioase; trei (37,5%) au fost printre cei opt pacienți cu pneumonie lipoidă din cauza aspirației; un pacient (5,3%) cu hipomagneziemie persistentă și tetanie a fost printre cei 19 pacienți cu hipomagnezemie; unul (5,3%) a avut acidoză metabolică persistentă; unul (5,3%) a avut pancreatită acută; iar unul (5,3%) a fost printre cei 19 pacienți cu osteopenie. Unul dintre cei 46 de pacienți cu hipertrigliceridemie a întrerupt KD din cauza evoluției prelungite și persistente a acestei complicații. Patru pacienți au murit în timpul KD. Un pacient cu cardiomiopatie a avut deficit de piruvat dehidrogenază (PDHD) și a murit în decurs de 12 luni de la KD. Un pacient cu pneumonie lipoidă a avut un istoric de insultă cerebrală perinatală, posibil combinată cu reflux gastroesofagian, iar doi pacienți cu boli infecțioase grave au avut insultă cerebrală hipoxică din cauza sindromului de aspirație meconium și a encefalitei anterioare. Pneumonie lipoidă și boli infecțioase grave au apărut în decurs de 2 luni de la KD la acești trei pacienți. Rata de mortalitate calculată a fost de 8,97 la 1.000 de persoane - ani.
Dintre cei 73 de pacienți care au continuat KD pentru> 12 luni, 47 (64,4%) au prezentat o scădere a percentilei în greutate, dar doar cinci (6,8%) pacienți au fost sub a treia percentilă. Dintre cei 14 pacienți care ar putea fi urmăriți timp de> 6 luni după întreruperea KD, 11 și-au recuperat percentila de greutate anterioară.
Nouăzeci și șase de pacienți luau VPA în timpul KD și 33 nu. Unul dintre pacienții cu pancreatită acută a fost în grupul comediat cu VPA. Unul dintre pacienții cu cardiomiopatie și pacientul cu hipocarnitinemie secundară s-au numărat printre grupul VPA - fără medicamente. Hepatita a apărut la opt (9,1%) din cei 96 de pacienți din grupul cu tratament medical și la doi (6,5%) din cei 33 de pacienți din grupul fără medicamente (p = 0,67). Nu s-a găsit nicio diferență semnificativă statistic între cele două grupuri în ceea ce privește incidența oricărui tip de complicație. Cetoza puternică s-a dezvoltat în decurs de 2,5 ± 0,7 zile în grupul comediat cu VPA, comparativ cu 2,3 ± 0,5 zile în grupul fără medicamente; aceste valori nu sunt semnificativ diferite (p = 0,13).
DISCUŢIE
Profilele lipidice pot fi modificate prin ingestia prelungită a dietelor bogate în lipide. Cu toate acestea, Swink și colab. (29) au sugerat că ateromul produs de KD poate fi absorbit după revenirea la o dietă normală. Livingston și colab. (30) au raportat că KD nu a influențat tensiunea arterială sau a crescut riscul de complicații cardiovasculare în studiile de urmărire pe termen lung. Wheless și Ashwal (24) au menționat că dieta poate fi continuată, cu excepția cazului în care nivelul de colesterol crește la> 1.000 mg/dl și rămâne acolo. La pacienții noștri, hipercolesterolemia a fost observată la 41 de pacienți, iar hipertrigliceridemia la 46 de pacienți. După cum am raportat în detaliu (31), majoritatea s-au îmbunătățit spontan sau au menținut un nivel de 1.000 mg/dl, au oprit KD. Deoarece complicațiile pe termen lung ale afecțiunilor lipemice sunt necunoscute, sunt necesare studii ulterioare de urmărire pe termen lung.
De Vivo și DiMauro (22) au sugerat că hepatita ar putea fi cauzată de afectarea oxidării acizilor grași sau a deficitului de carnitină, în special la pacienții care primesc și tratament cu VPA. Deși l-carnitina a fost prescrisă în mod obișnuit pentru pacienții noștri, hepatita a apărut la opt din cei 88 de pacienți tratați cu VPA și la doi dintre cei 31 de pacienți care nu au primit VPA. Nu am găsit nicio corelație semnificativă statistic între hepatită și utilizarea VPA. Toți pacienții cu hepatită au prezentat aspartat aminotransferază (AST) și alanină aminotransferază (ALT) niveluri de 9) și pot fi tratați cu tratament conservator. Hiponatremia repetitivă a șase pacienți a fost legată de deshidratare. Un pacient cu hipomagneziemie persistentă cu tetanie și un alt pacient cu acidoză metabolică persistentă a trebuit să întrerupă KD. Cauza acestei acidozei metabolice persistente nu a fost descoperită, în ciuda unei analize metabolice extinse. Mecanismul care stă la baza hipoproteinemiei nu a fost identificat, deși a fost suspectat consumul de gluconeogen datorat restricției de carbohidrați (7). Pacienții cu hipoproteinemie s-au îmbunătățit numai după o creștere a aportului de proteine de la 1 g/kg/zi la 1,5 g/kg/zi, în timp ce raportul lipidă/nonlipidă a fost menținut.
Suplimentarea profilactică cu calciu și vitamina D nu reușește uneori să împiedice progresul modificărilor osteoporotice, dar suplimentarea suplimentară cu ambele ar putea îmbunătăți această afecțiune la toți pacienții cu osteopenie severă. Dacă se suspectează osteopenia din cauza radiografiei simple sau a rezultatelor de laborator, este necesară urmărirea în serie cu densitometrie osoasă, studii hormonale osoase și doze suplimentare monitorizate cu atenție de calciu și vitamina D pentru a preveni progresul osteopeniei în timpul KD.
Doi pacienți au avut hipocarnitinemie secundară înainte de suplimentarea de rutină cu l-carnitină. Hipocarnitinemia poate fi cauzată de un aport scăzut de carnitină în timpul KD, o creștere a cererii, în al doilea rând din utilizarea pe termen lung a DEA, în special VPA și fenobarbital (PB), sau rareori ca urmare a hipocarnitinemiei primare subiacente (17). Ambii pacienți hipocarnitinemici din acest studiu au manifestat slăbiciune generalizată și cardiomegalie ușoară, iar unul a prezentat oboseală excesivă și scăderea puterii musculare. Niciunul dintre pacienți nu a avut hipocarnitinemie primară subiacentă și ambele au fost îmbunătățite doar cu înlocuirea l-carnitinei, cu continuarea KD. După suplimentarea de rutină cu l-carnitină la 66 mg/kg/zi, niciun alt pacient nu a avut hipocarnitinemie. Rutledge (37) a raportat că dieta ketogenică poate induce un deficit de carnitină, care la rândul său poate interfera cu efectele dietei de reducere a convulsiilor. Cu toate acestea, deoarece riscul de deficit de carnitină depășește efectele de reducere a convulsiilor și pentru că nu este ușor să recunoaștem starea de deficit de carinitină, recomandăm suplimentarea de rutină.
În plus față de aceste complicații, au fost raportate recent lipemie retiniană, neuropatie optică bilaterală, alopecie, acidoză tubulară renală și anemie hemolitică (7, 38). Pacienții noștri au fost suplimentați în mod obișnuit cu vitamina B, iar problemele optice, care sunt rareori raportate cu suplimentarea cu vitamina B, nu au fost observate (39).
VPA s-a demonstrat experimental că reduce cetonemia de post, dar din punct de vedere clinic, terapia VPA nu a împiedicat inițierea KD sau realizarea unei cetoze adecvate (40, 41). Din experiența noastră, APV nu a afectat realizarea unei cetoze adecvate și nu a fost legată de sau nu a crescut apariția niciunei complicații, inclusiv pancreatită acută, cardiomiopatie sau hipocarnitinemie secundară.
În concluzie, KD poate provoca diverse complicații, dar cele mai multe dintre acestea pot fi îmbunătățite printr-un management conservator, fără a fi nevoie să opriți KD. Cu toate acestea, uneori am întâmpinat complicații grave care necesită întreruperea KD, iar bolile infecțioase care pun viața în pericol, pneumonia lipoidă datorată aspirației și cardiomiopatia au produs rezultate fatale. Rata mortalității nu a fost mai mare decât cea asociată cu progresia naturală a epilepsiei simptomatice din copilărie (42). Cu toate acestea, pentru a preveni rezultatele fatale cu KD, detectarea precoce a bolilor grave și intervenția activă par a fi cele mai importante, la fel ca sprijinul nutrițional adecvat și screening-ul extins pentru tulburările metabolice sau imunologice subiacente.
- Dieta dinozaurilor prosauropode din triasicul târziu și jurasicul timpuriu - GALTON - 1985 - Lethaia
- Descrierea dietei ketogenice în limba spaniolă Descriere a Dieta Ketogénica în Español Epilepsie
- Efectele unei diete ketogenice asupra puterii și puterii
- Provocări clinice Dieta ketogenică de siguranță incertă pentru sănătatea inimii MedPage astăzi
- Efectele unei diete ketogenice în timpul sarcinii asupra creșterii embrionare la șoarece - PubMed