Abstract
Introducere
Adipocitele, celulele care alcătuiesc cea mai mare parte a țesutului adipos din organism, au un rol fiziologic important dincolo de capacitatea lor de stocare a lipidelor. Ele secretă o serie de molecule de semnalizare celulare importante, denumite adipokine. Aceste adipokine au consecințe variind de la efecte autocrine și paracrine locale la acțiuni endocrine sistemice. Adipokinele variază foarte mult atât în funcția lor, cât și în mecanismele de control. Un astfel de mecanism de control este compoziția de acizi grași a țesutului adipos care poate afecta semnalizarea celulară, traficul de acizi grași, expresia genelor și, în consecință, metabolismul [1]. Compoziția țesutului adipos variază în funcție de doi factori principali: echilibrul energetic, care reglează metabolismul acizilor grași liberi din țesutul adipos și dieta, care va modifica profilul acizilor grași al țesutului adipos. Deși primul a fost examinat pe larg, în special în ceea ce privește expresia leptinei și diferențierea adipocitelor, efectele acestuia din urmă asupra funcției endocrine au fugit recent pentru a fi investigate.
Adiponectina este cea mai puternic exprimată și secretată adipokină, cu efecte benefice asupra metabolismului, inflamației și funcției vasculare. Adiponectina are un model de expresie paradoxal. Pe măsură ce adipozitatea crește, exprimarea și secreția adiponectinei scade în țesutul adipos [2]. Se crede că acest paradox face parte din patologia obezității și este simptomatic al țesutului adipos disfuncțional. Adiponectina joacă un rol în sensibilitatea la insulină, oxidarea LDL, activarea eNOS, suprimarea inflamației și catabolismul acizilor grași [3-5). Astfel, hipoadiponectinemia prezintă interes ca biomarker atât al bolilor cardiovasculare, cât și al sindromului metabolic.
O altă adipokină importantă care ar putea fi stimulată de modificări ale profilului acizilor grași este leptina. A fost descoperită mai întâi ca proteină codificată de atârna genă, denumită după fenotipul șoarecelui knockout dublu. Acești șoareci nu experimentează nici o sațietate și, astfel, mănâncă continuu când sunt hrăniți ad libitum, ducând la obezitate severă indusă de dietă. La om, deficitul de leptină a fost implicat în cazurile de obezitate morbidă, fie ca factor genetic, fie ca insuficiență metabolică [6, 7]. Rolul leptinei în suprimarea apetitului mediată hipotalamic ca răspuns la aportul caloric nu este singura sa funcție. Leptina poate fi, de asemenea, importantă în modularea activității celulelor T în stadiile incipiente ale dezvoltării aterosclerotice, precum și în alte celule imune [8]. În obezitate, leptina poate fi sub-exprimată de țesutul adipos ca răspuns la o dietă calorică constantă sau receptorii de leptină pot fi reglați în jos, ducând astfel la niveluri ridicate de leptină plasmatică și rezistență la leptină [9].
Semințele de in au câștigat recent popularitate ca aliment funcțional. Acidul alfa-linolenic (ALA) cuprinde aproximativ 55% din conținutul total de acizi grași din acizii grași din semințe de in [10]. Dietele bogate în ALA, inclusiv dietele îmbogățite cu semințe de in măcinate, au fost demonstrate în studii intervenționale și experimentale pentru a reduce atât infarctul miocardic fatal, cât și non-fatal [11, 12], aritmiile cardiace [12-15] și incidența leziunilor aterosclerotice. [12, 14, 16, 17]. Cu toate acestea, mecanismul prin care ALA și semințele de in induc această acțiune cardio-protectoare este neclar. Datele anterioare au indicat faptul că ALA dintr-o dietă îmbogățită cu semințe de in se depune în țesutul adipos [18]. Prin urmare, este posibil ca această modificare a conținutului de acid gras al țesutului adipos să afecteze funcția țesutului adipos. Ipotezăm că schimbarea compoziției lipidice în țesutul adipos ca răspuns la o dietă suplimentată cu semințe de in poate afecta semnalizarea adipokinei de la adipocite. Prin urmare, este posibil ca acțiunile cardiovasculare benefice ale semințelor de in observate anterior să poată fi asociate cu modificări ale expresiei adipokinei.
Materiale și metode
Dieta și hrănirea
Toate experimentele au fost efectuate în conformitate cu liniile directoare ale Consiliului canadian pentru îngrijirea animalelor. Șaisprezece bărbați iepuri albi din Noua Zeelandă (2,8 ± 0,1 kg, iepure trandafir de sud) au fost repartizați aleatoriu pentru a primi una din cele patru diete. Dietele au fost preparate așa cum s-a descris anterior [15, 17] prin adăugarea de componente la o dietă obișnuită (RG) de iepure (CO-OP Complete Rabbit Ration, Federated Co-operatives): 0,5% colesterol (CH) sau 10% semințe de in macinate (FX), sau ambele (CF) timp de 8 săptămânin = 4). Chow a fost depozitat la 4 ° C și protejat de lumină. Dietele s-au diferit numai în ceea ce privește conținutul total de grăsimi datorită includerii semințelor de in macinate bogate în ALA natural (tabelele 1, 2). Compoziția de acizi grași din dietă este prezentată în tabelul 2. Adăugarea semințelor de in la dietă a crescut semnificativ cantitatea de C16: 0, C18: 0, C18: 1 (acid oleic) și C18: 3 (ALA) furnizate. Adăugarea de colesterol nu a avut niciun efect semnificativ asupra acizilor grași alimentari furnizați în comparație cu dieta RG. Iepurii au fost hrăniți cu 125 g/zi de dietă.
Eșantionare și analiză de sânge
Sângele a fost extras din vena urechii marginale stângi a iepurilor, care au fost postiti peste noapte înainte de a începe dieta experimentală și la 8 săptămâni. A fost colectat în tuburi vacutainer conținând EDTA (Becton-Dickinson). Probele de sânge au fost centrifugate la 4.500 ×g la temperatura camerei timp de 10 minute, iar plasma a fost apoi stocată la -80 ° C. Înainte de analiză, probele de plasmă au fost decongelate și centrifugate la 6.800 ×g. Nivelurile plasmatice ale colesterolului și trigliceridelor au fost analizate folosind un analizor VetTest 8008 de chimie a sângelui (Laboratoarele IDEXX). Acizii grași au fost extrasați din plasmă și derivați, așa cum s-a descris anterior [15, 18].
Colecția de țesuturi
După 8 săptămâni de tratament dietetic, animalele au fost eutanasiate cu 5% gaz izofluran livrat prin mască facială, urmate de extracție cardiacă. Au fost colectate țesut adipos retroperitoneal și epididimal. Pentru a preveni contaminarea cu RNase, animalul și instrumentele au fost pulverizate cu RNaseZap (Ambion) atât înainte, cât și în timpul colectării țesuturilor. Țesutul adipos a fost plasat imediat în ARNlater și păstrat peste noapte la 4 ° C, așa cum se indică în instrucțiunile producătorului (Ambion). Testele preliminare au indicat faptul că a existat o stabilizare cu succes a ARNm comparativ cu congelarea rapidă sau întreținerea peste noapte la 4 ° C (așa cum a fost evaluat prin electroforeză pe gel de agaroză și ulterior qRT-PCR) în ciuda conținutului ridicat de lipide din acest țesut. ARNlater a fost îndepărtat din țesut prin aspirație, iar probele au fost apoi congelate rapid în azot lichid și depozitate la -80 ° C.
qRT-PCR
ARN-ul a fost extras din țesutul adipos într-un mediu fără RNază. Țesutul adipos a fost omogenizat în reactiv Trizol (Invitrogen), iar grăsimea a fost îndepărtată. Fenolul a fost separat de soluție prin spălarea soluției de două ori cu cloroform. ARN a fost precipitat din soluție cu etanol și adăugat la coloanele RNeasy pentru purificare ulterioară (Qiagen). ARN-ul extras a fost cuantificat și evaluat pentru calitate prin spectrofotometru și electroforeză pe gel de agaroză. A fost apoi folosit pentru qRT-PCR (Quanta Biosystems) folosind un sistem de detecție PCR în timp real iQ5 (Bio-Rad). Grundele concepute utilizând software-ul BLAST (NCBI) și au fost după cum urmează: Adiponectină: (Forward 5′ACCAGGACAAGAACGTGGAC3 ′, Reverse 5′TGGAGATGGAATCGTTGACA3 ′);
Leptină: (Forward 5′GTCGTCGGTTTGGACTTCATC3 ′, Reverse 5′CGGAGGTTCTCCAGGTCGTTG3 ′) [19];
GAPDH: (Înainte 5′GATGGTGAAGGTCGGAGTGAA3 ′, Reverse 5′GGTGAAGACGCCAGTGGATT3 ′).
Grundele au fost validate utilizând software-ul BLAST al NCBI [21]. Probele neutilizate au fost depozitate la -80 ° C. ADNc a fost sintetizat din 1 ug de ARN cu qScript cDNA Supermix (Quanta) prin instrucțiunile producătorului. qPCR a continuat timp de 2 minute la 50 ° C, 95 ° C timp de 8,5 min, apoi 40 de cicluri de 95 ° C timp de 15 s și 60 ° C timp de 60 s, moment în care datele au fost capturate. O curbă de topire a fost obținută după ciclare cu 95 ° C timp de 1 min, urmată de 55 ° C timp de 1 min și 80 de cicluri de captare de 10 s de 55 + 0,5 ° C/ciclu. Rezultatele au fost normalizate prin expresia GAPDH și analizate prin metoda delta - delta-Ct utilizând software-ul de detectare în timp real iCycler.
Extracția și metilarea acizilor grași
Acizii grași plasmatici au fost extrasați direct și derivatizați utilizând o modificare a metodei originale descrisă de Lepage și Roy [22] și modificată ulterior de Garg și colab.. [23]. Pe scurt, 100 μL de plasmă au fost combinate cu 2 ml de 4: 1 (v/v) metanol: toluen într-un tub de sticlă borosilicat. Soluția metanol: toluen conținea 0,5 mg/ml din standardul intern, C19: 0 (Nu-Chek Prep. Inc.). În timp ce se rotea, s-au adăugat încet 200 pl de clorură de acetil. Tuburile au fost acoperite cu un capac căptușit cu teflon, cântărite și apoi încălzite la 100 ° C timp de 1 oră. Odată răcite la temperatura camerei, tuburile au fost re-cântărite pentru a se asigura că nu au avut loc pierderi de probă. S-au adăugat apoi cinci mililitri de soluție apoasă de 6% K2CO3 pentru a termina și neutraliza reacția. Tubul de probă a fost apoi centrifugat la 5.000 rpm timp de 5 minute la temperatura camerei, după care stratul superior de toluen a fost îndepărtat și supus analizei cromatografice cu gaz utilizând detectarea ionizării cu flacără (GC-FID). Metilarea a fost verificată prin cromatografie în strat subțire. Acizii grași din aproximativ 15 mg de țesut adipos au fost extrase și derivatizate utilizând metoda prezentată de Lepage și Roy [24].
Cromatografia cu gaze
Esterii metilici ai acizilor grași (FAME) au fost injectați pe un sistem de cromatografie gazoasă Varian CP 3800 utilizând un autosamplator Varian CP 8400. Analizele au fost detectate folosind detectarea ionizării cu flacără și analizate pe o stație de lucru Varian MS (vrs. 6.9.1). Un microlitru de probă a fost injectat la 250 ° C la un raport de divizare de 50: 1 pe o coloană capilară Varian CP-Sil 88 (60 m × 0,25 mm × 0,20 μm). Heliu gazos (ultra pur) a fost folosit ca gaz purtător la un debit constant de 1,5 ml/min. Temperatura cuptorului a fost menținută la 111 ° C timp de 1 min, apoi a crescut rapid cu 20 ° C/min până la 170 ° C. Apoi a fost crescut încet la o rată de 5 ° C/min până la 190 ° C și în cele din urmă cu 3 ° C/min până la 225 ° C, unde a fost menținut timp de 10 min. FAME au fost cuantificate în raport cu un standard extern, GLC 462 (Nu-Chek Prep, Inc.).
Cuantificarea aterosclerozei aortice
Aorta de la arcada ascendentă la bifurcația iliacă a fost izolată din țesuturile periferice și spălată în PBS rece, apoi deschisă longitudinal și fixată plat. Lumenul aortic a fost fotografiat digital, iar imaginile luminale au fost analizate cu ajutorul software-ului Silicon Graphics Imaging. Dungile grase și leziunile complicate au fost exprimate ca o percentilă a suprafeței luminale totale.
Statistici
Rezultatele au fost raportate ca medii ± SE și analizate cu software-ul Sigma-Stat prin ANOVA unidirecțional, utilizând testul LSD Fisher. O corelație semnificativă a fost identificată de o t Test. p ≤0,05 a fost considerat semnificativ statistic.
Rezultate
Greutate corporala
După 8 săptămâni de tratament dietetic, greutatea corporală medie a crescut semnificativ de la 2,8 ± 0,06 la 3,7 ± 0,09 kg. Cu toate acestea, nu a existat niciun efect asupra greutății cu dietele experimentale în comparație cu dietele de control (datele nu sunt prezentate).
Lipidele plasmatice
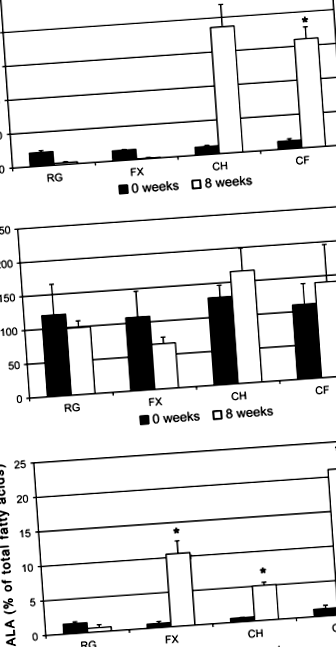
Nu a existat nicio modificare semnificativă a colesterolului plasmatic la animalele hrănite cu o dietă obișnuită sau suplimentată cu semințe de in după 8 săptămâni. Suplimentarea dietei cu colesterol dietetic timp de 8 săptămâni a indus hipercolesterolemie severă (Fig. 1a). Adăugarea semințelor de in dietetice la o dietă îmbogățită cu colesterol nu a scăzut valorile colesterolului plasmatic din cele observate la animalele hrănite cu o dietă suplimentată doar cu colesterol.
Trigliceridele plasmatice nu au fost afectate semnificativ de niciuna dintre diete (Fig. 1b). Adăugarea de semințe de in măcinate la dietă, oferind ALA, a indus o creștere de 17 ori a compoziției procentuale de ALA în plasmă (Fig. 1c). Consumul simultan de semințe de in și colesterol a dublat cantitatea de ALA din plasmă comparativ cu consumul de semințe de in singur, cuprinzând 21% din toți acizii grași din plasmă. o creștere de opt ori a ALA plasmatice, în ciuda faptului că i se oferă doar 2 mg ALA/gram, susținând observația că colesterolul ajută la absorbția ALA [15-18].
Ateroscleroza
Animalele hrănite cu o dietă obișnuită sau suplimentată cu semințe de in timp de 8 săptămâni nu au dezvoltat nicio ateroscleroză cuantificabilă în arcada aortică (Fig. 2). Includerea a 0,5% colesterol în leziuni aterosclerotice induse de dietă în aortă, acoperind 76,3 ± 8,5% din lumenul aortic (p FIG. 2
Dezvoltarea leziunilor aterosclerotice pe aorta iepurilor albi din Noua Zeelandă după 8 săptămâni de tratament dietetic. Valorile sunt mijloace ± SE; n = 3. *p ≤ 0,05 versus RG; p ≤ 0,05 versus CH. RG chow regulat, FX chow suplimentat cu 10% semințe de in, CH 0,5% dietă suplimentată cu colesterol, CF 10% semințe de in și 0,5% dietă suplimentată cu colesterol
Compoziția cu acizi grași a țesutului adipos
Lipidele totale au fost extrase din două surse primare de grăsime viscerală. Grăsimile epididimale și retroperitoneale au fost formate din 92,24% lipide în greutate umedă (interval 83,3-99,5%), fără modificări semnificative ale lipidelor totale între diferitele tratamente dietetice sau fie sursă adiposă (Tabelele 3, 4).
Componenta principală a țesutului adipos a fost C18: 1, acid oleic, care a compus din 32,3 ± 1,9% din totalul acizilor grași din adiposul retroperitoneal al animalelor hrănite cu RG (Tabelul 3). C16: 0, acid palmitic și C18: 2, acid linoleic, au fost, de asemenea, frecvente, cuprinzând 25,2 ± 1,4 și 26,7 ± 1,3% din conținutul total de acid gras al țesutului adipos retroperitoneal. De asemenea, depozitate în cantități apreciabile în țesutul adipos retroperitoneal al animalelor hrănite cu o dietă obișnuită au fost ALA (6,34 ± 0,34%), acid steric (6,14 ± 0,57%), acid palmitoleic (2,12 ± 0,08%), acid vaccenic (1,98 ± 0,21%) ) și acid miristic (1,77 ± 0,12%) (Tabelul 3).
Proporțiile de acizi grași din țesutul epididimal al animalelor hrănite cu o dietă regulată nu au fost semnificativ diferite de proporțiile de acid gras din țesutul retroperitoneal (Tabelul 4). Colesterolul alimentar nu a afectat în mod semnificativ nici lipidele totale, nici acizii grași individuali în comparație cu RG. Adăugarea semințelor de in la o dietă obișnuită a redus semnificativ nivelurile de C16: 0, C18: 1-cis, C18: 1-trans, și C18: 2 în țesutul adipos, atât în concentrații absolute, cât și în raport cu conținutul total de acizi grași (Tabelele 3, 4). Când este consumată împreună cu 0,5% colesterol, semințele de in din dietă au indus o creștere de 3,1 ori a ALA a țesutului adipos, o creștere semnificativă în comparație cu RG, dar semnificativ mai mică decât animalele suplimentate doar cu semințe de in. Colesterolul alimentar nu a afectat niciunul dintre ceilalți acizi grași observați.
Adipokine Expression
Adiponectina și leptina sunt cele două cele mai puternic exprimate adipokine din țesutul adipos. În țesutul adipos epididimal, nu a existat nicio modificare semnificativă în expresia ARNm de leptină sau adiponectină după adăugarea fie a semințelor de in, fie a colesterolului în dietă (Fig. 3a). Expresia adiponectinei nu a variat în funcție de tratamentul dietetic în țesutul adipos retroperitoneal (Fig. 3b). Cu toate acestea, în țesutul adipos retroperitoneal, semințele de in dietetice au indus o creștere de două ori a mARN-ului leptinei (p FIG. 3
Aceste modificări ale expresiei leptinei au fost corelate pozitiv cu nivelurile ALA plasmatice și ALA adipos (Fig. 4). ALA plasmatică corelată cu expresia leptinei în țesutul adipos retroperitoneal (p FIG. 4
Relația expresiei leptinei cu ateroscleroza
Toate animalele care nu au fost hrănite cu colesterol nu au prezentat nicio ateroscleroză. În consecință, pentru a determina dacă a existat o relație semnificativă între expresia leptinei și dezvoltarea leziunilor aterosclerotice, regresia liniară a fost efectuată numai pe datele obținute de la animale hrănite cu o dietă suplimentată cu colesterol. Creșterea expresiei leptinei în țesutul adipos retroperitoneal s-a corelat semnificativ (p FIG. 5
Discuţie
Mecanismul prin care expresia ARNm a leptinei este reglată de lipidele dietetice este în prezent neclar. Deși expresia ARNm SREBP1c este direct legată de conținutul de acizi grași polinesaturați din țesutul adipos [30] și un element de legare asemănător SREBP este prezent în promotorul leptinei, nu răspunde la SREBP în sine [31]. Cu toate acestea, acizii grași polinesaturați pot acționa ca liganzi pentru PPAR gamma pentru a modifica expresia adipokinei [32]. Acest lucru poate apărea printr-o creștere a traducerii [33]. Mason și colab. [28] au demonstrat un nou situs de legare pentru un factor de transcripție specific adipocitelor în poziția -87 a promotorului de leptină care este conservat atât la șoareci, cât și la oameni, cu toate acestea, secvența consens nu se potrivește cu niciun factor de transcripție cunoscut. Această regiune, denumită LP1, prezintă o posibilitate interesantă pentru un nou factor de transcripție care poate regla răspunsul leptinei la lipidele dietetice, în plus față de PPAR-gamma.
Observația că țesutul adipos răspunde la aceste diete într-un mod foarte specific sugerează că modificările sunt importante din punct de vedere fiziologic. Nivelurile crescute de leptină au fost identificate anterior ca un factor de risc pentru ateroscleroză [34]. Cu toate acestea, datele care corelează leptina și ateroscleroza au fost derivate de la oameni obezi și modele animale de obezitate [35-39]. Datele noastre indică faptul că, într-o populație non-obeză, leptina poate avea un rol neidentificat anterior în cardioprotecție. În sprijinul acestei ipoteze, expresia leptinei a fost semnificativ corelată negativ cu ateroscleroza. Când nivelurile de leptină erau ridicate, ateroscleroza era scăzută și când expresia leptinei era deprimată prin colesterolul circulant, aterogeneza a fost stimulată.
Citokinele benefice și dăunătoare din țesutul adipos pot fi responsabile pentru multe dintre legăturile dintre dietă, IMC și boli cardiovasculare. Datele actuale demonstrează că colesterolul din dietă și semințele de in au capacitatea de a modifica expresia leptinei. Se consideră că efectele cardioprotectoare ale semințelor de in sunt furnizate parțial prin administrarea de ALA către organism [16, 40]. Cu toate acestea, mecanismul pentru a explica inducerea acestor efecte de către ALA rămâne evaziv. În studiul de față, ALA în țesutul adipos a fost puternic asociată cu creșterea expresiei leptinei și reducerea ulterioară a aterosclerozei. Datele noastre, prin urmare, sugerează că semințele de in pot induce efectele sale anti-aterogene parțial printr-o modulație mediată de ALA a expresiei leptinei.
- Piața acidului tioctic (acid alfa lipoic) pentru creșterea masivă a martorilor oculari până în 2028 Shyndec, Taike
- Pastile de pierdere în greutate Top 5 Cele mai bune recenzii privind pierderea în greutate cu acid alfa lipoic Aprobat de FDA _ Terapeutic
- Beneficiile acidului alfa lipoic - broasca de plante
- Cele mai bune 17 recenzii pentru suplimente de aminoacizi 2020
- Tratamentul bolii pediatrice Graves este asociat cu creșterea excesivă în greutate