Jana Matic
Divizia Metabolismului și Centrul de Cercetare pentru Copii, Spitalul Universitar pentru Copii din Zurich, Zurich, Elveția
Nina A. Zeltner
Divizia de Metabolism și Centrul de Cercetare pentru Copii, Spitalul Universitar pentru Copii din Zurich, Zurich, Elveția
Johannes Häberle
Divizia de Metabolism și Centrul de Cercetare pentru Copii, Spitalul Universitar pentru Copii din Zurich, Zurich, Elveția
Abstract
Restricția cu fenilalanină dietetică la pacienții cu fenilcetonurie (PKU) este de obicei obligatorie pentru a preveni afectarea cognitivă. Influența unei diete cu conținut scăzut de proteine asupra creșterii a ridicat îngrijorări în familii și îngrijitori. Această lucrare își propune să investigheze creșterea la pacienții cu PKU tratați cu o dietă săracă în proteine, inclusiv suplimentarea aminoacizilor și a altor substanțe nutritive conform protocoalelor standard.
Am efectuat un studiu cu un singur centru, transversal, cu privire la creșterea la pacienții copii cu PKU (n = 51) tratați cu o dietă cu conținut scăzut de proteine pe o perioadă de 20 de luni. Înălțimea fraților sănătoși (n = 44) și înălțimea țintă, calculate pe baza înălțimii părinților, au servit drept controale.
Nu s-au găsit diferențe semnificative statistic comparând scorurile medii ale înălțimii z între pacienți și frați (p = 0,261). Cuvinte cheie: Creștere, dietă săracă în proteine, fenilcetonurie, PKU, înălțimea țintă
Introducere
Fenilcetonuria (PKU) este o eroare înnăscută a metabolismului l-fenilalaninei (Phe) cauzată de un defect autozomal-recesiv al genei fenilalanine hidroxilazei (PAH) (Blau și colab. 2010). Incidența globală a PKU este estimată între 1: 10.000 și 1: 15.000 și 1: 8.000 în Europa (Blau și colab. 2011; Loeber 2007; Widaman 2009).
Deoarece fenilalanina hidroxilază (HAP) catalizează conversia Phe în tirozină, PKU duce la creșterea nivelului de Phe în sânge (hiperfenilalaninemie, HPA) și țesuturile corpului, dar niveluri scăzute de tirozină. Tirosina este un precursor al l-dopa (3,4-dihidroxi-l -phe), care este metabolizat în neurotransmițători cheie și catecolamine (Widaman 2009; Williams și colab. 2008).
Activitatea PAH necesită prezența oxigenului molecular și a cofactorului său tetrahidrobiopterină (BH4), care acționează ca un șaperonă pentru a preveni deplasarea PAH (Scriver 2007; Thöny și Blau 2006; Williams și colab. 2008). Defectele moștenite ale metabolismului BH4 datorate mutațiilor genelor care codifică biosinteza BH4 sunt mai puțin frecvente și reprezintă 2-3% din totalul HPA (Blau 2016; Thöny și Blau 2006).
În funcție de gradul de creștere a concentrațiilor de Phe din sânge, severitatea bolii poate fi clasificată: HPA benignă este definită cu niveluri de Phe de 120–600 μmol/L, PKU ușoară cu niveluri de Phe de 600–1.200 μmol/L și clasică PKU cu niveluri de Phe> 1.200 μmol/L (Blau și colab. 2010). În prezent există un total de 1.040 mutații PAH descrise (http://www.biopku.org/home/home.asp), dintre care 60% sunt mutații cu sens greșit, urmate de variante și ștergeri de îmbinare (14% fiecare) (Blau et și colab. 2014; Williams și colab. 2008).
Aparând normal la naștere, pacienții cu PKU ar dezvolta complicații neurologice, cum ar fi microcefalia, disfuncții motorii, convulsii, insuficiență de creștere, distonie și spasticitate și pot evolua spre întârziere mentală severă dacă nu sunt tratați (Blau 2016; Widaman 2009; Williams și colab. 2008) .
Programele de screening pentru nou-născuți (BNS) sunt acum introduse în multe țări ca un instrument eficient pentru diagnosticarea precoce și inițierea terapiei în primele zile după naștere. Ghidurile actuale sugerează tratarea pacienților cu niveluri de Phe care depășesc 360 sau 600 μmol/L cu intensitate variabilă în funcție de vârsta pacientului și de creșterea Phe (Burgard și colab. 2017; Diamond și colab. 1997; van Spronsen și colab. 2017; Vockley și colab. . și colab. 2014; Weglage și colab. 2001).
Pentru a asigura creșterea și dezvoltarea normală, precum și nivelurile de Phe în intervalele terapeutice, pacienții cu PKU necesită o dietă echilibrată, cu o monitorizare atentă a aportului lor nutrițional (van Spronsen și colab. 2017; Vockley și colab. 2014). Cele două componente principale ale managementului PKU sunt, în primul rând, restricția dietetică a proteinelor și, în al doilea rând, produsele nutriționale speciale pentru a evita aminoacizii esențiali sau alte deficiențe nutritive (Panel 2001). Scopul creșterii normale este expus riscului în cazul restricționării excesive a proteinelor fără suplimentarea adecvată, așa cum sa observat în primii ani de tratament cu PKU (Mereu 1967). În ultimele decenii, produsele dietetice cu o compoziție superioară, disponibilitatea alimentelor cu conținut scăzut de proteine și o monitorizare îmbunătățită a pacienților care urmăresc să mimeze îndeaproape nutriția normală și astfel să permită o creștere și o dezvoltare neafectată (Vockley et al. 2014).
Cu toate acestea, au existat îngrijorări, atât în rândul familiilor afectate, cât și al cadrelor medicale, că o dietă cu conținut scăzut de proteine din PKU poate afecta în continuare creșterea normală. Pentru a investiga acest lucru, am studiat înălțimea pacienților cu PKU sub o dietă cu conținut scăzut de proteine într-un singur centru metabolic în comparație cu înălțimea fraților neafectați și înălțimea țintă așteptată pe baza înălțimii părinților lor.
Material si metode
Cohorta pacientului
Acest studiu a fost efectuat la pacienți cu PKU, tratați la Spitalul Universitar de Copii din Zurich, care au fost toți diagnosticați prin BNS și tratați imediat după diagnosticul. Toți pacienții incluși au fost tratați printr-o dietă cu conținut scăzut de proteine, au participat la vizite periodice ambulatorii și au efectuat o monitorizare regulată la domiciliu a nivelurilor de Phe. Am exclus pacienții cu HPA și care nu au nevoie de restricții proteice și cei cu complianță slabă (definiți ca concentrații de Phe în principal peste limita superioară a intervalului de toleranță în ultimul an înainte de începerea studiului).
Datele au fost achiziționate în timpul programului de rutină anual de ambulatoriu între iulie 2015 și ianuarie 2017.
Un consimțământ informat, semnat de pacienți sau de tutorii legali, a fost obținut înainte de înscriere. Acest studiu a fost aprobat de Comitetul de Etică al Universității din Zurich (KEK-ZH-Nr. 2015-0281).
Controlul populației
Controlul populației a cuprins frații și părinții pacienților. Au fost incluse ultimele pentru a calcula înălțimea țintă așteptată a pacienților. Subiecții cu boli cronice cu relevanță pentru nutriție sau dezvoltare au fost excluși.
Antropometrie
Înălțimea pacienților și controalele au fost măsurate în timpul programărilor ambulatorii. Dacă controalele erau absente, părinților li se cerea să măsoare înălțimea reală a corpului și să o raporteze telefonic coordonatorului studiului.
tabelul 1
Sexul, vârsta, înălțimea și percentila pacienților și controalele
| Sex (femeie) | 43,1% | 34,1% | 0,373/0,555 | |
| Vârstă (ani), medie (SD) | 8,96 (5,17) | 11,66 (5,07) | 0,012/- | |
| Înălțime (cm) | ||||
| Înălțime, medie (SD) | 127,41 (31,36) | 144,08 (26,84) | 171,90 (7,96) | 0,007/- |
| Înălțime, mediană [P25 - P75] | 135,0 [102,6–152,8] | 142,5 [121,5-170,25] | 174,0 [165,0–177,5] | |
| Înălțimea z-scor Spitalul Universitar de Copii, medie (SD) | −0,29 (1,00) | −0,03 (1,17) | 0,17 (0,80) | 0,261/0,013 |
p 1 valoarea p a comparației dintre pacienți și controlul 1: frați, p 2 valoarea p a comparației dintre pacienți și controlul 2: înălțimea țintă
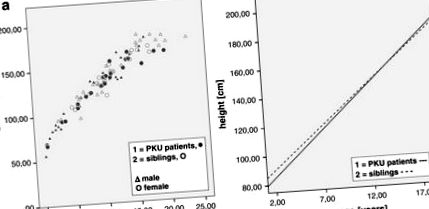
Înălțimea medie a pacientului (deviație standard) a fost de 127,41 cm (± 31,36), ceea ce este semnificativ mai mic în comparație cu frații (144,08 cm ± 26,84), în timp ce aceste grupuri au diferit și în ceea ce privește vârsta (frați: 11,57 ani ± 5,17; pacienți: 8,95 ani ± 5.18), așa cum este ilustrat în Fig. Fig.1 1 .
(A) Înălțimea până la vârstă separată pentru pacienții și frații de sex masculin și feminin; (b) linia de regresie a pacienților (linia completă) și a fraților (linia punctată), cu vârste cuprinse între 2 și 18 ani (1; 1; 1: R2 Liniar = 0,941 2; 2; 2: R2 Liniar = 0,912)
Analize statistice
Pacienții și frații au dezvăluit o înălțime negativă a scorului z, rezultând o medie de -0,29 (± 1,00) și, respectiv, -0,03 (± 1,17), în timp ce înălțimea țintă înălțimea medie a scorului z a fost de 0,17 (± 0,80) (Tabelul 1). 1). O comparație între scorurile z ale pacienților, fraților și înălțimea țintă în diagramele de împrăștiere și în diagramele de cutie este prezentată în Fig. Fig.2 2 .
Înălțimea scorurilor z ale pacienților, fraților și înălțimii țintă în diagramele împrăștiate. (A) separate prin sex și boxplots; (b) afișarea fiecărei două valori externe în frate și în grupul de înălțime țintă, cu scorurile z înălțime individuale fiind: numărul ID (scor z): 109 (−3,34); 75 (-4,20); 154 (2,19); și 124 (-1,99)
Nu s-a găsit nicio diferență semnificativă între scorurile medii ale înălțimii z ale pacienților și fraților (t = -1,13, p = 0,261, mărimea efectului r = 0,11).
- Oamenii obezi aproape niciodată nu ating greutatea normală, arată studiul - CBS News
- Natural Usa Oxy Pro Elite Recenzii pastile dietetice - Global Study UK
- Suplimentele pentru pastile dietetice pentru farmacii naturale - Studiu global Marea Britanie
- Studiul constată că pacienții cu PWS au niveluri diferite de irizină decât alți obezi
- Planul dietetic specific funcționează mai bine decât medicamentele pentru diabetul de tip 2, arată studiul