Kum Kum S. Bhasin
1 Departamentul de Medicină, Școala de Medicină David Geffen, Universitatea din California, Los Angeles, California
Attila van Nas
2 Departamentul de genetică umană, Școala de medicină David Geffen, Universitatea din California, Los Angeles, California
Lisa J. Martin
2 Departamentul de genetică umană, Școala de medicină David Geffen, Universitatea din California, Los Angeles, California
Richard C. Davis
1 Departamentul de Medicină, Școala de Medicină David Geffen, Universitatea din California, Los Angeles, California
Sherin U. Devaskar
3 Departamentul de Pediatrie, Școala de Medicină David Geffen, Universitatea din California, Los Angeles, California
Aldons J. Lusis
1 Departamentul de Medicină, Școala de Medicină David Geffen, Universitatea din California, Los Angeles, California
2 Departamentul de genetică umană, Școala de medicină David Geffen, Universitatea din California, Los Angeles, California
4 Departamentul de Microbiologie, Imunologie și Genetică Moleculară, Școala de Medicină David Geffen, Universitatea din California, Los Angeles, California
Cititorii pot folosi acest articol atâta timp cât lucrarea este citată în mod corespunzător, utilizarea este educativă și nu are scop lucrativ, iar lucrarea nu este modificată. Consultați http://creativecommons.org/licenses/by-nc-nd/3.0/ pentru detalii.
Date asociate
Abstract
OBIECTIV-Am examinat mecanismele materne pentru intoleranța la glucoză la debutul adulților, creșterea adipozității și ateroscleroza utilizând două modele de șoarece pentru restricția de creștere intrauterină (IUGR): restricția maternă a proteinelor și hipercolesterolemia.
PROIECTARE ȘI METODE DE CERCETARE—Pentru aceste studii, am măsurat nivelurile de aminoacizi din baraje de la două modele de șoareci pentru IUGR: 1) hrănirea barajelor C57BL/6J cu o dietă cu restricție de proteine și 2) hrănirea receptorului C57BL/6J LDL - baraje nule (LDLR -/-) a dietă bogată în grăsimi (occidentală).
REZULTATE—Ambele baraje cu restricție de proteine și hipercolesterolemice au prezentat concentrații semnificativ scăzute de aminoacizi esențiali fenilalanină și aminoacizi esențiali cu lanț ramificat, leucină, izoleucină și valină. Dieta cu restricție de proteine pentru femeile însărcinate a avut ca rezultat puieturi cu IUGR semnificativ. Descendenții masculi cu restricție de proteine au prezentat o creștere de recuperare cu vârsta de 8 săptămâni și au dezvoltat adipozitate crescută și intoleranță la glucoză cu vârsta de 32 de săptămâni. Barajele LDLR -/- însărcinate, care au urmat o dietă occidentală, au avut, de asemenea, litere cu IUGR semnificativ. LDLR masculin și feminin -/- descendenții din dieta occidentală au dezvoltat leziuni aterosclerotice semnificativ mai mari cu 90 de zile, comparativ cu descendenții din dieta chow.
CONCLUZII—În două modele de șoarece de IUGR, am găsit concentrații reduse de aminoacizi esențiali în barajele experimentale. Acest lucru a indicat faptul că mecanismele comune pot sta la baza efectelor fenotipice ale hipercolesterolemiei materne și ale restricției proteinelor materne asupra descendenților.
La om, malnutriția în timpul sarcinii duce la copii cu greutate mai mică la naștere și un risc crescut de mortalitate și morbiditate neonatală (1). Greutatea redusă la naștere este, de asemenea, asociată cu un risc crescut pentru anumite boli cronice, inclusiv diabetul de tip 2, bolile cardiovasculare și hipertensiunea (2-4). O explicație propusă care leagă greutatea scăzută la naștere de bolile cronice este ipoteza „fenotipului gospodar” Barker, care postulează că lipsa nutrienților adecvați în mediul intrauterin „programează” descendenții pentru supraviețuire într-o lume săracă în nutrienți. Rezultă că, dacă mediul postnatal real nu este sărac în nutrienți, ci în schimb bogat în nutrienți, căile metabolice vor fi „malprogramate”, ducând la apariția bolilor sindromului metabolic cu debut, inclusiv ateroscleroza și diabetul (5). O mulțime de dovezi susțin acum ipoteza Barker (6); prin urmare, cercetările actuale la om și la modele animale se concentrează pe mecanisme specifice pentru programarea in utero (4).
Deoarece restricția maternă a proteinelor și hipercolesterolemia creează ambele un mediu metabolic anormal, am emis ipoteza că poate exista o perturbare comună a căilor metabolice care afectează descendenții. Pentru a testa ipoteza, am folosit două modele de șoarece pentru condiții in utero care duc la IUGR, unul cu restricție de proteine și unul cu hipercolesterolemie. Am căutat apoi puncte comune în barajele experimentale pentru a identifica căile posibile pentru originile de dezvoltare ale bolilor sindromului metabolic. În ambele modele, barajele au scăzut nivelurile anumitor aminoacizi esențiali.
PROIECTAREA ȘI METODELE CERCETĂRII
Creșterea animalelor.
Acest studiu a fost aprobat de Comitetul de Cercetare a Animalelor UCLA și a fost realizat în conformitate cu liniile directoare ale Institutului Național de Sănătate pentru utilizarea animalelor experimentale. Șoarecii FVB/J, C57BL/6J (B6) și LDLR -/- pe fundal B6 au fost cumpărați de la Jackson Laboratories (Bar Harbor, ME).
Dietele.
Dieta cu conținut scăzut de proteine (D02041002; Dietele de cercetare) conținea 9% proteine în greutate, a fost izocalorică și a fost formulată pentru a se potrivi cu dietele cu conținut scăzut de proteine publicate anterior (26). În dieta cu conținut scăzut de proteine, conținutul de grăsimi a fost de 4,4%, iar carbohidrații au fost de 77% din greutate. Dieta cu proteine de control (dieta standard Chow TD 7013; Harlan Teklad) a fost utilizată pentru hrănirea barajelor proteice de control, a mamelor adoptive, a barajelor LDLR -/- Chow și a descendenților înțărcați din ambele experimente. Dieta cu proteine de control conținea 19% proteine, 6,2% grăsimi și 75% carbohidrați în greutate și a contribuit cu 18% kcal din grăsimi. Dieta occidentală (TD 88137; Harlan Teklad) conținea 42% kcal calorii din grăsimi și din greutate după cum urmează: 21% grăsimi, 17% proteine, 49% carbohidrați și 0,2% colesterol.
Studii de restricție a proteinelor.
Studii de hipercolesterolemie.
Analiza plasmatică a aminoacizilor materni.
Analiza plasmatică a aminoacizilor materni a fost efectuată prin cromatografie lichidă de înaltă performanță la Institutul de boli metabolice al Centrului Medical al Universității Baylor (http://www.baylorhealth.edu/imd/) (28). Acest experiment a fost repetat pentru a detecta posibile variații în analiza aminoacizilor. În primul studiu, barajelor li s-a permis să-și livreze puii și apoi li s-a administrat anestezie cu 2% izofluran înainte de exsanguinări retro-orbitale în decurs de 4 ore de la naștere. Acest timp post-sarcină a fost ales pentru a minimiza orice efect advers al exsanguinărilor asupra fătului și pentru a maximiza efectul diferitelor diete asupra mamelor. În cel de-al doilea studiu, s-au prelevat probe de sânge de la femele la 1-2 săptămâni după naștere, menținând în același timp aceeași dietă în care au fost în timpul sarcinii. Am observat tendințe similare în ambele experimente și, prin urmare, am combinat datele noastre din cele două studii.
Teste de toleranță la glucoză.
Testele de toleranță la glucoză au fost efectuate așa cum s-a descris anterior (29) la descendenții cu conținut scăzut de proteine și de control la vârsta de 126 de zile (4 luni) și 210 zile (7 luni). Șoarecii au fost cântăriți, rasi pe membrele posterioare și au postit peste noapte. A doua zi dimineață, glucoza de post a fost măsurată în sângele colectat din puncția venei safene, după care s-a administrat încărcare de glucoză de 2 mg/g intraperitoneal. Măsurătorile serice ale glicemiei s-au efectuat la intervale de 0,5 ore în următoarele 2 ore de la punctele venoase safene. Glucometrul One Touch Ultra (Lifescan) a fost utilizat pentru a măsura concentrațiile de glucoză din sânge integral (30).
Compozitia corpului.
Acest lucru a fost efectuat într-un scaner de rezonanță magnetică nucleară pentru rozătoare (Bruker Biospin, Billerica, MA) care a fost standardizat la un control intern furnizat de producător. Șoarecii au fost cântăriți individual pe o cântar și apoi plasați în scaner pentru măsurarea compoziției corpului, analizați ca procent de masă grasă (denumită și adipozitate), procent de masă musculară și procent de masă lichidă. Grăsimea corporală totală a fost calculată utilizând greutatea la scară a fiecărui șoarece în ziua respectivă.
Analiza lipidelor plasmatice.
Șoarecii au fost postiti peste noapte, iar sângele retro-orbital a fost colectat sub anestezie cu izofluran. Concentrațiile plasmatice totale de colesterol, HDL, colesterol neesterificat, trigliceride și concentrații de acizi grași liberi au fost determinate așa cum s-a descris anterior (31).
Analiza leziunii.
Șoarecii au fost uciși la 90 de zile, iar inima și aorta proximală au fost îndepărtate, încorporate în compusul OCT (Laboratoarele Miles) și depozitate la -70 ° C. Criosecțiuni în serie cu grosimea de 10 μm din porțiunea mijlocie a ventriculului stâng și arcada aortică au fost colectate și montate pe plăci acoperite cu poli-d-lisină. Secțiunile au fost colorate cu ulei colorat cu lipide roșu O și hematoxilină. Zonele colorate cu lipide au fost vizualizate la microscopul cu lumină și numărate manual de un observator orbit. Scorurile au fost determinate așa cum s-a descris anterior (32).
Analiza datelor.
Toate valorile sunt exprimate ca medii ± SE. O greutate medie a așternutului a fost utilizată pentru a compara greutățile la naștere în modelul IUGR de restricție a proteinelor. Acest lucru a fost făcut pentru a evita o eroare de tip 1, deoarece numărul real de pui nou-născuți a fost foarte mare și pentru a minimiza efectul diferențelor în interiorul așternutului. Modelul ANOVA cu două căi a fost utilizat pentru a compara simultan variabile independente în două grupuri pentru a evalua efectul sexului și al mediului matern asupra descendenților. În LDLR -/- litters, dimensiunile așternuturilor și greutățile în interiorul așternuturilor nu au variat semnificativ (6-7 pui pe așternut) și, prin urmare, au fost calculate în medie greutățile individuale ale puilor. Valorile P pentru toate comparațiile de grup au fost atribuite folosind corecția diferenței protejate cel mai puțin semnificativ protejată de Fisher. ANOVA unidirecțională a fost utilizată atunci când au fost efectuate comparații la un singur sex. Software-ul Statview versiunea 5.0 a fost utilizat pentru analiză.
REZULTATE
Model de șoarece cu restricție de proteine pentru IUGR.
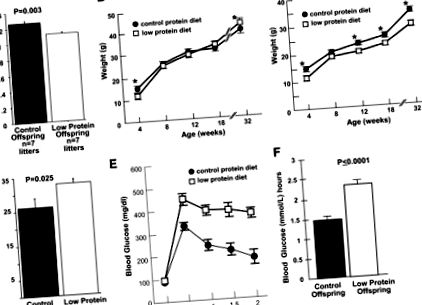
Restricția creșterii in utero a fost asociată cu subnutriția în timpul sarcinii, ducând la tulburări metabolice cu debut la adulți. Pentru a dezvolta un model de șoarece de IUGR, am hrănit femelele C57BL/6J cu o dietă săracă în proteine începând cu ziua 0 de gestație. Apoi am livrat pui de la barajele de control și protejate cu bară prin cezariană în ziua de gestație 19 și am fost încrucișați la barajele de asistență FVB/J pe o dietă chow. Ponderile medii la nașterea deșeurilor a puietului cu restricție proteică au fost semnificativ mai mici decât martorii (P = 0,003) (Fig. 1A). Greutățile masculine cu conținut scăzut de proteine și de control nu au fost semnificativ diferite începând cu vârsta de 8 săptămâni (Fig. 1B), iar la 32 de săptămâni, greutățile descendenților masculi cu conținut scăzut de proteine au fost semnificativ mai mari decât martorii (P ≤ 0,05) (Fig. 1B). În schimb, descendenții feminini cu conținut scăzut de proteine au prezentat restricții semnificative de creștere în comparație cu martorii până când au fost uciși la vârsta de 32 de săptămâni (Fig. 1C).
Caracterizarea descendenților de la puietul martor și proteine cu restricție. A: Greutăți medii la naștere a așternutului de 9% deșeuri cu diete cu conținut scăzut de proteine, comparativ cu 19% deșeuri de proteine de control, P = 0,003. B: Curba de creștere a descendenților masculi cu vârsta cuprinsă între 4 și 32 de săptămâni. * Greutățile au fost semnificativ diferite la nivelul P ≤ 0,05 la 4 și 32 de săptămâni. C: Restricție persistentă a creșterii la descendenții cu restricție proteică feminină, cu vârsta cuprinsă între 4 și 32 de săptămâni. * Valori semnificativ diferite la nivelul P ≤ 0,05. D: Adipozitate crescută la descendenții masculi cu conținut scăzut de proteine la vârsta de 32 de săptămâni, P = 0,025. E: Intoleranță la glucoză la descendenții masculi cu conținut scăzut de proteine. Concentrațiile de glucoză din sânge ale descendenților cu restricție proteică masculină după administrarea unei provocări intraperitoneale standard de 2 mg/g greutate corporală (greutate) glucoză. n = 12, 9, 9, 9 și 8 pentru descendenții de control; și n = 14, 13, 13, 10 și 9 pentru descendenții cu restricție proteică la momentul 0, 0,5, 1, 1,5 și respectiv 2 ore. F: Zona sub curbă (ASC) pentru descendenții masculi cu restricție de proteine după administrarea unei încărcări standard de glucoză intraperitoneală.
Descendenții masculi cu conținut scăzut de proteine au prezentat greutate crescută, adipozitate și intoleranță la glucoză.
Descendenții masculi cu conținut scăzut de proteine au avut o adipozitate semnificativ mai mare (P = 0,025) la vârsta de 32 de săptămâni, comparativ cu martorii (Fig. 1D). Adipozitatea la descendenții feminini cu conținut scăzut de proteine la vârsta de 32 de săptămâni nu a diferit semnificativ de martori (datele nu sunt prezentate). La 32 de săptămâni (dar nu la 18 săptămâni; datele nu sunt prezentate), descendenții masculi cu conținut scăzut de proteine au demonstrat concentrații semnificativ mai mari de glucoză în sânge după o provocare a glucozei (Fig. 1E) și o semnificativ mai mare (P Fig. 1F) comparativ cu martorii. Concentrațiile inițiale de glucoză și răspunsul la o sarcină de glucoză nu au fost semnificativ diferite între descendenții feminini cu conținut scăzut de proteine și martorii la vârsta de 32 de săptămâni (datele nu sunt prezentate). Atât la descendenții masculini, cât și la cei feminini, nu au existat diferențe semnificative între nivelul scăzut de proteine și cel de control pentru colesterolul total, colesterolul neesterificat, trigliceridele, acizii grași liberi sau colesterolul HDL din plasmă (datele nu sunt prezentate).
Efectul mediului fetal hipercolesterolemic asupra descendenților adulți.
Caracterizarea LDLR -/- control și a descendenților din dieta occidentală la naștere și la vârsta de 90 de zile. A: Concentrațiile plasmatice totale înaintea sarcinii de LDLR -/- femele în dietele chow și occidentale. B: Greutatea la naștere a descendenților din barajele LDLR -/- din dieta occidentală comparativ cu martorii, P = 0,02. C: Greutate corporală mai mică a descendenților din dieta occidentală la vârsta de 90 de zile comparativ cu martorii, P = 0,05. D: lungimea nasului până la coadă la descendenții occidentali, P = 0,0004 pentru efectul colesterolului matern atât la descendenții masculini, cât și la cei feminini. E: Greutatea tamponului de grăsime gonadală normalizată în funcție de greutatea corporală, P = 0,04 pentru efectul colesterolului matern la descendenții masculi și feminini. F: Dimensiunea leziunii aterosclerotice a aortei proximale la vârsta de 90 de zile, P = 0,02 pentru efectul colesterolului matern atât la bărbați, cât și la femei. G: Leziuni reprezentative la vârsta de 90 de zile la descendenții LDLR -/- expuși la hipercolesterolemie maternă. 1, întreaga secțiune aortică proximală; 2, o leziune mărită. (Vă rugăm să consultați http://dx.doi.org/10.2337/db07-1530 pentru o reprezentare digitală de înaltă calitate a acestei figuri.)
La vârsta de 90 de zile, descendenții din dieta occidentală au scăzut semnificativ greutatea (P ≤ 0,05) și lungimea (P = 0,0004) comparativ cu martorii (Fig. 2C și D). Descendenții din dieta occidentală au avut un raport semnificativ mai scăzut (P = 0,04) de grăsime gonadică - raport cu greutatea corporală decât martorii, iar bărbații au avut raporturi semnificativ mai mari decât femelele (P = 0,0001) (Fig. 2E). Descendenții LDLR -/- din dieta occidentală au avut leziuni aterosclerotice semnificativ mai mari decât martorii (P = 0,002) (Fig. 2F). O secțiune reprezentativă a aortei cu leziunile [1) întreaga secțiune și 2) o leziune] observată la vârsta de 90 de zile este prezentată în Fig. 2G. Bărbații și femelele nu au prezentat nicio diferență semnificativă în dimensiunea leziunii. Morfologia și compoziția celulară a leziunilor (macrofage vs. celule musculare netede) nu au fost diferite între grupuri (datele nu sunt prezentate). Nu s-au găsit diferențe semnificative în lipidele plasmatice ale descendenților, inclusiv acizii grași liberi, trigliceridele, colesterolul total, colesterolul neesterificat și colesterolul HDL (datele nu sunt prezentate).
Scăderea nivelului de aminoacizi plasmatici materne atât la barajele cu conținut scăzut de proteine, cât și la cele hipercolesterolemice.
Hipoaminoacidemia la barajele cu restricție de proteine și hipercolesterolemice. A: Concentrațiile plasmatice de uree și aminoacizi la baraje pe o dietă de control proteic de 23% (n = 8; □) și 9% dietă cu conținut scăzut de proteine (n = 3; ▪) și în barajele LDLR -/- pe o dietă occidentală ( n = 11; ▪) și controlați dieta chow (n = 9; (). * Șoarecii P -/- care sunt sensibili la ateroscleroză pentru a induce caracteristici cauzate de IUGR care pot contribui la ateroscleroză. Descendenții barajelor LDLR -/- hrănite cu o dietă occidentală în studiul nostru au avut greutăți la naștere mai mici și leziuni aterosclerotice mai severe decât martorii la vârsta de 90 de zile. De o importanță deosebită, atât barajele cu restricție proteică, cât și barajele hipercolesterolemice au avut concentrații plasmatice scăzute ale mai multor aminoacizi esențiali.
Modelele IUGR din studiul nostru au diferit în câteva domenii cheie. În primul rând, o diferență de sex în creșterea în greutate și intoleranța la glucoză a fost observată în modelul cu proteine scăzute. Bărbații, dar nu și femeile, au prins în greutate pentru a controla descendenții până la vârsta de opt săptămâni și au dezvoltat intoleranță la glucoză până la vârsta de 32 de săptămâni. Această diferență de sex a fost găsită în alte modele de șoareci, inclusiv o investigație recentă a șoarecilor heterozigoți GLUT3-nuli (30). De asemenea, într-un model de șoarece transgenic al regulatorului exprimat hipotalamic pentru aportul de alimente, receptorul 1 al neuropeptidei Y, a fost observat un efect sexual. Bărbații transgenici NPYR1, dar nu și femeile, au câștigat excesul de greutate pe o dietă bogată în grăsimi și au slăbit cu administrarea de leptină (38). Astfel, diferența de sex pe care am văzut-o în ceea ce privește creșterea în greutate, adipozitatea și toleranța la glucoză în grupul cu conținut scăzut de proteine este în concordanță cu alte constatări și indică participarea probabilă a sistemului endocrin la etiologia acestor trăsături.
Devine din ce în ce mai evident că celulele embrionare și fetale au un sistem complex care integrează semnalele nutriționale din mediul lor pentru a maximiza potențialul de supraviețuire. Asocierea malnutriției materne și a IUGR care duce la tulburări metabolice la debutul adulților, cum ar fi obezitatea, diabetul de tip 2 și ateroscleroza, a fost demonstrată în mai multe studii epidemiologice (2,49-51). Rezultatele noastre au imitat studiile populației la oameni în care malnutriția maternă și greutatea redusă rezultată la naștere au fost identificați ca factori de risc frecvenți pentru bolile cu debut la adulți. În plus, studiile noastre au demonstrat că restricția maternă a proteinelor și hipercolesterolemia au fost ambele asociate cu hipoaminoacidemia maternă. Prin urmare, hipoaminoacidemia maternă poate fi un antecedent important în ambele modele de IUGR și poate fi o verigă importantă în mecanismele care contribuie la intoleranța la glucoză la debutul adultului, obezitatea și ateroscleroza.
- Dieta cu conținut scăzut de grăsimi cu acizi grași omega-3 crește concentrația plasmatică a factorului de creștere asemănător insulinei
- Grăsimea interesterificată sau uleiul de palmier ca înlocuitori ai grăsimilor parțial hidrogenate din dieta maternă pot
- Este o dietă cu conținut scăzut de proteine sănătoasă aici; Ce consideră bine dieteticienii
- Dieta cu conținut scăzut de proteine și progresia degenerescenței retiniene în atrofia girat a coroidei și
- Dieta maternă în timpul sarcinii și concentrațiile sanguine de cadmiu într - o cohortă observațională de