Abstract
Introducere
Coccinelidele sunt un grup eterogen de insecte împărțit în trei categorii majore în funcție de preferințele lor alimentare: zoofage (predatoare), fitofage (consum de plante) și micofage (consum de ciuperci) (Giorgi et al. 2009). Gărgărițele prădătoare au evoluat din gărgărițele micofage care au fost adaptate mai întâi pentru a se hrăni cu mucegaiuri de funingine, dar apoi au acceptat insectele care produc mieră, cum ar fi afidele (Leschen 2000). Majoritatea cocoșelor prădătoare se hrănesc cu insecte producătoare de miere din subordinul hemipterian Sternorrhyncha, de care au nevoie pentru a finaliza dezvoltarea. Până în prezent, nu există specii de coccinelide pentru care să se cunoască în întregime lățimea alimentară completă (Weber și Lundgren 2009).
Speciile de coccinelide entomofage consumă în mod regulat alimente care nu sunt pradă, cum ar fi polenul și nectarul (Togni și colab. 2016), mierea și părțile plantelor (Giorgi și colab. 2009) și fructe și ciuperci (Triltsch 1997). Aceste tipuri de alimente reprezintă o componentă importantă a dietelor pentru multe cucine ca o sursă suplimentară de energie și deseori necesare pentru dezvoltare (Lundgren 2009a). Analizele conținutului intestinal au arătat că sporii fungici pot fi preluați de, de exemplu., Coccinella septempunctata, și chiar să fie mai frecvent prezenți decât părțile corpului pradă, în special la o abundență scăzută de afide (Triltsch 1999). Putman (1964) a sugerat că mâncarea pe sporii fungici până la C. septempunctata se întâmplă pe deplin accidental, dar conform Sutherland și Parrella (2009), sporii fungici pot fi hrană sezonieră importantă pentru cocoșele. Importanța prezenței acestui tip de hrană care nu este pradă în dieta pentru gărgărițe și impactul asupra comportamentului lor de hrănire sunt slab înțelese.
Coccinelidele entomofage utilizează în mod activ indiciile olfactive asociate cu mirosul prăzii (Francis și colab. 2004), plantele infestate cu afide (Ninkovic și colab. 2001; Togni și colab. 2016) sau combinația ambelor (Jamal și Brown 2001). Gărgărițele micofage au arătat o preferință puternică față de mirosurile caracteristice eliberate de plantele de dovleac infectate cu făinare, arătând că astfel de indicii pot juca un rol important în comportamentul de hrănire a gărgărițelor (Tabata și colab. 2011). Sursele alimentare care nu sunt pradă, cum ar fi ciupercile, sunt componente ale dietelor coccinelide entomofage, dar încă nu știm aproape nimic despre modul în care localizează plantele infectate. Detectarea și localizarea alimentelor neesențiale, cum ar fi ciupercile, pot fi accidentale sau mediate de mirosurile asociate plantelor infectate cu ciuperci.
A explora C. septempunctata căutând făinarea, am testat răspunsul lor la mirosurile de la plantele de orz infectate și neinfectate folosind un olfactometru cu două brațe. Am investigat, de asemenea, dacă făinarea ar constitui o dietă adecvată pentru cocoșele și dacă o consumă ca un singur aliment sau în combinație cu Rhopalosiphum padi.
Materiale și metode
Făinarea
Un izolat de mucegai praf, Blumeria graminis f. sp. hordei (Bgh), a fost obținut de la Lantmännen SW Seed AB, Svalöv, Suedia. Pentru propagarea făinării, s-a utilizat soiul de orz foarte sensibil (cv.) Steffi. Plantele au fost cultivate într-o seră și menținute la 18-22 ° C cu un regim ușor de L16: D8. Zece plante per ghiveci (Ø 12 cm, înălțime 9 cm) au fost cultivate în sol de ghiveci (grădina Special Hasselfors, Hasselfors, Suedia). Plante de orz infectate cu 7 zile mai devreme cu B. graminis au fost folosite pentru inocularea plantelor vechi de 10 zile (a doua frunză începe să se dezvolte) cu B. graminis prin agitarea plantelor infestate deasupra plantelor sănătoase. Plantele infectate au fost acoperite cu cilindri din plexiglas (Ø 10 cm, înălțime 32,8 cm, grosime 2 mm) închise în partea superioară de un pătrat de pâslă și o bandă de cauciuc. Plantele au fost incubate într-o cameră climatică la 18-22 ° C cu un regim ușor de L16: D8 și umiditate relativă 70% timp de 5-7 zile, până la formarea de noi leziuni sporulante de făinare pe frunze.
Insecte
Gărgăriță cu șapte pete, Coccinella septempunctata, adulții au fost colectați din habitate naturale din apropiere de Uppsala, Suedia (59 ° 47′00.0 ″ N, 17 ° 39′00.0 ″ E) și crescuți cu cel puțin cinci generații înainte de a fi utilizați în experimente. Gărgărițele au fost crescute în cuști (40 × 40 × 80 cm). S-au hrănit cu o dietă mixtă formată din afide de cireș-ovăz de pasăre (Rhopalosiphum padi), afide de piersici verzi (Myzus persicae), afide de mazăre (Acyrthosiphon pisum) și polenul muștarului alb înflorit (Sinapis alba). Afidele au fost crescute pe plante gazdă specifice; R. padi pe orz (Hordeum vulgare), M. persicae pe semințe de rapiță (Brassica napus), și A. pisum pe fasole (Vicia faba). Gărgărițele au fost crescute în aceleași condiții ca și plantele de testare. Adulții din experimente au avut 3-4 săptămâni. Rhopalosiphum padi utilizate în experimente au fost crescute pe cv de ovăz în ghiveci. Belinda în aceleași condiții de creștere ca și plantele infectate, dar într-o cameră separată.
Plante infestate de afide și infectate cu făinare
Orz cv. Annabell a fost utilizat în experimente, deoarece s-a observat că are o apariție ridicată de cocoșe atunci când este infectat cu făinare în câmp. Zece plante per ghiveci în stadiul cu două frunze au fost infestate cu R. padi (20 de afide pe plantă). La șapte zile după infestare, când numărul de afide pe plantă era în jur de 100, plantele au fost folosite pentru bioanalize.
Plantele infectate cu mucegaiul praf au fost obținute prin infectarea plantelor de orz în stadiul cu două frunze prin agitarea plantelor infectate deasupra plantelor sănătoase. La șapte zile după inoculare, când leziunile erau vizibile, plantele au fost exploatate pentru experimente.
Plantele tratate atât cu afide, cât și cu mucegaiul au fost obținute prin eliberarea a 20 de afide pe plantă pe plantele care au fost infectate cu mucegaiul cu o zi înainte. Șapte zile mai târziu, plantele au fost utilizate în bioanalize. Fiecare ghiveci cu zece plante (tratate sau martor) a fost plasat într-un cilindru din plexiglas (Ø 6,8 cm, înălțime 32,8 cm, grosime 2 mm) și partea superioară a cilindrului a fost sigilată cu un pătrat de pânză rezistentă la mucegai și strânsă cu o bandă de cauciuc.
Bioanaliza olfactometrului
Răspunsurile olfactive ale adulților de gărgăriță au fost măsurate folosind un olfactometru cu flux de aer bidirecțional format din două zone de stimul (brațe) direct opuse una cu cealaltă, cu o zonă neutră centrală care le separă (Ninkovic și colab. 2001). Aerul a fost extras din centrul olfactometrului folosind o pompă de vid, stabilind curenți de aer discret în brațele laterale. Debitul de aer din olfactometru a fost setat la 180 ml/min, măsurat cu un debitmetru la intrările brațului. Fiecare braț al olfactometrului a fost conectat la o cușcă care conține plantele. Au fost stabilite trei aranjamente diferite (1) orz infestat de R. padi într-o cușcă versus plante sănătoase de orz într-o altă cușcă, (2) orz infectat cu mucegai versus plante sănătoase de orz și (3) orz infectat cu mucegai pudrat versus orz infestat de R. padi. O singură gărgăriță, aleasă la întâmplare fără determinarea sexului, a fost introdusă în olfactometru și după o perioadă de adaptare de 10 min, poziția sa a fost înregistrată la fiecare 2 minute pe o perioadă de 20 de minute. Numărul de persoane testate pe combinație a variat de la 21 la 23. Coccinelele rămase imobile mai mult de 10 minute au fost aruncate. Fiecare buburuză a fost testată o singură dată. După fiecare individ testat, olfactometrul a fost curățat folosind 70% etanol.
Test de supraviețuire a gărgăriței
Efectul dietelor asupra supraviețuirii gărgăriței a fost investigat în patru tratamente diferite: (1) plante infectate cu făinare, (2) plante infestate cu R. padi, (3) plante atât infectate cu făinare, cât și infestate cu R. padi, și (4) controlul plantelor fără afide sau făinare. După 7 zile de tratament, a fost introdusă câte o gărgăriță în fiecare cilindru. Gărgărițele au avut acces la apă printr-un dop de vată conectat la apă într-un recipient mic plasat lângă plantă. În fiecare a treia zi, am înregistrat gărgărițe vii sau moarte într-o perioadă experimentală de 15 zile. Gărgărițele moarte au fost colectate la fiecare observație și introduse - 20 ° C. Coccinele încă în viață în ziua 15 au fost, de asemenea, introduse - 20 ° C. Toate cocoșele au fost ținute acolo până la analiza ADN a conținutului intestinal.
Extracția ADN și PCR
Intestinele izolate au fost plasate în tuburi Eppendorf, congelate rapid cu azot lichid și omogenizate cu un pistil steril. ADN-ul total a fost extras de un robot automat de extracție Qiacube (Qiagen) folosind mini kitul QIAamp DNA (Qiagen). PCR în 25 de reacții reacții s-a efectuat cu margele de PCR Illustra PuReTaq Ready-To-Go (GE Healthcare, Uppsala, Suedia) conform Chen și colab. (2015) folosind grunduri pentru B. graminis BF-F1 (5'-AAGCTATGCGGAACTTCGTTT-3 ') și BF-R (5'-TTAGGAGTTTTGGCAAGTCCC-3'). Programul PCR a fost după cum urmează: 94 ° C timp de 5 min, urmat de 35 de cicluri de [94 ° C timp de 50 s, 68 ° C timp de 50 s, 72 ° C timp de 50 s] urmat de o etapă finală de extensie la 72 ° C timp de 10 min. Produsele de amplificare au fost secvențiate la Macrogen (Coreea de Sud). Tripa izolată a 17 gărgărițe a fost extrasă individual de ADN și analizată prin PCR pentru prezența B. graminis.
Analize statistice
Numărul de vizite la unul sau alt braț al olfactometrului a fost comparat utilizând testele de perechi potrivite Wilcoxon din pachetul statistic SAS software-ul Dell Statistica (2015). Datele de supraviețuire au fost analizate folosind abordarea non-parametrică a analizei supraviețuirii propusă de Kaplan și Meier (1958). A fost utilizată procedura de testare a vieții a pachetului SAS (2014). Concluziile s-au bazat pe testul Log-rank. Comparațiile pe perechi au fost ajustate pentru multiplicitate utilizând metoda Bonferroni. Testele care compară supraviețuirea la fiecare punct de timp au fost efectuate ca teste Chi-pătrat exacte, adică teste Chi-pătrat în care valoarea p a fost calculată utilizând o abordare a testului de randomizare, similar cu testul exact al lui Fisher.
Rezultate
Răspunsurile olfactive ale gărzii
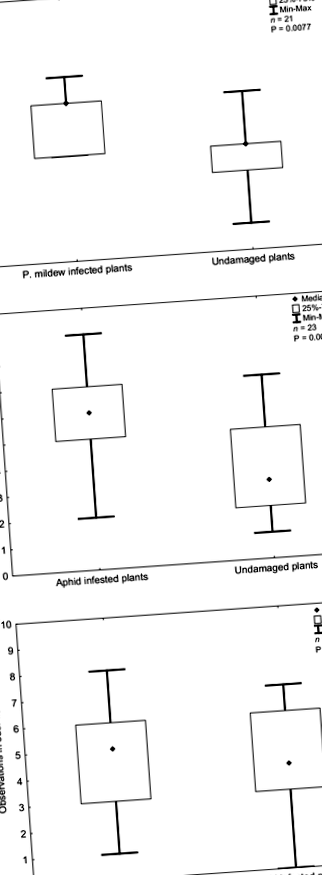
Mirosurile eliberate din plantele stresate (infectate cu mucegai sau infestate cu afide) au influențat răspunsurile olfactive ale C. septempunctata (Fig. 1). Mirosurile plantelor infectate cu mucegaiul praf au evocat un răspuns comportamental pozitiv al cucerinelor comparativ cu mirosul controalelor neinfectate (testul Wilcoxon: Z = 2.663, P = 0,0077, n = 21; FIG. 1a). Mirosul de R. padi plantele infestate au evocat, de asemenea, un răspuns comportamental pozitiv al cucerinelor, comparativ cu mirosurile eliberate de la plantele neinfestate (testul Wilcoxon: Z = 2,84, P = 0,0045, n = 23; FIG. 1b). Nu a existat nicio diferență în răspunsurile olfactive ale gărgăriței atunci când au avut de ales între mirosul plantelor de orz infectate cu mucegaiul și infestate cu afide (testul Wilcoxon: Z = 0,243, P = 0,807, n = 22; FIG. 1c).
Răspunsuri olfactive ale cocoșelor, Coccinella septempunctata, la diferite surse de miros: A plantele infectate cu mucegaiul și plantele nedeteriorate ca control, b plantele infectate cu afide și plantele nedeteriorate ca control și c plantele infectate cu mucegaiul și plantele infestate cu afide. Complotele cu cutii și mustăți reprezintă numărul cumulat de vizite în zona brațului după zece observații. Fiecare casetă include 50% din mijlocul datelor; simbolul punct indică valoarea mediană. Mustățile (liniile verticale) indică un număr minim sau maxim de vizite ale unei insecte testate; n numărul de insecte testate, P probabilitatea calculată prin testul perechilor potrivite Wilcoxon
Supraviețuirea gărgăriței
Detectarea mucegaiului sub formă de pudră în intestine
PCR a fost utilizată pentru a detecta prezența mucegaiului în budele de gărgărițe după diferite diete. Toate cocoșele care se hrăneau exclusiv cu mucegaiul au avut produse PCR de dimensiunea corespunzătoare B. graminis. De asemenea, unul dintre cele cinci controale de înfometare a indicat prezența făinării. Toate aceste produse PCR au fost trimise pentru secvențial, confirmând că aparțin făinării. În schimb, nu s-au obținut produse PCR pentru gărgărițele hrănite exclusiv cu afide, în timp ce un singur produs slab PCR a fost observat pentru o gărgăriță care avea acces atât la făinare cât și la afide (Tabelul 1).
Discuţie
Luate împreună, datele din acest studiu și observațiile făcute pe teren, arată că mirosurile eliberate din plantele stresate pot atrage gărgărițele în habitate cu prezența atât a alimentelor neesențiale, cât și a alimentelor esențiale. Un astfel de comportament de hrănire sugerează că gărgărițele aleg un loc de hrănire cu hrană diversificată care le poate crește rata de supraviețuire printr-o dietă echilibrată.
Referințe
Chen S, Cao YY, Li TY, Wu XX (2015) Detecția simultană a trei specii fungice patogene de grâu prin PCR multiplex. Phytoparasitica 43: 449–460. https://doi.org/10.1007/s12600-014-0442-1
de Vos M, Jander G (2010) Comunicare volatilă în interacțiunile plante-afide. Curr Opin Plant Biol 13: 366–371. https://doi.org/10.1016/j.pbi.2010.05.001
Dell Inc (2015) Dell Statistics, versiunea 13.dell.com
Dicke M, Baldwin IT (2010) Contextul evolutiv pentru volatile plantelor induse de erbivori: dincolo de „strigătul de ajutor”. Trends Plant Sci 15: 167–175. https://doi.org/10.1016/j.tplants.2009.12.002
Francis F, Lognay G, Haubruge E (2004) Răspunsuri olfactive la afide și la gazdele eliberate de plante volatile: (E) -β-Farnesene un kairomon eficient pentru prădător Adalia bipunctata. J Chem Ecol 30: 741-755. https://doi.org/10.1023/B:JOEC.0000028429.13413.a2
Gencer NS, Kumral NA, Seidi M, Pehlevan B (2017) Răspunsurile de atracție ale gândacului de gărgăriță Hippodamia variegata (Goeze, 1777) (Coleoptera: Coccinellidae) la un amestec unic și binar de plante volatile din plante sintetice induse de erbivore în teste de laborator. Turk J Entomol 41: 17–26. https://doi.org/10.16970/ted.05956
Giorgi JA, Vanderberg NV, McHugh JV, Forrester JA, Slipinski SA, Miller KB, Shapiro LR, Whiting MF (2009) Evoluția preferințelor alimentare la Coccinellidae. Biol Control 52: 215–231. https://doi.org/10.1016/j.biocontrol.2009.05.019
Jamal E, Brown GC (2001) Orientare a Hipodamia convergens (Coleoptera: Coccinellidae) larve la substanțe chimice volatile asociate cu Myzus nicotianae (Homoptera: Aphidiidae). Environ Entomol 30: 1012-1016. https://doi.org/10.1603/0046-225X-30.6.1012
Kaplan EL, Meier P (1958) Estimare neparametrică din observații incomplete. J Am Stat Assoc 53: 457-481. https://doi.org/10.2307/2281868
Leschen RAB (2000) Gândacii care se hrănesc cu bug-uri (Coleoptera, Hemiptera). Schimbări repetate de la strămoșii micofagi. Taxonul Invertebr 14: 917–929. https://doi.org/10.1071/IT00025
Li YY, Zhou XR, Pang BP, Han HB, Yan F (2013) Răspunsuri comportamentale ale Hippodamia variegata (Coleoptera: Coccinellidae) la volatile de la plante infestate de Aphis gossypii (Hemiptera: Aphidae) și analiza componentelor volatile. Acta Entomol Sin 56: 153-160
Lundgren JG (2009a) Aspecte nutriționale ale alimentelor fără pradă în istoricul de viață al Coccinellidae predacee. Biol Control 51: 294-305. https://doi.org/10.1016/j.biocontrol.2009.05.016
Lundgren JG (2009b) Relația dușmanilor naturali și a alimentelor care nu sunt pradă. Springer, Dordrecht. https://doi.org/10.1007/978-1-4020-9235-0
Ninkovic V, Al Abassi S, Pettersson J (2001) Influența volatilelor plantelor induse de afide asupra comportamentului de căutare a gândacilor. Biol Control 21: 191–195. https://doi.org/10.1006/bcon.2001.0935
Ninkovic V, Al Abassi S, Ahmed E, Glinwood R, Pettersson J (2011) Efectul amestecului genotipului plantelor din specii asupra preferinței de habitat a unui prădător de insecte polifage. Oecologia 166: 391–400. https://doi.org/10.1007/s00442-010-1839-2
Ninkovic V, Dahlin I, Vucetic A, Petrovic-Obradovic O, Glinwood R, Webster B (2013) Schimb volatil între plante nedeteriorate - un nou mecanism care afectează orientarea insectelor în intercultură. PLoS ONE 8: e69431. https://doi.org/10.1371/journal.pone.0069431
Putman WL (1964) Apariția și hrana unor coccinelide (Coleoptera) în livezile de piersici din Ontario. Can Entomol 96: 1149–1155. https://doi.org/10.4039/Ent961149-9
SAS (2014) Pachet SAS Institute Inc. Ghidul utilizatorului SAS/Stat. Versiunea 9.4. SAS Institute Inc, Cary
Sherratt TN, Speed MP, Ruxton GD (2004) Selecție naturală asupra speciilor neplăcute impuse de comportamentul de hrănire dependent de stat. J Theor Biol 228: 217-226. https://doi.org/10.1016/j.jtbi.2003.12.009
Sutherland AM, Parrella MP (2009) Micofagie în Coccinellidae: revizuire și sinteză. Biol Control 51: 284–293. https://doi.org/10.1016/j.biocontrol.2009.05.012
Tabata J, De Moraes CM, Mescher MC (2011) Indiciile olfactive de la plante infectate cu mucegaiul ghid de hrănire de către un gândac micophagous ladybird. PLoS ONE 6: e23799. https://doi.org/10.1371/journal.pone.0023799
Togni PHB, Venzon M, Muniz CA, Martins EF, Pallini A, Sujii ER (2016) Mecanisme care stau la baza atracției înnăscute a unui coccinelid afidofag la plantele de coriandru: implicații pentru controlul biologic al conservării. Biol Control 92: 77-84. https://doi.org/10.1016/j.biocontrol.2015.10.002
Triltsch H (1997) Conținutul intestinal în adulți eșantionați în câmp Coccinella septempunctata (Col. Coccinellidae). Entomophaga 42: 125–131. https://doi.org/10.1007/BF02769889
Triltsch H (1999) Mâncarea rămâne în curajul Coccinella septempunctata (Coleoptera: Coccinellidae) adulți și larve. Eur J Entomol 96: 355–364
Waldbauer GP, Friedman S (1991) Auto-selecție a dietelor optime de către insecte. Annu Rev Entomol 36: 43–63
Weber DC, Lundgren JG (2009) Evaluarea ecologiei trofice a Coccinellidae: rolurile lor ca prădători și ca pradă. Biol Control 51: 199–214. https://doi.org/10.1016/j.biocontrol.2009.05.013
Mulțumiri
Acest studiu este dedicat regretatului profesor Jan Pettersson, pentru bunătatea sa, sprijinul științific fără sfârșit și altruismul său, care va fi întotdeauna amintit. Studiul a fost susținut financiar de Consiliul suedez de cercetare pentru mediu (FORMAS) (numărul proiectului 2014-225) și de Ministerul Educației, Științei și Dezvoltării Tehnologice din Republica Serbia (Numărul proiectului III 46008) și de Carl Tryggers Stiftelse pentru Vetenskaplig Forskning (numărul proiectului 12: 333). Mulțumim cu recunoștință profesorului Ulf Olsson pentru sprijin statistic și Dr. Dimitrije Markovic pentru comentarii valoroase.
Informatia autorului
Afilieri
Facultatea de Agricultură, Universitatea din Belgrad, Zemun-Belgrad, Serbia
Departamentul de biologie celulară și moleculară, Universitatea Uppsala, Uppsala, Suedia
Departamentul de ecologie, Universitatea suedeză de științe agricole, caseta 7044, 750 07, Uppsala, Suedia
Andja Radonjic, Olle Terenius și Velemir Ninkovic
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Puteți căuta acest autor și în PubMed Google Scholar
Contribuții
AR și VN au conceput și proiectat studiul; AR a efectuat experimente; VN a efectuat analize statistice ale datelor; AR și VN au elaborat manuscrisul; OT a efectuat analize ADN; VN și OT au finalizat manuscrisul. Toți autorii au citit și au aprobat lucrarea.
- Efectele micului dejun asupra comportamentului și performanței academice la copii și adolescenți
- Survival Save the Children International
- Resurse de supraviețuire; Ciupercile nu sunt pentru supraviețuire
- Ce părere aveți despre acest comportament pentru hrana pentru câini; Sănătate
- Acesta este modul în care stresul afectează rozaceea; Riversol