Irina V. Saltykova
un Laborator Central de Cercetare Universitatea de Stat din Siberia, 2 Moskovsky trakt, Tomsk, 634050, Tomsk, Federația Rusă
b Laborator de cercetări catalitice, str. Arkadiya Ivanova 49, 634050, Tomsk, Universitatea de Stat din Tomsk, Federația Rusă
c Centrul de cercetare pentru bolile neglijate ale sărăciei, Departamentul de Microbiologie, Imunologie și Medicină Tropicală, Școala de Medicină și Științe ale Sănătății, Universitatea George Washington, Ross Hall, 2300 I Street, NW, Washington, DC 20037 SUA
Ludmilla M. Ogorodova
un Laborator Central de Cercetare Universitatea de Stat din Siberia, 2 Moskovsky trakt, Tomsk, 634050, Tomsk, Federația Rusă
Vladimir V. Ivanov
un Laborator Central de Cercetare Universitatea de Stat din Siberia, 2 Moskovsky trakt, Tomsk, 634050, Tomsk, Federația Rusă
Alexander O. Bogdanov
un Laborator Central de Cercetare Universitatea de Stat din Siberia, 2 Moskovsky trakt, Tomsk, 634050, Tomsk, Federația Rusă
Elena A. Gereng
un Laborator Central de Cercetare Universitatea de Stat din Siberia, 2 Moskovsky trakt, Tomsk, 634050, Tomsk, Federația Rusă
Екатерина.А. Perina
un Laborator Central de Cercetare Universitatea de Stat din Siberia, 2 Moskovsky trakt, Tomsk, 634050, Tomsk, Federația Rusă
Paul J. Brindley
c Centrul de cercetare pentru bolile neglijate ale sărăciei, Departamentul de Microbiologie, Imunologie și Medicină Tropicală, Școala de Medicină și Științe ale Sănătății, Universitatea George Washington, Ross Hall, 2300 I Street, NW, Washington, DC 20037 SUA
Alexsey E. Sazonov
un Laborator Central de Cercetare Universitatea de Stat din Siberia, 2 Moskovsky trakt, Tomsk, 634050, Tomsk, Federația Rusă
d Lomonosov Universitatea de Stat din Moscova, 1 Leninskie Gory, Moscova, 119991, Federația Rusă
Date asociate
Abstract
Abstract grafic
1. Introducere
Opisthorchis felineus și O. viverrini sunt strâns înrudite trematode digenee zoonotice, care infectează pe oameni și diverse alte mamifere care mănâncă pești. O. viverrini rămâne o problemă importantă de sănătate publică în zonele endemice din Asia de Sud-Est, unde peste 40 de milioane de persoane sunt infectate [1-3]. Prevalența ridicată a infecției cu O. felineus a fost descrisă pentru Europa de Est (Ucraina și partea europeană a Rusiei), Asia de Nord (Siberia) și Asia Centrală (nordul Kazahstanului) [4]. Cazurile de infecție cu O. felineus par să crească și în Europa de Vest, inclusiv în Italia, Germania și Portugalia [5-7].
Complicațiile opistorhiazei rezultă din obstrucția căilor biliare. Obstrucția căilor biliare intrahepatice poate evolua către colangită piogenă, abces hepatic și hepatită. Ratele crescute de mortalitate după intervenția chirurgicală hepatică sunt observate în timpul infecției cu O. felineus ca o consecință a afectării ficatului și a sistemului biliar asociate cu infecția [8,9]. Mecanismele moleculare care stau la baza modificărilor patologice ale ficatului în timpul opistorhiazei cronice merită o investigație suplimentară.
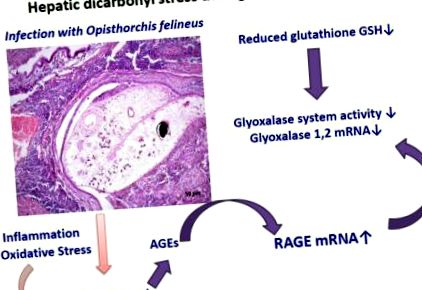
Metabolizarea carbohidraților prin trematode utilizează glicoliza [10]. Metilglioxalul (MGO), un compus dicarbonilic reactiv, este un produs secundar inevitabil al glicolizei. Metabolismul prin afectarea ficatului și metaboliții rezultați nu este singura sursă posibilă de MGO în timpul opistorhiazei. În plus, compușii glicați reactivi, cum ar fi MGO și glioxalul, se pot forma, de asemenea, în timpul stresului oxidativ și al peroxidării lipidelor [11,12] în timpul inflamației asociate opistorhiazei. MGO poate reacționa cu diferite macromolecule (lipide, proteine, acid nucleic), generând produse glicate avansate (AGE). AGE cauzează leziuni prin legarea la receptorii AGE de la suprafața celulei, dintre care cel mai bine caracterizat este RAGE, un receptor pentru produse finale avansate de glicație [13]. Sistemul enzimatic al glioxalazei este compus din glioxalaza 1 (Glo1) și glioxalaza 2 (Glo2); Glo1 neutralizează MGO. În prezența glutationului redus (GSH), MGO formează spontan un hemitioacetal. Glo1 catalizează izomerizarea hemitioacetal în S-D-lactoilglutation, care este, la rândul său, convertită în D-lactat de Glo2 [14-16].
Speculăm că opistorhiaza este asociată cu formarea stresului MGO și carbonilic al ficatului și tractului biliar. Pentru a îmbunătăți înțelegerea acestor sisteme în patogeneza opistorhiazei, aici am investigat aspecte ale sistemului glioxalazei și RAGE în timpul infecției cronice a hamsterilor cu O. felineus.
2 metode
2.1. Materiale
Solvenții de calitate HPLC, glutation (GSH), soluție salină tamponată cu fosfat (PBS), tampon fosfat de sodiu (NaH2PO4) și alte substanțe chimice au fost obținute de la Fisher Scientific (Pittsburgh, PA, SUA); acidul etilaminediaminetetraacetic (EDTA), 5,5'-ditio-bis (acid 2-nitrobenzoic) DTNB, MGO și S-D/L-lactoilglutationa provin de la Sigma-Aldrich (St. Louis, MO, SUA).
2.2. Hamsteri
2.3. Analiza histologică
Țesutul hepatic rezecat a fost fixat în formalină tamponată 10% și încorporat în parafină. Țesutul a fost secționat la o grosime de 4-5 μm, transferat pe lamele de microscop de sticlă și colorat cu hematoxilină și eozină. Secțiunile țesuturilor hepatice colorate au fost examinate la microscopul optic (Axiostar plus, Carl Zeiss).
2.4. Extracție totală de ARN, sinteză de ADNc și primeri PCR
2.5. Glutation
Nivelurile de glutation (și activitățile glioxalazei-1 și -2, mai jos) au fost măsurate în probe de ficat de la fiecare dintre cei 12 hamsteri infectați și șase neinfectați la fiecare dintre 8, 12, 24, 36, 48 săptămâni de infecție. Probele de ficat congelate au fost omogenizate cu 10 volume de fosfat de potasiu 0,1 M răcit cu gheață (pH 7,4) conținând 1% Triton X-100 și lizatul clarificat prin centrifugare la 20.000 g timp de 15 minute la 4 ° C. Nivelurile de glutation (GSH) din supernatant au fost stabilite prin spectrofotometrie, așa cum este descris [18]. GSH reduce DTNB la acidul 5-tionionrobenzoic (TNB), de culoare galbenă. Absorbanta masurata la 412 nm este direct proportionala cu concentratia de GSH. Absorbanța standardelor care variază în concentrație de la 25 la 100 mg/dl GSH a fost determinată pentru a stabili o curbă standard, după care nivelurile de GSH în probele de ficat au fost determinate prin interpolare de la curba standard.
2.6. Glicoxalază-1 și -2 activități în ficat
Activitatea Glo1 a fost măsurată la omogenatele hepatice utilizând o metodă spectrofotometrică [19]. 2,0 mM MGO și 2,0 mM GSH în 50 mM fosfat de sodiu pH 6,6 au fost pre-incubate timp de 10 minute la 37 ° C pentru a forma hemitioacetal. Activitatea Glo1 a fost determinată prin măsurarea formării S-D-lactoilglutationului la 240 nm. Coeficientul de absorbție utilizat pentru formarea S-D-lactoilglutationului a fost de 2,86 mM -1 cm -1. O unitate de activitate a fost definită ca cantitatea de enzimă Glo1 necesară pentru a cataliza formarea a 1 μmol/min de S-D-lactoilglutation.
Activitatea Glo2 a fost testată la 25 ° C în urma creșterii absorbanței datorită hidrolizei S-D-lactoilglutationului, prin titrarea formării GSH în prezența DTNB la 412 nm [20]. Un U de activitate a fost definit ca cantitatea de Glo2 necesară pentru a cataliza hidroliza a 1 μmol/min de S-D-lactoilglutationă.
2.7. analize statistice
Analizele statistice au fost efectuate folosind IBM SPSS Statistics pentru Windows, versiunea 21.0 (Armonk, NY: IBM Corp.). Toți parametrii au fost tratați ca date non-parametrice. Datele au fost raportate ca medii și intervale interquartile. Testul Mann-Whitney a fost utilizat pentru a compara două grupuri de date independente. Valorile P ≤ 0,05 au fost considerate semnificative.
3. Rezultate
3.1. Măsura stabilității (M) a genelor de referință
Folosind geNorm, am analizat trei gene de referință candidate. GAPDH a fost cea mai puțin stabilă genă din ficatul hamsterului în contextul infecției cu O. felineus (date neprezentate). Două gene, ACTB, GUSB, au fost utilizate pentru normalizare.
3.2. Glo1, Glo2, expresie RAGE
La opt săptămâni după infecție, expresia scăzută a ARNm care codifică GLO1 în ficatul de hamster în timpul infecției cu O. felineus a fost evidentă în comparație cu hamsterii de control, neinfectați (P = 0,014). Expresia GLO2 a scăzut la săptămânile 8, 12, 24 și 36 ale infecției, în timp ce expresia RAGE a fost mai mare la ficatul hamsterilor infectați (față de animalele neinfectate) pe parcursul întregului experiment, la fiecare dintre săptămânile 8, 12, 24, 36 și 48 după infecție (Fig. 1).
Analiza expresiei genelor prin PCR cantitativă în timp real (RT-qPCR) a glioxalazei 1 (GLO1) (A) și 2 (GLO2) (B) și a RAGE (C) în ficatul hamsterilor martor și infectați. Cantități relative normalizate calibrate (CNRQ) determinate cu ajutorul software-ului qbase plus. Datele sunt prezentate ca intervale mediane și interquartile. * Diferențe semnificative (P ≤ 0,05) au fost evidente între martor (bare deschise) (n = 6) și grupuri infectate (bare gri) (n = 12).
3.3. Activitatea sistemului glioxalazei
Activitatea Glo1, Glo2 a scăzut la opt și 12 săptămâni după infectare la hamsteri, în timp ce activitatea crescută a Glo1 a fost observată în săptămâna 24 după infecție (P = 0,047). Diferențele în activitatea Glo1 și Glo2 în stadiul târziu al infecției, la săptămânile 36 și 48 după infecție, nu au fost observate în comparație cu hamsterii de control, neinfectați (Fig. 2). MGO este detoxifiat prin sistemul glioxalazei într-o manieră dependentă de GSH și, în consecință, am analizat nivelurile de GSH. Nivelurile GSH hepatice au fost mai mici la hamsterii infectați la opt săptămâni după infecție (Fig. 3).
Activitățile enzimei hepatice ale Glo1 (A) și Glo2 (B). Datele sunt prezentate ca intervale mediane și interquartile. * Diferențe semnificative (P ≤ 0,05) între control (bare deschise) (n = 6) și grupul infectat (bare gri) (n = 12).
Concentrația de glutation hepatic (GSH). Datele sunt prezentate ca intervale mediane și interquartile. * Diferențe semnificative evidente (P ≤ 0,05) între control (bare deschise) (n = 6) și grupurile infectate (bare gri) (n = 12).
3.4. Modificări histopatologice
Modificările patologice nu au fost evidente la ficatul de hamsteri martori în perioada de studiu. În schimb, leziunile majore la hamsteri erau evidente la opt săptămâni după infecție. Acestea au inclus colangita, dilatarea căilor biliare, hiperplazia mucoasei și infiltrarea limfoplasmacitică. Mai mult, proliferarea ductulelor biliare a fost pronunțată atât la 12, cât și la 24 de săptămâni după infecție. Constatările histopatologice după 36 de săptămâni de infecție au relevat hiperplazia epiteliului căii biliare cu metaplazie a celulelor calice. Fibroza periductală cu colangită a fost evidentă începând cu 24 săptămâni de infecție. Figura 4 prezintă micrografii reprezentative ale histopatologiei induse de opisthorhiasis, împreună cu imaginea de control de la hamsterul de control neinfectat. Deși alții au raportat ocazional leziuni precanceroase sau chiar colangiocarcinom la hamsterii rozătoarelor după infecția cronică [21], nu am observat nicio masă tumorală care nu a fost observată la acești hamsteri cu infecții de lungă durată.
Analiza histologică a țesuturilor hepatice de hamster (A) ficatul de control (8 săptămâni); (B) ficatul hamsterului infectat la 8 săptămâni de la infecție; bar = 50 μm; (C) ficatul hamsterului infectat la 8 săptămâni de la infecție; bar = 100 μm; (D) ficatul hamsterului infectat la 24 de săptămâni după infecție; bar = 100 μm; (E) ficatul hamsterului infectat la 36 de săptămâni după infecție; bar = 100 μm; (F) ficatul hamsterului infectat la 48 de săptămâni după infecție; bar = 100 μm. Repere anatomice și patologice reprezentative sunt indicate, după cum urmează, cu numerele de adnotare de pe micrografii: 1. Venă, hamster neinfectat; 2. Canal biliar, hamster neinfectat; 3. Fluke hepatic (vierme adult) care se află în lumenul căii biliare la opt săptămâni după infecție; 4. Colangita; 5. Dilatarea căii biliare și a hiperplaziei mucoasei; 6. Infiltrarea peri-biliară difuză de către celulele mononucleare polimorfe cu eozinofile; 7. Fibroza periductală; 8. Proliferarea conductelor biliare (model de punte).
4. Discutie
Aici am descris fenomenele de stres carbonilic în timpul infecției cronice a hamsterilor cu O. felineus. Expresia GLO1 a scăzut la a opta săptămână de infecție și activitatea catalitică a scăzut la 8 și 12 săptămâni după infecție, iar expresia GLO2 a scăzut până la 36 de săptămâni după infecție, ceea ce a fost asociat cu scăderea activității enzimei la 8 și 12 săptămâni după infecție . Nivelurile de GSH în ficatul infectat scăzuseră în săptămâna 8 de infecție, în timp ce nivelul de ARN RAGE a crescut în mod vizibil în timpul infecției experimentale cu o durată de aproximativ un an. Aceste constatări amintesc de situația din timpul schistosomiazei: nivelurile GSH cresc în plămâni și splină la 4 și 6 săptămâni, dar scad la 8-10 săptămâni după infecția cu Schistosoma haematobium. Depleția nivelurilor de GSH a fost observată și în vezice la 8 și 10 săptămâni după infecție [22].
Pe baza acestor constatări, speculăm că există stres dicarbonilic în ficat în timpul opistorhiazei cronice. Stresul dicarbonilic poate fi un mediator al obezității și rezistenței la insulină [36], iar stresul carbonilic este cunoscut că joacă un rol major în patogeneza diabetului [12]. Există dezbateri cu privire la relația dintre diabetul zaharat și dezvoltarea colangiocarcinomului la persoanele infectate cu afectarea hepatică asociată, O. viverrini [37]. În concluzie, inhibarea sistemului glioxalazei și acumularea de MGO în stadiile incipiente ale infecției cu aceste afecțiuni hepatice reprezintă un mecanism care ar putea duce la apariția rezistenței la insulină în timpul opistorhiazei.
Repere
Infecția hamsterilor cu Opisthorchis felineus indusă de formarea metilglioxală hepatică și stres carbonilic
La începutul infecției cronice, glutationul hepatic a fost găsit scăzut, dar mai târziu a revenit la niveluri normale
Infecția a inhibat temporar sistemul glioxalazei, în timp ce nivelul de ARN RAGE a fost în mod constitutiv crescut
- Efectele benefice ale restricției dietetice a carbohidraților în cortexul pulmonar cronic - ScienceDirect
- Antibiotice pentru infecția rănilor - PlushCare
- Efect benefic pe termen scurt al dietei cu conținut scăzut de proteine asupra bolilor renale cronice pro-gresie la pacienți
- Cel mai bun ulei de CBD pentru anxietate, depresie și observator al stresului
- 5 sfaturi despre stilul de viață pentru a trăi cu leucemie mieloidă cronică (LMC) - Unde sănătate; Culture Connect